等位基因特异性PCR检测CYP3A5和MDR-1基因多态性方法的建立及临床应用*
吴洁,侯佳展,程倩,李佳垚,李丹丹,尹逸丛,苏薇
(中国医学科学院北京协和医院检验科,北京 100730)
·临床检验技术研究·
等位基因特异性PCR检测CYP3A5和MDR-1基因多态性方法的建立及临床应用*
吴洁,侯佳展,程倩,李佳垚,李丹丹,尹逸丛,苏薇
(中国医学科学院北京协和医院检验科,北京 100730)
目的用等位基因特异性PCR(ARMS-PCR)检测细胞色素P450酶CYP3A5(A6986G) 和多药耐药基因MDR-1(C3435T)基因多态性,探讨其与肾移植受者他克莫司(Tac)血药浓度和剂量比的相关性。方法根据CYP3A5(A6986G) 和MDR-1(C3435T)基因多态性位点分别设计ARMS-PCR引物,分析72例肾移植受者外周血基因组DNA中该2个基因位点的多态性,同时以DNA测序法为金标准进行验证。化学发光微粒子免疫分析法测定肾移植受者血Tac浓度,并比较术后1个月时不同基因型受者之间血Tac浓度、Tac剂量/Tac用量的差异。结果建立的ARMS-PCR法与DNA测序法检测符合率为100%。72例肾移植受者中,CYP3A5 *1/*1、*1/*3和*3/*3基因型的发生频率分别为18.1%、31.9%和50.0%,MDR-1 C/C、C/T和T/T基因型的发生频率分别为27.8%、58.3%和13.9%。此外,不同CYP3A5基因型肾移植受者的血Tac浓度(P=0.014)和Tac浓度/Tac用量(P=0.019)均存在明显差异,进一步两两比较发现,CYP3A5 *3/*3基因型受者血Tac浓度/Tac用量明显高于*1/*1和*1/*3基因型(P均<0.05)。结论成功建立检测CYP3A5和MDR-1基因多态性的ARMS-PCR法,肾移植受者CYP3A5*3基因多态性与Tac的药代动力学明显相关。
等位基因特异性PCR;细胞色素P450酶CYP3A5;多药耐药基因MDR-1;基因多态性
他克莫司(Tac)是钙调神经磷酸酶抑制剂(CNI)家族的成员,以Tac为基础的免疫抑制药物已广泛应用于临床器官移植后抗排斥反应。然而,Tac的药物治疗窗窄,且生物利用度个体差异大[1],临床往往需要根据血药浓度来调整用药剂量。此外,药物相关的副作用,如肾毒性,神经毒性和高血糖,会明显降低移植后受体的生存质量[2]。因此,移植后尽快达到所需的Tac血药浓度对于避免排斥或过度免疫抑制,从而限制剂量相关不良反应至关重要。研究表明,药物代谢酶细胞色素P450CYP3A5基因A6986G(CYP3A5 * 3)多态性和多药耐药基因MDR-1的C3435T多态性可影响Tac在不同受者体内的吸收和代谢[3-5]。本研究旨在建立等位基因特异性PCR(ARMS-PCR)法检测CYP3A5基因A6986G和MDR-1基因C3435T单核苷酸多态性,并探讨这2个多态性位点与肾移植后受者血Tac浓度和剂量比的相关性,以期指导临床用药。
1 研究对象与方法
1.1研究对象 选取2013年9月至2016年9月接受肾移植受者72例,男32 例,女40 例,年龄(38.0±13.9)岁。纳入标准:(1)没有同时接受其他任何移植;(2)受体术后均使用含有Tac+激素的免疫抑制方案;(3)未使用与Tac有相互作用的药物,且术后未发生排斥反应。排除标准:患有严重心、肝、造血系统、神经系统疾病,或患有吸收不良综合征、胃肠切除术后等影响药物吸收的受者。
1.2主要仪器及试剂 i2000全自动免疫分析仪(美国雅培公司),Multiskan GO核酸分析仪(美国Thermo公司),T100基因扩增仪(美国伯乐公司),DYY-6C电泳仪(北京六一公司),血液基因组DNA提取试剂盒(批号:DP348,北京天根公司),NewBioIndustry 2×NI-Taq PCR Master Mix(批号:303102,天津沙船公司)。
1.3血Tac浓度检测 术后1个月时,在受者服药后12 h(即下一次服药前),采集受者空腹静脉全血5 mL, EDTA-K2抗凝,取200 μL用于血Tac浓度检测,剩余全血置-80 ℃保存,用于基因多态性检测。用全血化学发光微粒子免疫分析法测定血Tac浓度(ng/mL),同时统计Tac用量(为每天每千克体重的用药量,mg/kg/d),最后计算Tac血药浓度和剂量比(即血Tac浓度/Tac用量),通过比较浓度剂量比来分析不同基因型受者对Tac药物代谢情况的差异。
1.4CYP3A5和MDR-1单核苷酸多态性检测
1.4.1基因组DNA提取 取200 μL EDTA-K2抗凝外周血,按照血液基因组DNA提取试剂盒说明书操作提取基因组DNA,50 μL TE缓冲液洗脱。用GO核酸分析仪测定提取DNA的浓度和纯度,取浓度在50~200 ng/μL,A260/280 nm比值在1.8~2.0之间的样本用于后续实验,置-20 ℃保存。
1.4.2引物的设计 参照GenBank中CYP3A5和MDR-1基因序列,使用Primer Premier 5.0软件设计等位基因特异性PCR引物,针对CYP3A5(rs776746)和MDR-1(rs1045642)多态性位点分别各设计2对特异性引物,用以鉴别CYP3A5(A6986G)的3种基因型(AA型即*1/*1野生型,AG型即*1/*3杂合型,GG型即*3/*3突变型) 和MDR-1(C3435T)的3种基因型(C/C野生型,C/T杂合型,T/T突变型)。引物序列见表1,所有引物均由Invitrogen公司合成。
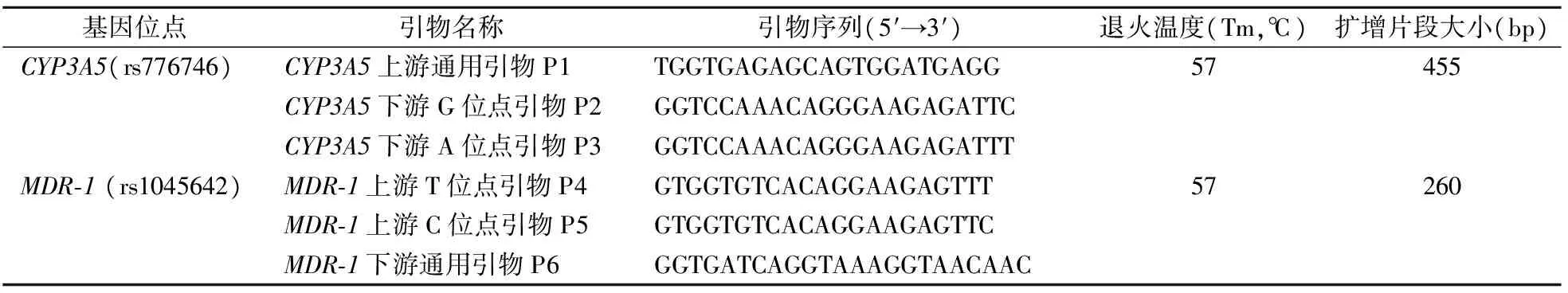
表1 CYP3A5和MDR-1基因多态性分型等位基因特异性PCR引物
1.4.3等位基因特异性PCR(ARMS-PCR)扩增 每个样本分为A管和B管, PCR扩增体系均为20 μL。A管中加入引物P1+P2+P4+P6,各0.5 μL,B管中加入引物P1+P3+P5+P6,各0.5 μL。此外,每管加入10 μL 2×NI-Taq PCR Master Mix,1 μL 基因组DNA和7 μL ddH2O。PCR反应条件:95 ℃预变性5 min;95 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s,35次循环;72 ℃延伸5 min。PCR产物经含0.5 mg/L溴化乙锭的15 g/L琼脂糖凝胶电泳,并采用凝胶成像系统进行图像分析。
1.4.4基因型判读 取6 μL PCR产物,在含0.5 mg/L溴化乙锭(EB)的15 g/L琼脂糖凝胶中电泳,采用凝胶成像系统分析CYP3A5(A6986G)和MDR-1(C3435T) 位点基因型。对于同一位点,如果仅A管出现扩增产物,则判定该位点为突变型,如果仅B管出现扩增产物,则判定该位点为野生型,如A管和B管中均出现扩增产物,则为杂合子。
1.4.5DNA测序验证 将上述72例经ARMS-PCR法检测的DNA样本的PCR产物送至北京天一辉远公司,通过基因测序验证ARMS-PCR法的可靠性。
2 结果
2.1肾移植受者CYP3A5和MDR-1基因型检测结果 分别用ARMS-PCR法和基因测序法对72例肾移植受者标本CYP3A5(A6986G) 和MDR-1(C3435T)基因型进行检测,两种方法检测符合率均为100%(图1~2)。72例肾移植受者中,CYP3A5 *1/*1、*1/*3和*3/*3基因型的发生频率分别为18.1%、31.9%和50.0%,MDR-1 C/C、C/T和T/T基因型的发生频率分别为27.8%、58.3%和13.9%。CYP3A5和MDR-1等位基因分布频率比较的χ2分别为3.029和1.230,P值分别为0.220和0.541,等位基因分布均符合Hardy-Weinberg平衡。CYP3A5和MDR-1不同基因型之间年龄、性别组成无明显性差异。见表2。
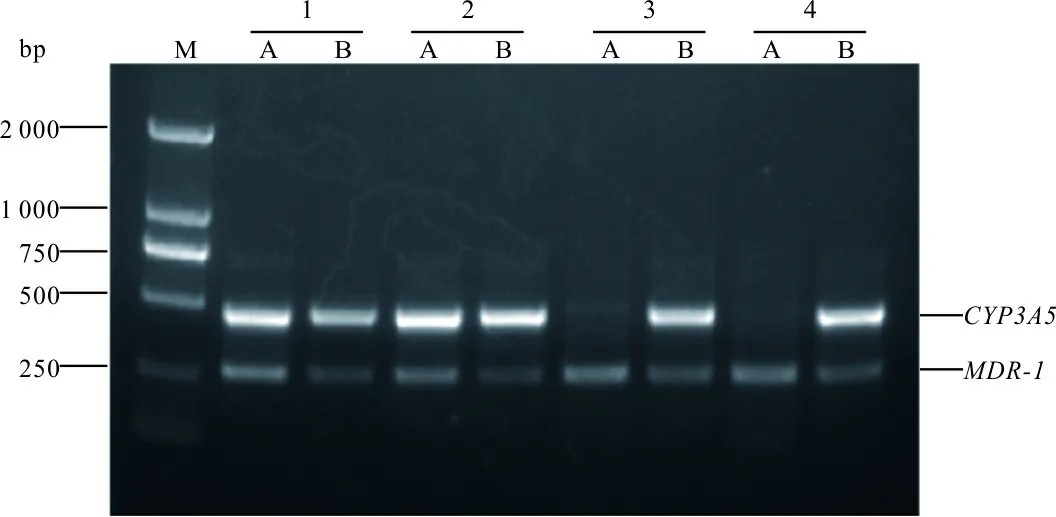
注:标本1和2为CYP3A5*1/*3&MDR-1 C/T基因型,标本3和4为CYP3A5*1/*1&MDR-1 C/T基因型。
图1 等位基因特异性PCR检测4例肾移植受者CYP3A5(A6986G) 和MDR-1(C3435T)多态性结果
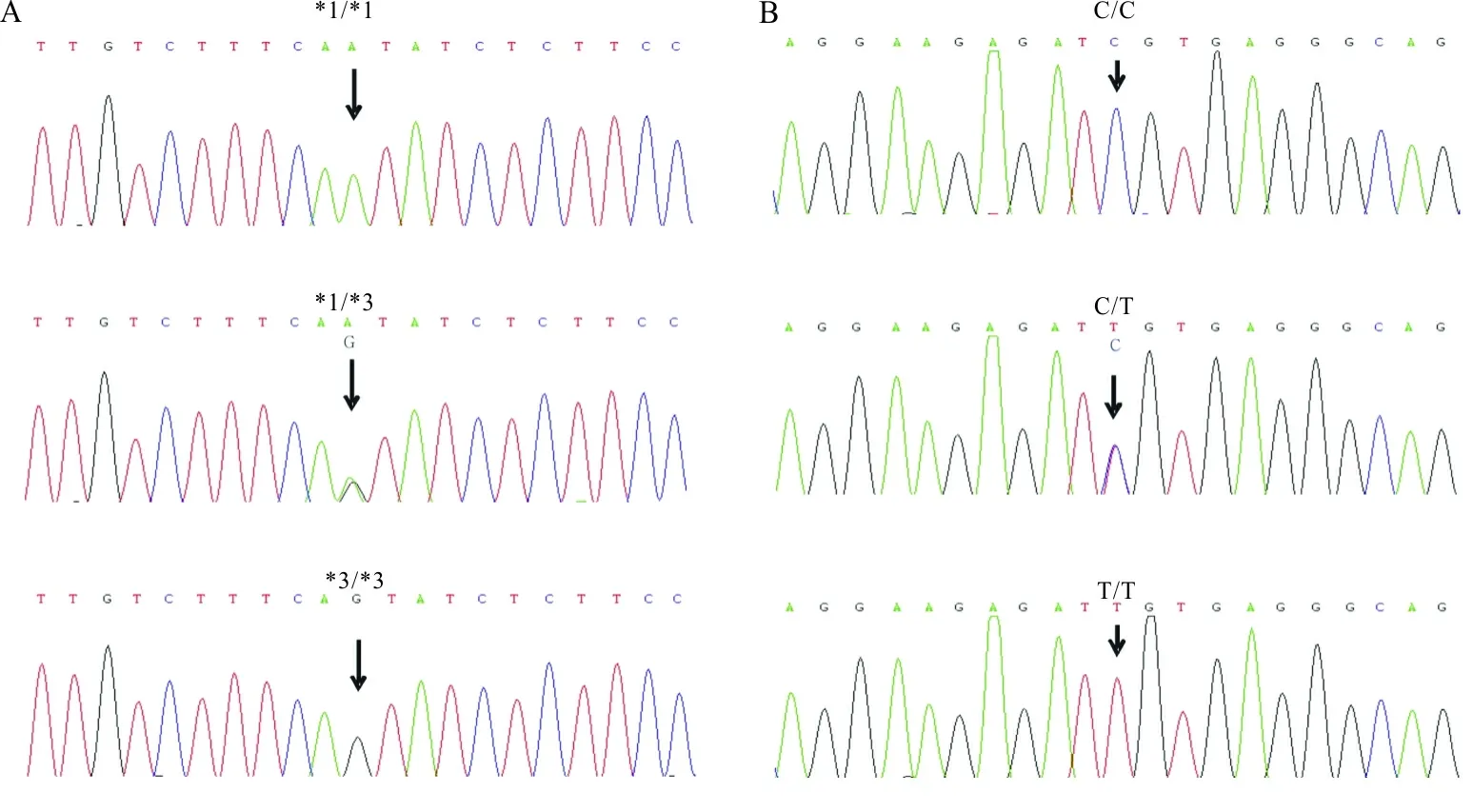
注:A,CYP3A5 A6986G基因型;B,MDR-1 C3435T基因型;箭头示突变位点。
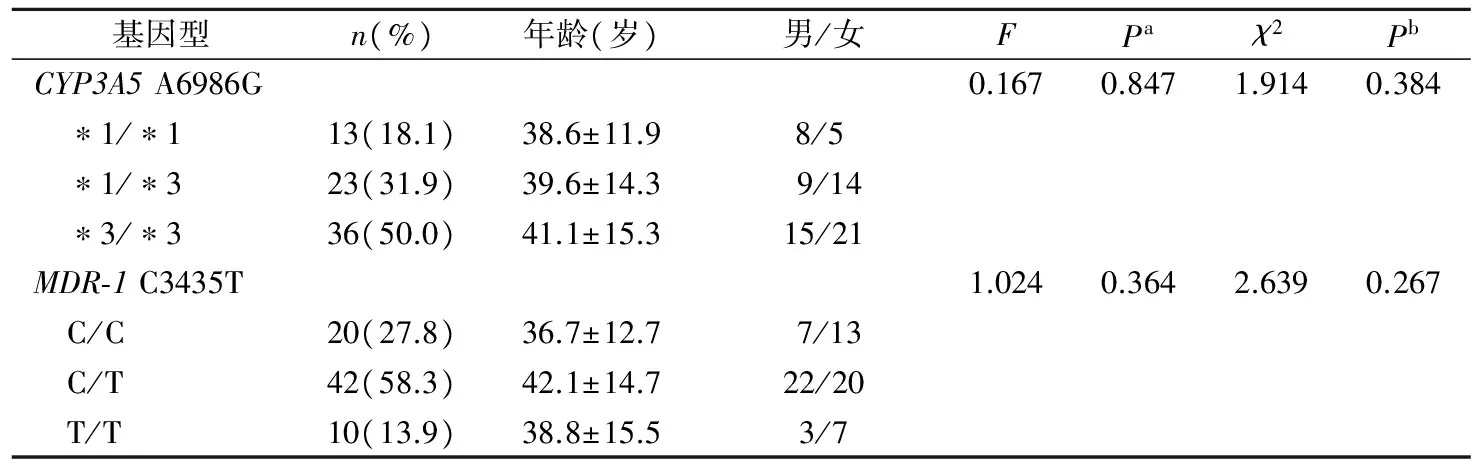
图2 DNA测序检测CYP3A5(A6986G)和MDR-1(C3435T)多态性结果
注:Pa,不同基因型间年龄比较;Pb不同基因型间性别比较。
2.2CYP3A5基因型和MDR-1基因型对Tac血药浓度和剂量比的影响 术后1个月,不同CYP3A5基因型和MDR-1基因型的肾移植受者的Tac血药浓度、Tac用量及两者比值见表3。不同CYP3A5基因型间血Tac浓度(P=0.014)和Tac浓度/Tac用量(P=0.019)均存在明显差异。进一步两两比较发现,CYP3A5 *3/*3基因型受者血Tac浓度/Tac用量明显高于*1/*1和*1/*3基因型受者,差异有统计学意义(P均<0.05),而CYP3A5 *1/*1和*1/*3基因型受者之间则无明显差异(P>0.05)。MDR-1 C/T和T/T基因型受者血Tac浓度/Tac用量高于C/C基因型受者,但差异均无统计学意义(P>0.05)。
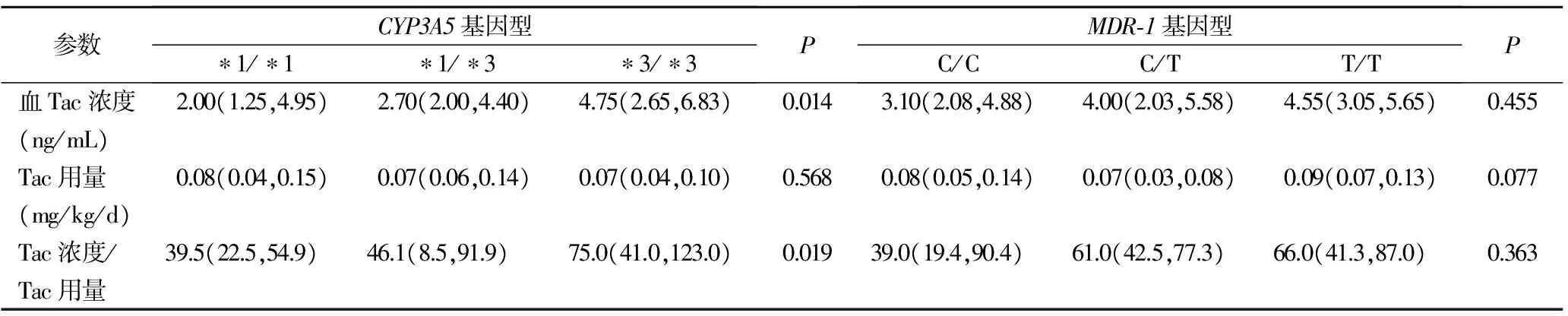
表3 不同CYP3A5和MDR-1基因型的肾移植受者血Tac浓度与Tac用量比[M(P25,M75)]
3 讨论
单核苷酸多态性(single nucleotide polymorphism,SNP)是在基因组水平上由单个核苷酸的变异所引起的DNA序列多态性。目前认为CYP3A5和MDR-1基因的SNP与Tac在体内的代谢和吸收相关。DNA测序是检测SNP的金标准,但所需仪器设备成本较高,且耗时较长,难以在一般实验室及基层医院普及。本研究建立了一种较为简便的ARMS-PCR方法,通过A,B管的同步多重PCR反应和琼脂糖凝胶电泳分析,即可实现同时对CYP3A5(A6986G) 和MDR-1(C3435T)基因多态性位点的判定。分别用该方法和测序法对72例肾移植受者标本该2个基因多态性位点进行检测,2种方法检测符合率达100%,说明此ARMS-PCR方法是可靠的。
CYP3A5基因的第3内含子A6986G的SNP会引起CYP3A5蛋白功能差异。野生型等位基因CYP3A5*1(A6986)可产生功能性蛋白质,突变型等位基因CYP3A5*3(6986G)因提前形成终止密码而产生无正常功能的蛋白质。多项研究[6-8]表明,不论是移植患者还是其他免疫疾病用药患者,当服用同等剂量的Tac时,携带*3等位基因患者的血药浓度比携带*1等位基因患者明显升高。本研究结果也证实*3/*3基因型受者血药浓度与剂量比(C/D)最高,*1/*3基因型其次,*1/*1基因型最低。本研究发现CYP3A5 *1/*1、*1/*3和*3/*3基因型的发生频率分别为18.1%、31.9%和50.0%,CYP3A5 *3/*3是发生率最高的基因型。另一项对194名肾移植受者中的研究也得到了与本研究相类似的结果,其发现CYP3A5*1/*1, *1/*3和*3/*3等位基因的发生频率分别为 7.7%, 44.8%和 47.4%[9]。一项荟萃(Meta)分析表明,CYP3A5 6986A> G多态性可影响Tac的药代动力学和肾移植受者的急性排斥反应和慢性肾毒性的发生[10],因此,在肾移植前对患者进行该位点的检测可预测发生Tac相关并发症的风险。
目前,关于MDR-1 SNPs包括26外显子C3435T对Tac药代动力学的影响仍然存在争议。Ciftci等[5]的研究表明,含有纯合突变TT基因型患者的Tac C/D值高于野生CC基因型患者。本研究发现MDR-1(C3435T) T/T和C/T基因型受者血药浓度与剂量比C/D高于C/C基因型受者,T/T基因型最高,C/T基因型次之,但差异无统计学意义。考虑到本研究纳入例数较少,因此结果还需要在更大的患者群体中进一步验证。另外,本研究仅针对包括CYP3A5和MDR-1的2个位点的多态性进行分析,目前已报道的与Tac吸收和代谢相关的还有其他的多态性位点。如有学者报道供体MDR-1 C3435T多态性是Tac治疗肾移植受者肾小球滤过率的决定因素[11],故而仍需进一步研究证实。综上所述,本研究结果表明,通过ARMS-PCR肾移植受体CYP3A5和MDR-1基因SNP进行检测将有助于医师调整Tac剂量。当CYP3A5和MDR-1杂合子或纯合突变基因型患者进行肾移植时,可以在移植后以较低的Tac剂量进行管理。
[1]Tang JT, Andrews LM, van Gelder T,etal. Pharmacogenetic aspects of the use of tacrolimus in renal transplantation:recent developments and ethnic considerations[J]. Expert Opin Drug Metab Toxicol, 2016, 12(5):555-565.
[2]Shi Y, Li Y, Tang J,etal. Influence ofCYP3A4,CYP3A5 andMDR-1 polymorphisms on tacrolimus pharmacokinetics and early renal dysfunction in liver transplant recipients[J]. Gene, 2013, 512(2):226-231.
[3]Soda M, Fujitani M, Michiuchi R,etal. Association between tacrolimus pharmacokinetics and cytochrome P450 3A5 and multidrug resistance protein 1 exon 21 polymorphisms[J]. Transplant Proc, 2017, 49(6):1492-1498.
[4]Zong YP, Wang ZJ, Zhou WL,etal. Effects ofCYP3A5 polymorphisms on tacrolimus pharmacokinetics in pediatric kidney transplantation:a systematic review and meta-analysis of observational studies[J]. World J Pediatr, 2017. doi: 10.1007/s12519-017-0035-4. [Epub ahead of print].
[5]Ciftci HS, Ayna TK, Caliskan YK,etal. Effect ofMDR1 polymorphisms on the blood concentrations of tacrolimus in Turkish renal transplant patients[J]. Transplant Proc, 2013, 45(3):895-900.
[6]Ito A, Okada Y, Hashita T,etal. Sex differences in the blood concentration of tacrolimus in systemic lupus erythematosus and rheumatoid arthritis patients withCYP3A5*3/*3[J]. Biochem Genet, 2017, 55(3):268-277.
[7]Kato H, Usui M, Muraki Y,etal. Long-Term influence ofCYP3A5 gene polymorphism on pharmacokinetics of tacrolimus and patient outcome after living donor liver transplantation[J]. Transplant Proc, 2016, 48(4):1087-1094.
[8]Niioka T, Kagaya H, Saito M,etal. Impact of theCYP3A5 genotype on the distributions of dose-adjusted trough concentrations and incidence of rejection in Japanese renal transplant recipients receiving different tacrolimus formulations[J]. Clin Exp Nephrol, 2017. doi: 10.1007/s10157-016-1375-4. [Epub ahead of print].
[9]Chen P, Li J, Li J,etal. Dynamic effects ofCYP3A5 polymorphism on dose requirement and trough concentration of tacrolimus in renal transplant recipients[J]. J Clin Pharm Ther, 2017, 42(1):93-97.
[10]Rojas L, Neumann I, Herrero MJ,etal. Effect ofCYP3A5*3 on kidney transplant recipients treated with tacrolimus:a systematic review and meta-analysis of observational studies[J]. Pharmacogenomics J, 2015, 15(1):38-48.
[11]Tavira B, Gomez J, Diaz-Corte C,etal. The donorABCB1(MDR-1) C3435T polymorphism is a determinant of the graft glomerular filtration rate among tacrolimus treated kidney transplanted patients[J]. J Hum Genet, 2015, 60(5):273-276.
2017-07-26)
(本文编辑:许晓蒙)
Establishmentofallele-specificPCRforthedetectionofCYP3A5andMDR-1genepolymorphismsanditsclinicalapplication
WUJie,HOUJia-zhan,CHENGQian,LIJia-yao,LIDan-dan,YINYi-cong,SUWei
(DepartmentofClinicalLaboratory,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollegeHospital,Beijing100730,China)
ObjectiveTo establish an allele-specific PCR method for the detection of cytochrome P-450CYP3A5 (A6986G) and multidrug resistance geneMDR-1 (C3435T) polymorphisms, and investigate the correlations of their polymorphisms with blood tacrolimus (Tac) concentration/dose (C/D) ratio in renal transplant recipients.MethodsThe allele-specific PCR primers were designed according to the polymorphism sites ofCYP3A5 (A6986G) andMDR-1 (C3435T) genes. Then, their polymorphisms in the genomic DNA of peripheral blood samples from 72 renal transplant recipients were analyzed, and the results were validated by DNA sequencing. The blood Tac concentration was determined by the chemiluminescence microparticle immunoassay and the differences of concentration, dose and C/D ratio of blood Tac in renal transplant recipients with different genotypes were compared at 1 month after transplantation.ResultsThe coincidence rate between the established allele-specific PCR and DNA sequencing was 100%. The frequencies ofCYP3A5 *1/*1, *1/*3 and *3/*3 genotypes in 72 renal transplant recipients were 18.1%, 31.9% and 50.0%, respectively, and those ofMDR-1 C/C, C/T and T/T genotypes were 27.8%, 58.3% and 13.9%, respectively. There were significant differences in blood Tac concentration (P=0.014) and Tac C/D ratio (P=0.019) between differentCYP3A5 genotypes of renal transplant recipients. Further analysis found that the Tac C/D ratio ofCYP3A5 *3/*3 genotype was significantly higher than that ofCYP3A5 *1/*1 and *1/*3 genotypes (P<0.05).ConclusionThe allele-specific PCR method for the detection ofCYP3A5 andMDR-1 polymorphisms is successfully established and the polymorphism ofCYP3A5 *3 gene in renal transplant recipients is obviously correlated with the pharmacokinetics of Tac.
allele-specific PCR; cytochrome P-450CYP3A5; multidrug resistance gene; gene polymorphism
10.13602/j.cnki.jcls.2017.11.11
国家自然科学基金项目(81301508)。
吴洁,1982年生,女,副研究员,博士,主要从事疾病分子诊断和标志物筛选研究。
苏薇,副研究员,大学本科,E-mail:suwei_64@163.com。
R446
A

