镇江地区诺如病毒分子流行病学特点及基因型分析*
许金凤,徐虹,宋寅生,薛渊,邵世和,申红星
(1.江苏大学医学院,江苏镇江 212013;2.镇江市疾病预防控制中心检验科,江苏镇江 212000)
·研究生园地·
镇江地区诺如病毒分子流行病学特点及基因型分析*
许金凤1,2,徐虹2,宋寅生2,薛渊2,邵世和1,申红星1
(1.江苏大学医学院,江苏镇江 212013;2.镇江市疾病预防控制中心检验科,江苏镇江 212000)
目的分析2015-2016年镇江地区诺如病毒(NoV)的分子流行病学特点及基因型分布。方法收集镇江地区腹泻患者粪便标本,逆转录PCR(RT-PCR)检测NoV衣壳蛋白基因的表达水平,并对PCR产物行基因测序验证; Mega软件构建系统进化树,并进行序列进化和基因型分析。结果NoV总阳性率为5.30%(85/1 605),GⅠ组检出率为0.87%(14/1 605),GⅡ组检出率为4.55%(73/1 605),其中2份样本同时检出感染GⅠ/GⅡ。GⅡ组在10~20岁组中的阳性率最高(17.80%)。2015年NoV的检出率以1月最高,11月、2月次之;2016年以12月最高,3月、4月次之。2015年NoV的基因型以新GII.17型变异株为主(63.89%),2016年以GII.4 Sydney_2012株为主(35%)。结论镇江地区的NoV以GII组为主,青少年患者阳性率高,主要流行季节为11月至次年4月,主要流行基因型为GII.17型变异株和GII.4 Sydney_2012株。
诺如病毒;分子流行病;基因型
诺如病毒(Norovirus, NoV)属于杯状病毒家族,是引起非细菌性胃肠炎的重要原因之一[1]。目前,NoV已逐渐成为导致世界范围内人群腹泻的主要原因[1]。NoV病毒存在地区及人群的差异性[2-3],为充分了解镇江地区肠道NoV感染的分子流行病学特征及基因型状况,本研究采集了2015-2016年的镇江地区腹泻人群的标本及临床信息,并进行检测和序列测定等分析,以期探究其分子流行病学特点及基因型分布。
1 材料与方法
1.1样本采集 收集2015年1月至2016年12月镇江地区5家食源性疾病哨点医院的病例样本以及各区疾控中心检验科室采集的突发公共卫生事件的病例样本共1 605份(其中2015年832份,2016年773份),均为以腹泻为主的就诊病例。腹泻是指每日排便3次或3次以上,且粪便性状异常,如稀便、水样便、粘液便或脓血便等。纳入标准依据卫生部食源性疾病诊断技术规范研讨会规定的《食源性疾
病诊断标准和规范》的定义。研究对象均来自镇江及周边地区。
1.2主要试剂与仪器 DL 2000 DNA Marker (批号A20018)、10×Loading buffer(批号A8401A)、PrimeScriptTMone step RT-PCR Kit Ver.2 (批号AK3802)均购自日本TaKaRa公司;High Pure Viral RNA kit(批号11696800,德国Roche公司);诺如病毒GI/GⅡ核酸检测试剂盒(批号20150402,江苏硕世公司);Biowest琼脂糖(批号122015,西班牙Biowest公司);Gelred核酸染料(批号150520,上海辉睿公司);ABI 7500 PCR仪(美国Applied Biosystems公司);凝胶电泳仪及Gel Doc XR+凝胶成像系统(美国Bio-Rad公司);PL303电子天平(美国Mettler toledo公司)。
1.3临床样本采集及RNA抽提 制备粪便悬液:将0.1 g固体粪便标本或100 μL液体粪便标本加至1.5 mL Eppendorf管或2 mL螺口管中,加入1 mL无核酶ddH2O,置于漩涡震荡器震荡3次,每次10 s,静置10 min,再以8 000 r/min离心5 min,上清液置-70 ℃保存。取上清标本200 μL,按照High Pure Viral RNA Kit说明书操作提取样本RNA核酸,置于-70 ℃保存。
1.4引物序列 根据参考文献[4]设计引物,并送上海生工公司合成。引物序列见表1。

表1 NoV的RT-PCR扩增引物序列
注:所用的兼并碱基代码B=G/C/T, H=A/C/T, N=A/G/C/T, R=A/G, Y=C/T。
1.5实时荧光定量PCR反应(qRT-PCR)及逆转录PCR反应(RT-PCR)
1.5.1qRT-PCR检测NoV GⅠ/GⅡ的表达 以提取保存的样本RNA为模板,进行qRT-PCR扩增反应,RT-PCR反应总体系为25 μL,包括RT-PCR反应液7.5 μL,酶混合液(主要成分为逆转录酶、RNA酶抑制剂、Taq酶)5 μL,NoV GⅠ/GⅡ反应液4 μL,DEPC处理H2O 3.5 μL,RNA模板5 μL。PCR循环参数:50 ℃逆转录30 min;95 ℃ 5 min;95 ℃,10 s,55 ℃退火、延伸40 s,45个循环。用PCR 2.0.6软件在55 ℃时收集荧光信号并检测,荧光检测通道为FAM和VIC。结果判读:Ct值≤35,曲线呈S型且有明显指数增长期判断为NoV GI组或GII组阳性,Ct值>38或未检出,判断为阴性。
1.5.2RT-PCR检测ORF2区VP1基因的表达 RT-PCR总反应体系为50 μL,包括PrimeScript 1 Step Enzyme Mix 2 μL,2×1 Step Buffer 25 μL,10 μmol/L GI/GII上、下游引物各2 μL, RNA 5 μL,无RNA酶ddH2O 14 μL。循环参数:50 ℃ 30 min;94 ℃ 2 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 40 s,30个循环。特异性片段经15 g/L琼脂糖凝胶电泳,并用Gel Doc XR+凝胶成像系统扫描并拍照。结果判读:GI组阳性为在330 bp处有特异性条带,GII组阳性为在387 bp处有特异性条带。
1.6序列测定及进化树分析 取1.5.2中PCR阳性扩增产物,送上海生工公司进行序列测定,测序结果用Mega软件Clustal W方法进行序列比对,并提交到NoV基因分型网站(http://www.rivm.nl/mpf/norovirus/typingtool/)[5]进行基因分型。用Mega 6.06软件及邻近归并法(Neighbor-joining, N-J)构建核苷酸系统进化树,用bootstrap 1000检验评价进化树的可靠性。用于系统发生树分析的NoV参考序列均来自于GenBank数据库。
1.7统计学分析 采用Excel 2003及SPSS 16.0统计软件进行。率的比较用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1病毒感染的分布情况 qRT-PCR检测结果表明,NoV总体阳性率为5.30%(85/1 605),其中GI组检出率为0.87%(14/1 605),GII组检出率为4.55%(73/1 605),两组间差异有统计学意义(χ2=41.13,P<0.05)。此外,另有2份样本同时感染GⅠ/GⅡ组。分层分析结果表明,男性感染NoV的阳性率为6.26%(52/831),女性阳性率为4.26%(33/774),两组间差异无统计学意义(χ2=3.18,P>0.05)。GⅡ组感染者以10~20岁的阳性率最高(17.80%),GⅠ组感染者以30~40岁组的阳性率最高(1.64%)。见表2。
2.2NoV感染月份分布情况 2015年共检测832份样本,NoV阳性率为5.05%,除12月份无样本检测外,其他各月份均有NoV的检出,以1月份的阳性率最高(25.0%,3/12),其次为11月(14.63%,6/14)和2月(占比为12.50%,1/8)。2016年共检测773份样本,NoV阳性率为5.56%,以12月份的阳性率最高(75.0%,3/4),其次为3月(26.67%,4/15)和4月(21.15%,11/52)。
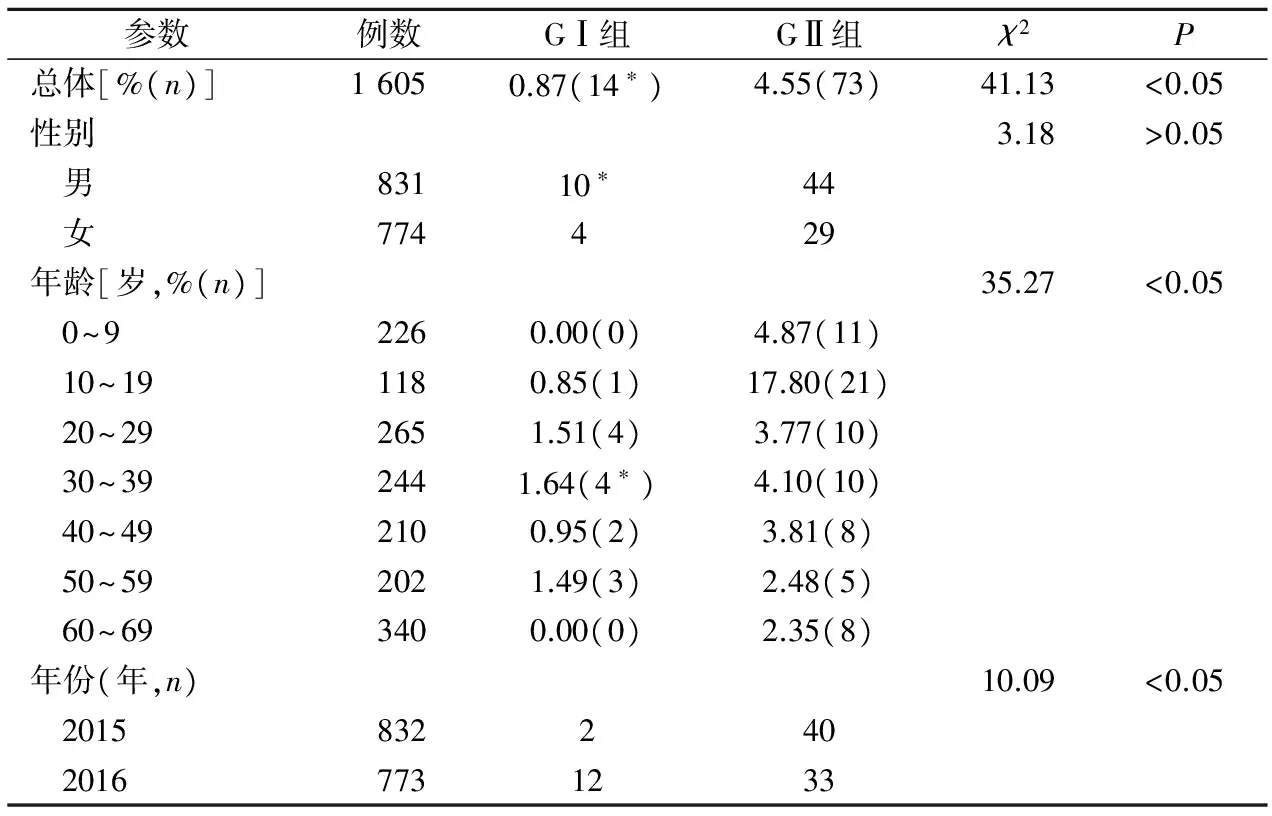
表2 NoV感染的分布情况
注:*,表示同时感染NoV GⅠ/GⅡ组。
2.3NoV基因型分布情况 经NoV基因分型分析,2015年的基因型别为GI.、GII.3、GII.4 Sydney_2012、GII.13、GII.17,其中新GII.17型变异株所占比例最高为63.89%。2016年的基因型别为GI.3-GI.8、GII.2、GII.3、GII.4 Sydney_2012、GII.14、GII.17,其中GII.4 Sydney_2012型占比最高,为35%。见表3。
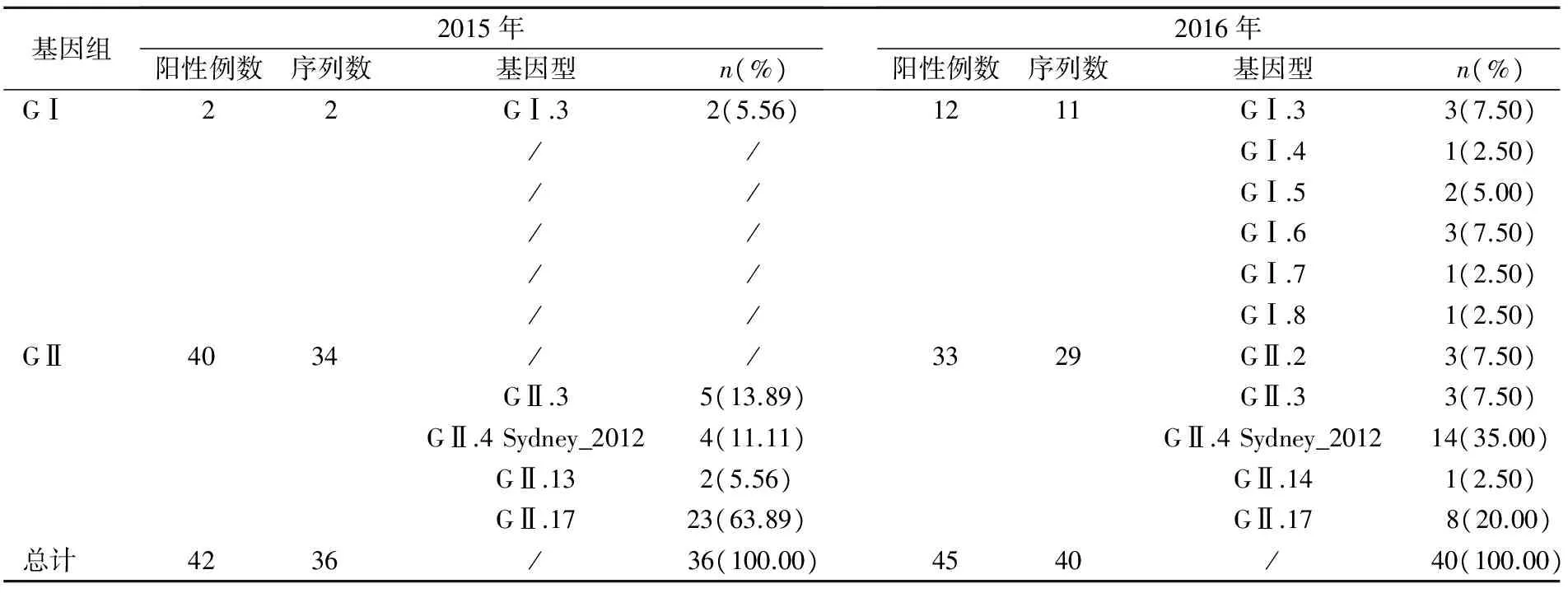
表3 镇江地区2015-2016年NoV基因型分布
2.4NV GⅠ/GⅡ组进化树分析结果 GI组capsid(ORF2)区构建的进化树见图1。其中GI型主要以GI.3为主,此外还存在GI.4-GI.8等基因型,相同基因型在一个进化分支上,具有同源性,无变异株。GII组capsid(ORF2)区构建的进化树见图2。其中GII.17型变异体和GII.4_Sydney2012所占比例最高,31株GII.17型序列中,有3株与1978-2002年的GII.17型在一个进化分支上;另外28株均为新GII.17型变异株,与2014年流行的GII.17型在同一个大的进化分支上,具有同源性。18株GII.4型序列均为GII.4_Sydney2012,与JX459908/NSW0514/AU/GⅡ.4_Sydney2012在一个进化分支上,具有同源性,与X86557/Lordsdale/UK/GⅡ.4_1995存在一定的变异。

注:圆点分别代表本地区2015-2016年的GⅠ组序列。用不同颜色表示不同型别的序列,粉红色圆点为GI.5型序列,深绿色圆点为GI.4型序列,浅绿色圆点为GI.6型序列,蓝色圆点为GI.7型序列,黄色圆点为GI.8型序列,红色圆点为GI.3型序列。
图1 镇江地区NV病毒GⅠ组ORF2(Capsid)区构建的进化树
3 讨论
本研究结果发现,2015-2016年的1 605份样本中,NoV阳性率为5.30%,GII组NoV检出率明显高于GI组,说明NoV是本地区胃肠道疾病中常见的病毒类型之一[6],GII组处于优势地位,与其他文献[7-8]报道的结果较为一致。本地区NoV的感染主要集中在11月份至次年4月份,这与国内某些地区以及其他某些国家报道的结果一致[2, 9-10]。
在年龄分布的数据分析上来看,镇江地区0~10岁的学龄儿童以及60岁以上的老年人主要感染NoV GII组,GII组在10~20岁组中的阳性率最高,与其他年龄组的差异有统计学意义;而GI组在人群中无明显年龄分布特征。原因推测10~20岁组的处在学校等集体环境居多,一旦感染NoV,容易造成大规模的流行和传播。
目前,对NoV的分型主要针对ORF2的Capsid区进行。在人群中流行的基因型主要是GII组的17种基因亚型,其中GII.4型是NoV的主要流行株,自20世纪90年代以来,引起了至少4次季节性的腹泻病大流行[11],而GII.17型在2014年以后,在上海、广东、浙江及香港等地发现GII.17型序列[12-15],这充分表明了GII.17型NoV在国内从2014年开始逐渐增多。本地监测数据发现,镇江地区存在多种NoV基因型,2015年以GII.17型为主,2016年以GII.4 Sydney_2012型为主,NoV基因型别处于动态变化中。本次检测的NoV GII.17型是一种新的GII.17型变异株,2014年10月在江苏省首次被检出后,2015年2月成为主要的流行株[16]。镇江地区在2014年12月首次检出,随后引发了几起由NoV GII.17型引起的突发疫情[17]。镇江地处长江沿岸,很容易引起NoV通过水源的传播,本地区人群普遍缺乏新的GII.17型变异株的抗体,容易导致突发疫情的发生。本地检出的GII.4型为最新的GII.4变异株:GII.4 Sydney_2012株,也是容易引起NoV暴发流行的病毒株,但是近2年镇江地区并未发生因GII.4 Sydney_2012株感染引起的暴发疫情,一方面说明此型别NoV的毒力有所降低,不容易引起暴发感染,仅在监测中可以零星发现,另一方面也说明本地人群可能已经具有抵抗此型病毒的抗体,具体原因还需要进一步研究。
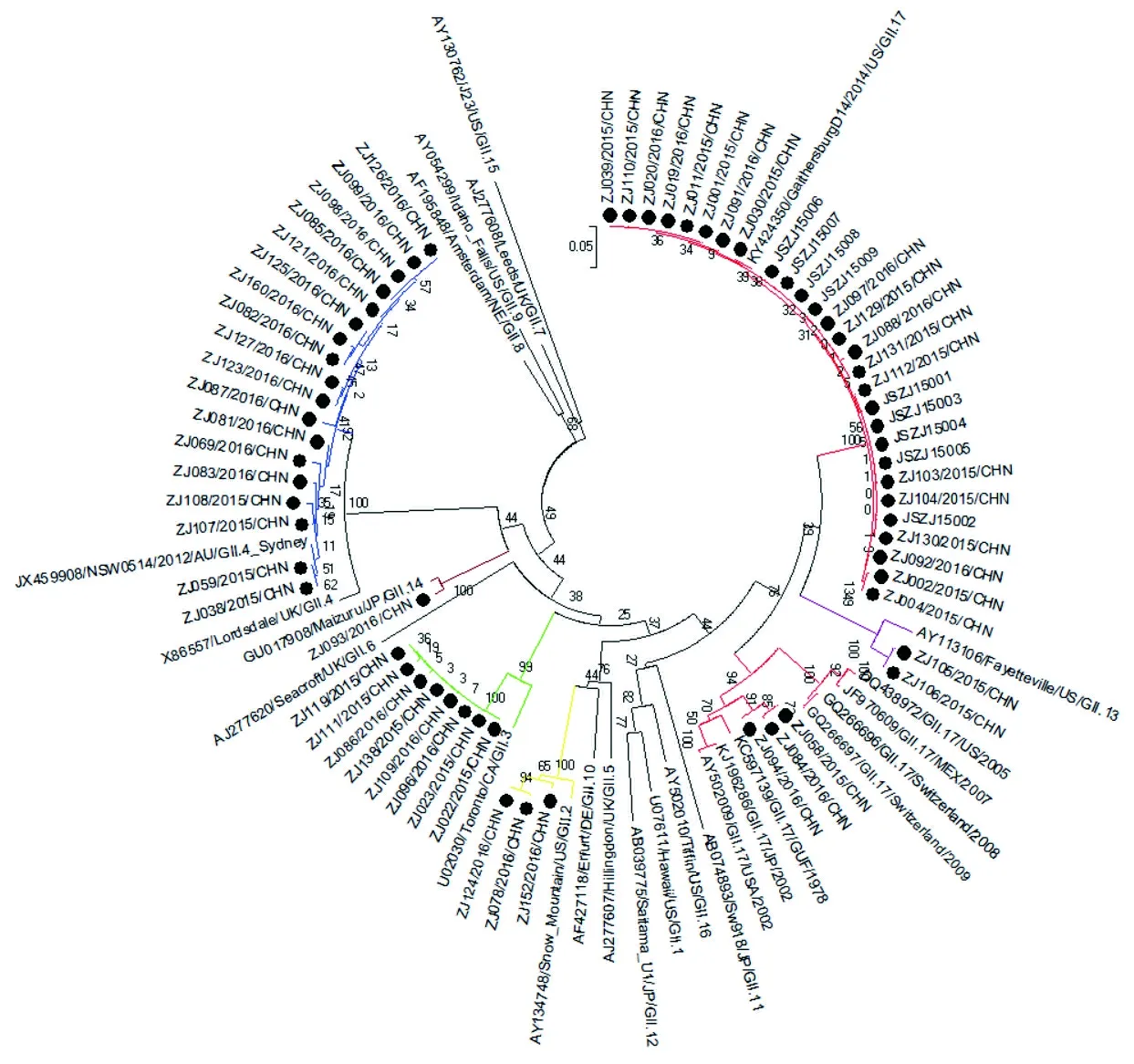
注:圆点代表2015-2016年的GII组序列。不同型别的进化分支分别用不同颜色表示。
图2 镇江地区NV GII组Capsid(ORF2)区构建系统进化树
[1]Payne DC, Vinjé J, Szilagyi PG,etal. Norovirus and medically attended gastroenteritis in U.S. children[J]. N Engl J Med,2013,368(12):1121-1130.
[2]Zhang P, Chen L, Fu Y,etal. Clinical and molecular analyses of norovirus-associated sporadic acute gastroenteritis: the emergence of GⅡ.17 over GⅡ.4, Huzhou, China, 2015[J]. BMC Infect Dis,2016,16(1):717.
[3]Qiao N, Wang XY, Liu L. Temporal evolutionary dynamics of norovirus GⅡ.4 variants in China between 2004 and 2015[J]. PLoS One,2016, 11(9):e0163166.
[4]Shigeyuki K, Tsutomu K, Shuetsu F,etal. Genogroup-specific PCR primers for detection of Norwalk-like viruses[J]. J Virol Methods,2002,100(1):107-114.
[5]Kroneman A, Vennema H, Deforche K,etal. An automated genotyping tool for enteroviruses and noroviruses.[J]. J Clin Virol,2011,51(2):121-125.
[6]张敏,孙长贵,陈晓,等. 2013年杭州市腹泻病原谱分析[J]. 临床检验杂志,2015,33(6):469-471.
[7]Ayukekbong JA, Fobisong C, Tah F,etal. Pattern of circulation of norovirus GⅡ strains during natural infection[J]. J Clin Microbiol,2014,52(12):4253-4259.
[8]付建光,艾静,靳淼,等. 江苏省近期急性胃肠炎暴发中诺如病毒分子特征分析[J]. 中华流行病学杂志,2013,34(8):808-811.
[9]Heejin H, Oh S, Hyunjung S,etal. Molecular characteristics of noroviruses genogroup I and genogroup II detected in patients with acute gastroenteritis.[J]. Ann Lab Med,2015,35(2):242-245.
[10]Dey SK,Phathammavong O, Okitsu S,etal. Seasonal pattern and genotype distribution of norovirus infection in Japan.[J]. Pediatr Infect Dis J,2010,29(5):e32.
[11]Yang Y, Xia M, Tan M,etal. Genetic and phenotypic characterization of GⅡ-4 noroviruses that circulated during 1987 to 2008[J]. J Virol,2010,84(18):9595-9607.
[12]Chen H, Qian F, Xu J,etal. A novel norovirus GⅡ.17 lineage contributed to adult gastroenteritis in Shanghai, China, during the winter of 2014-2015[J]. Emerg Microbes Infect,2015,4(11):e67.
[13]Han J, Ji L, Shen Y,etal. Emergence and predominance of norovirus GⅡ.17 in Huzhou, China, 2014-2015[J]. Virol J,2015,12(1):139.
[14]Lu J, Sun L, Fang L,etal. Gastroenteritis outbreaks caused by norovirus GⅡ.17, Guangdong Province, China, 2014-2015[J]. Emerg Infect Dis,2015,21(7):1240-1242.
[15]Chan MC, Leung TF, Chung TW,etal. Virus genotype distribution and virus burden in children and adults hospitalized for norovirus gastroenteritis, 2012-2014, Hong Kong[J]. Sci Rep,2015,5(1):11507.
[16]Fu J, Ai J, Jin M,etal. Emergence of a new GⅡ.17 norovirus variant in patients with acute gastroenteritis in Jiangsu, China, September 2014 to March 2015[J]. Euro Surveill,2015,20(24):21157.
[17]许金凤,徐虹,薛渊,等. 3起GⅡ.17型诺如病毒突发疫情的分子流行病学分析[J]. 中国卫生检验杂志,2016,26(23):3423-3425.
2017-06-30)
(本文编辑:许晓蒙)
MolecularepidemiologicalcharacteristicsandgenotypeanalysisofnorovirusinZhenjiangregion
XUJin-feng1,2,XUHong2,SONGYin-sheng2,XUEYuan2,SHAOShi-he1,SHENHong-xing1
(1.SchoolofMedicine,JiangsuUniversity,Zhenjiang212013,Jiangsu; 2.DepartmentofClinicalLaboratory,ZhenjiangCenterforDiseasePreventionandControl,Zhenjiang212000,Jiangsu,China)
ObjectiveTo analyze the molecular epidemiological characteristics and genotype distribution of norovirus in Zhenjiang region during 2015 and 2016.MethodsThe fecal samples from diarrhea patients in Zhenjiang region were collected, and the expression level of norovirus capsid protein gene was detected by reverse transcription PCR (RT-PCR). The PCR products were validated by gene sequencing. Then, phylogenetic tree was constructed with Mega software, and sequence evolution and genotype were analyzed.ResultsThe positive rate of norovirus infection was 5.30% (85/1 605). Among them, the detection rates of GⅠ genogroup and GⅡ genogroup were 0.87% (14/1 605) and 4.55% (73/1 605), respectively, and 2 samples were detected both of GⅠ and GⅡ genogroups. The highest positive rate of GⅡ genogroup occurred in adolescent patients aged from 10 to 20 years (17.80%). During 2015, the detection rate of norovirus infection was the highest in January, and then in November and February. During 2016, the detection rate of norovirus infection was the highest in December, and then in March and April. The main genotypes of norovirus in 2015 and 2016 were new GⅡ.17 variant (63.89%) and GⅡ.4 Sydney_2012 strain (35%), respectively.ConclusionThe infection of norovirus in Zhenjiang region appears GⅡ as main genogroup, adolescent as main patients, November to April of the next year as main epidemic seasons, and GⅡ.17 variant and GⅡ.4 Sydney_2012 strain as main epidemic genotypes.
norovirus; molecular epidemic disease; genotype
10.13602/j.cnki.jcls.2017.11.14
镇江市卫生科技重点专项项目(SHW2015015);镇江市科技计划社会发展项目(SH2015083)。
许金凤,1981年生,女,主管技师,硕士研究生,主要从事病原生物学研究。
邵世和,教授,博士研究生导师, E-mail:shaoshihe2006@163.com;申红星,副教授,硕士研究生导师,E-mail:hxshen@ujs.edu.cn。
Q939.4
A

