miR-494在乳腺癌中的表达及其临床意义*
靳雪芹,刘水逸,李晓怡,陈卫群,镇鸿雁,卢忠心
(1.江汉大学医学院,武汉 430056;2.华中科技大学同济医学院附属武汉中心医院检验科,武汉 430014)
·肿瘤与微环境检测·
miR-494在乳腺癌中的表达及其临床意义*
靳雪芹1,2,刘水逸2,李晓怡2,陈卫群2,镇鸿雁1,卢忠心2
(1.江汉大学医学院,武汉 430056;2.华中科技大学同济医学院附属武汉中心医院检验科,武汉 430014)
目的探讨miR-494在乳腺癌组织和乳腺癌细胞系中的表达及其与乳腺癌临床分期、转移和预后的关系。方法实时荧光定量聚合酶链反应(qRT-PCR)检测5种乳腺癌细胞系MDA-MB-231、MDA-MB-453、HCC-1937、MDA-MB-468、MCF-7和乳腺上皮细胞系HBL-100中miR-494的表达水平;收集54对乳腺癌组织和癌旁组织,用qRT-PCR法检测其miR-494的表达水平,并分析其与乳腺癌临床分期、转移和预后的关系。结果qRT-PCR检测结果显示,与正常乳腺上皮细胞HBL-100相比,MDA-MB-231、MDA-MB-453、HCC-1937、MDA-MB-468、MCF-7乳腺癌细胞系中miR-494的表达水平均明显降低(t分别为212.9、37.73、27.53、10.61、19.46,P均<0.05)。此外,miR-494在乳腺癌组织中的表达水平亦明显低于癌旁组织(t=5.80,P<0.01),且与临床分期(χ2=17.41,P<0.05)、组织病理分级(χ2=5.33,P<0.05)、C-erbB-2表达情况(χ2=9.83,P<0.05)、Ki-67阳性细胞百分比(χ2=6.13,P<0.05)有关。结论miR-494在乳腺癌组织和乳腺癌细胞系中低表达,且与乳腺癌临床分期、转移和预后关系密切,可成为乳腺癌辅助诊断和预后判断的分子标志。
微小RNA-494;乳腺癌;预后判断
MicroRNA(miRNA)是一类长度约20~24个核苷酸的非编码小分子RNA,参与了包括乳腺癌在内的多种肿瘤的发生和发展[1-4]。由于乳腺癌的初期没有明显症状,呈现局部侵袭,多数乳腺癌患者在确诊时已经是局部晚期,因此,寻找特异性的诊断和预后判断的分子标志物,从而提高乳腺癌患者的生存时间、改善生存质量具有重要的临床意义。本研究通过检测miR-494在乳腺癌细胞系和组织中的表达,分析其与乳腺癌临床分期、侵袭转移及预后的关系,旨在探讨miR-494与乳腺癌的发生、发展的相关性,为其可能成为乳腺癌早期诊断和靶向治疗及预后判断的新的分子标志物提供实验依据。
1 材料与方法
1.1临床标本 收集2016年3月至2016年12月武汉市中心医院甲乳外科就诊的乳腺癌患者经手术切除的乳腺癌组织和癌旁组织(距肿瘤组织≥5 cm)54对(新鲜组织标本离体后立即液氮速冻后置于-80 ℃冻存),患者均为女性,年龄37~81岁,中位年龄56岁。术前均未做过化疗、放疗、免疫及内分泌治疗,所有患者临床资料完整,术前检查确认均不合并高血压、糖尿病及其他恶性肿瘤(如胃癌、结直肠癌等),术后乳腺癌组织标本经病理组织学证实为乳腺癌。包括乳腺浸润性导管癌50例、小叶癌1例、粘液腺癌3例;按照美国国立综合癌症网络(NCCN)诊断标准进行肿瘤TNM分期,其中Ⅰ期16例,Ⅱ期22例,Ⅲ期14例,Ⅳ期2例;组织病理学分级为1~2级患者36例,3级患者18例;淋巴结转移阳性患者25例,淋巴结转移阴性患者29例;乳腺癌组织经免疫组织化学证实雌激素受体(ER)阳性患者38例,孕激素受体(PR)阳性患者41例;C-erbB-2表达阳性患者35例,阴性19例;Ki-67≥14%患者42例,Ki-67<14%患者12例;本研究经医院医学伦理学委员会批准,所有研究对象均签署知情同意书。
1.2细胞系、试剂及仪器 人乳腺癌细胞系MDA-MB-231、MDA-MB-453、HCC-1937、MDA-MB-468、MCF-7和人乳腺上皮细胞系HBL-100购自美国典藏细胞库(ATCC),RPMI-1640培养基、L15培养基、DMEM培养基、胎牛血清(FBS)均购自美国Gibco公司,Trizol试剂(美国Invitrogen公司),TaqMan miRNA分析试剂盒、Step one plus实时荧光定量PCR仪(美国ABI公司),倒置生物显微镜IX51(日本Olympus公司),超净工作台、CO2恒温培养养箱(美国Thermo公司),紫外线可见光分光光度计(美国Beckman Coulter公司),瞬时离心机、冷冻高速离心机(德国Eppendorf公司)。
1.3细胞培养 乳腺上皮细胞系HBL-100、乳腺癌细胞系MCF-7细胞培养于含10%胎牛血清、1×双抗(青霉素100 U/mL,链霉素为0.1 g/mL)的DMEM培养基中,HCC-1937细胞培养于含10%胎牛血清、1×双抗的RPMI-1640培养基中,MDA-MB-231、 MDA-MB-453、MDA-MB-468培养于含10%胎牛血清、1×双抗的L15培养基,并置5% CO2、37 ℃培养箱中恒温培养。
1.4qRT-PCR检测miR-494的表达 用Trizol试剂提取乳腺癌组织及癌旁组织(10 mg)及各乳腺细胞系(5×105个)总RNA,利用紫外分光光度计测定其吸光度值,取吸光度(A260/280 nm)为1.8~2.0的样本,按逆转录试剂盒说明书将RNA逆转录为cDNA,样本置-20 ℃保存。按照TaqMan miRNA检测试剂盒说明书操作检测miR-494和内参照U6。循环参数:95 ℃变性10 min;95 ℃ 15 s,60 ℃ 60 s,共40个循环。miR-494的相对表达量在组织中用2-ΔCt法计算,细胞中用2-ΔΔCt法计算[3]。实验重复3次。
1.5组织病理检测 采用免疫组化染色法检测乳腺癌组织及癌旁组织中ER、PR、C-rBb-2、Ki-67的表达,步骤:组织标本以10%甲醛固定24 h,常规石蜡包埋,制备5 μm厚连续切片,附于3-氨丙基三氧基硅烷(APES)处理后的载玻片上,60 ℃烤制2 h。免疫组化染色:石蜡切片脱蜡; 3%H2O2常温温育10 min,蒸馏水冲洗,PBS浸泡5 min;高压锅进行抗原修复;加入鼠抗人ER、PR、C-rBb-2、Ki-67单克隆抗体(1∶500稀释),室温放置2 h,PBS冲洗2 min×3次;加入羊抗鼠多克隆IgG二抗(1∶1 000稀释),室温温育30 min,PBS冲洗2 min×3次;加入DAB溶液显色;用自来水反复冲洗、复染、脱水、透明、封片。结果判断:阳性细胞表现为棕黄色或棕褐色着色,阳性细胞数<10%为阴性(-);10%~25%为弱阳性(+);26%~50%为阳性(2+);>50%为强阳性(3+),以Ki-67阳性细胞的百分比<14%为肿瘤细胞低增殖,Ki-67阳性细胞的百分比≥14%为细胞高增殖[5]。实验重复3次。
1.6统计学分析 用SPSS 19.0统计软件进行。正态分布的组间样本均数比较用Student′st检验。以P<0.05为差异有统计学意义。
2 结果
2.1乳腺癌细胞系和乳腺正常细胞中miR-494的表达水平 结果显示,乳腺癌细胞系(MDA-MB-231、MDA-MB-453、HCC-1937、MDA-MB-468、MCF-7)中miR-494的相对表达量分别为(0.02±0.01、0.07±0.03、0.11±0.05、0.26±0.10、0.38±0.05),与正常对照乳腺上皮细胞HBL-100(1.00±0.07)相比,均明显降低(t分别为212.9、37.73、27.53、10.61、19.46,P均<0.05)。
2.2乳腺癌组织和癌旁组织中miR-494的表达水平 qRT-PCR检测54对乳腺癌患者癌组织和癌旁组织中miR-494的相对表达水平,结果显示乳腺癌组织中miR-494的表达量为(1.32±2.24),明显低于癌旁组织(15.12±17.26),差异有统计学意义(t=5.80,P<0.05)。
2.3miR-494的表达与乳腺癌患者临床病理参数的关系 miR-494的表达水平与患者的临床分期、组织病理分级、C-erbB-2、Ki-67表达情况密切相关,临床分期、组织病理分级越高,miR-494的表达水平越低(P<0.05);临床分期为Ⅲ~Ⅳ期患者miR-494的表达水平低于Ⅰ~Ⅱ期患者,且组织病理分级G3级患者miR-494的表达水平低于G1-2级患者(P<0.05),C-erbB-2表达阳性患者组织中miR-494表达水平明显低于C-erbB-2表达阴性患者(P<0.01); Ki-67≥14%患者中miR-494表达水平较Ki-67<14%患者偏低(P<0.05);而miR-494的表达与患者年龄、肿瘤大小、淋巴结转移情况、雌孕激素受体的表达差异均无统计学意义(P>0.05)。见表1。
表1 miR-494表达水平与乳腺癌患者临床病理参数的关系[n(%)]
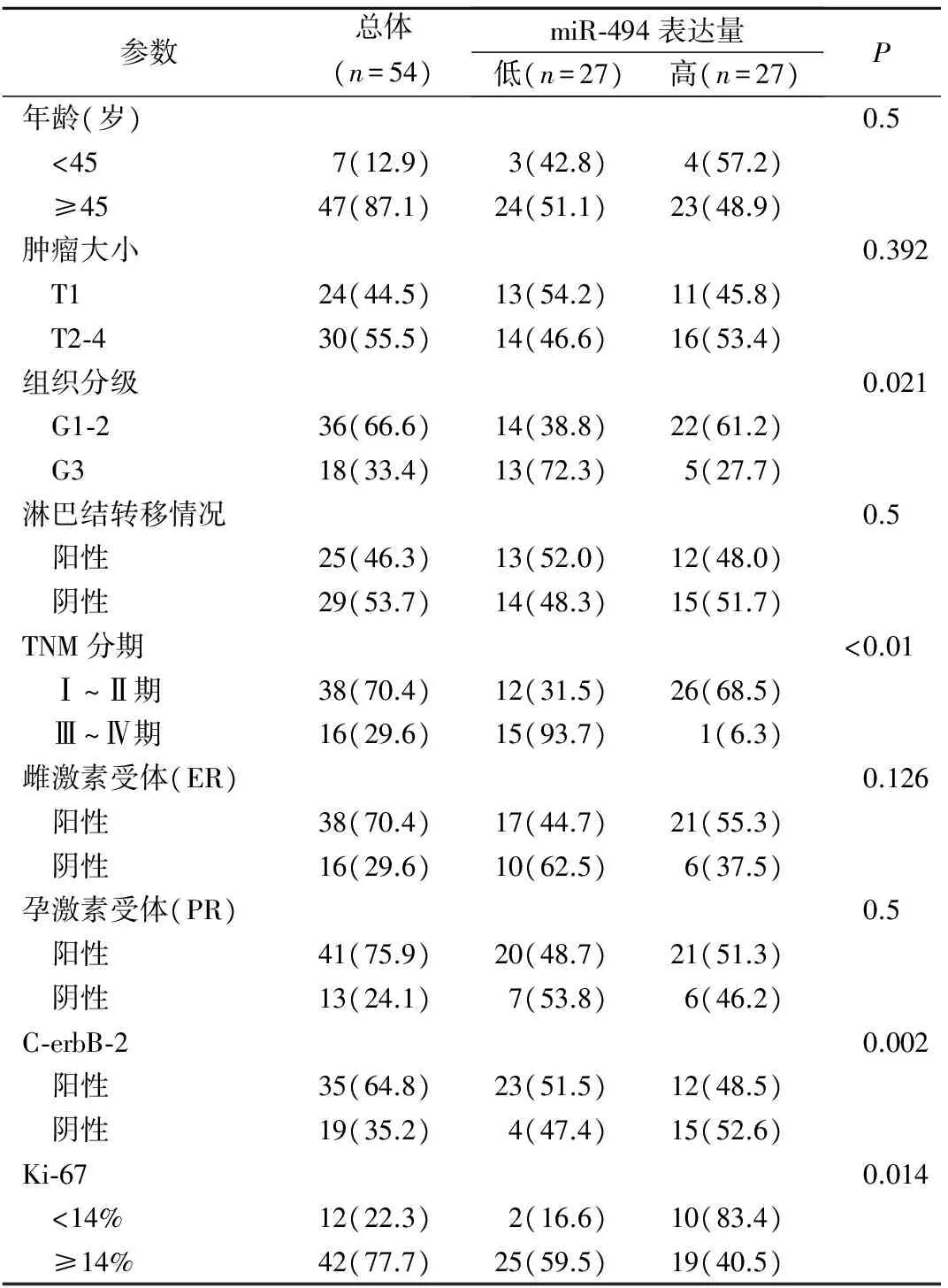
参数总体(n=54)miR⁃494表达量低(n=27)高(n=27)P年龄(岁)0.5 <457(12.9)3(42.8)4(57.2) ≥4547(87.1)24(51.1)23(48.9)肿瘤大小0.392 T124(44.5)13(54.2)11(45.8) T2⁃430(55.5)14(46.6)16(53.4)组织分级0.021 G1⁃236(66.6)14(38.8)22(61.2) G318(33.4)13(72.3)5(27.7)淋巴结转移情况0.5 阳性25(46.3)13(52.0)12(48.0) 阴性29(53.7)14(48.3)15(51.7)TNM分期<0.01 Ⅰ~Ⅱ期38(70.4)12(31.5)26(68.5) Ⅲ~Ⅳ期16(29.6)15(93.7)1(6.3)雌激素受体(ER)0.126 阳性38(70.4)17(44.7)21(55.3) 阴性16(29.6)10(62.5)6(37.5)孕激素受体(PR)0.5 阳性41(75.9)20(48.7)21(51.3) 阴性13(24.1)7(53.8)6(46.2)C⁃erbB⁃20.002 阳性35(64.8)23(51.5)12(48.5) 阴性19(35.2)4(47.4)15(52.6)Ki⁃670.014 <14%12(22.3)2(16.6)10(83.4) ≥14%42(77.7)25(59.5)19(40.5)
3 讨论
miRNA在肿瘤的发生和发展过程中发挥重要作用,约92%的人类基因被miRNA所调节[6]。miR-494 编码基因位于染色体14q32.31上,多项研究证实,miR-494在卵巢癌、肺癌、胃癌等多种恶性肿瘤中差异表达,如Zhao等[7]发现,miR-494通过靶向下调纤维细胞生长因子受体2(FGFR2),抑制卵巢癌细胞增殖并促进细胞凋亡。Romano等[8]发现在非小细胞肺癌中miR-494受ERK1/2的调节,并通过下调BIM介导TRAIL诱导的细胞凋亡;He等[9]发现,miR-494在胃癌中通过靶向c-myc基因抑制肿瘤发生、发展;Song等[10]研究发现,miR-494靶向趋化因子受体CXCR4,并且能够通过抑制Wnt/β-catenin信号通路抑制乳腺癌细胞的增殖、迁移和侵袭。本研究发现,miR-494在乳腺癌细胞系和乳腺癌组织中均呈低表达,与上述文献报道基本一致,表明miR-494可能作为抑癌基因参与乳腺癌的发生、发展。然而,由于本研究中乳腺癌组织标本数量相对较少,miR-494作为辅助乳腺癌的分子标志仍需大量的标本进行验证,此外,我们也将从乳腺癌患者血清入手,检测乳腺癌患者血清中miR-494的表达水平,从而进一步探讨miR-494在乳腺癌患者的表达情况与肿瘤TNM分期的相关性。
根据基因分析和免疫组化的结果可以将乳腺癌分为不同的亚型;根据ER、PR、C-erbB-2及Ki-67(细胞核增殖抗原)状态可以将乳腺癌分为不同的分子分型[11-13]。分子分型、肿瘤分期是评估肿瘤恶性程度、复发风险和制定治疗方案的决定性依据,本研究通过分析54例乳腺癌组织中miR-494的表达水平与患者的临床病理资料发现,miR-494的表达水平与乳腺癌患者的临床分期、组织参数分级、C-erbB-2、Ki-67表达情况密切相关,临床分期、组织病理分级越高,miR-494的表达水平越低,临床分期Ⅲ~Ⅳ期患者miR-494的表达水平明显低于I~Ⅱ期患者,且组织病理分级G3级患者miR-494的表达水平明显低于G1-2级患者,差异具有统计学意义(P<0.05)。乳腺癌是一种激素依赖性肿瘤,观察患者ER、PR受体表达能够预测乳腺癌患者对内分泌治疗的敏感性,本研究发现miR-494的表达水平与患者雌孕激素受体表达无相关性。C-erbB-2(人表皮生长因子-2)[12]是一类原癌基因,与肿瘤的发生、转移、放化疗敏感性下降关系密切,C-erbB-2阳性是乳腺癌不良预后的独立预测因子[14];本研究发现C-erbB-2阳性患者组织中miR-494表达明显降低(P<0.01),提示了患者的预后较差、术后复发转移的可能性较大。Ki-67是细胞增殖相关蛋白,与肿瘤细胞的增殖、凋亡密切相关,Ki-67越高其肿瘤的分化程度越差、浸润和侵袭转移的可能越高,故而是评估患者预后的重要指标[15-16];本研究发现在Ki-67≥14%患者中的miR-494呈低表达(P<0.05),提示miR-494表达水平越低,患者预后越差。因此通过检测乳腺癌组织中miR-494表达水平并结合C-erbB-2、Ki-67、肿瘤大小、临床分期、组织分级来评估肿瘤的生物学行为及判断预后,指导临床治疗方案的选择,具有重要意义。此外,为了进一步探讨miR-494参与乳腺癌发生发展的分子机制,我们将在后续的研究中通过生物信息学软件预测miR-494的靶基因,在分子生物学水平验证miR-494是否通过抑制癌基因的表达来调控乳腺癌的发生、发展。
[1]Wang P, Liu X, Shao Y,etal. MicroRNA-107-5p suppresses non-small cell lung cancer by directly targeting oncogene epidermal growth factor receptor[J]. Oncotarget, 2017,34(8):57012-57023.
[2]Yuan L, Yuan P, Yuan H,etal. miR-542-3p inhibits colorectal cancer cell proliferation, migration and invasion by targeting OTUB1[J]. Am J Cancer Res, 2017, 7(1):159-172.
[3]Wu T, Chen W, Kong D,etal. miR-25 targets the modulator of apoptosis 1 gene in lung cancer[J]. Carcinogenesis, 2015, 36(8):925-935.
[4]Zhi X, Wu K, Yu D,etal. MicroRNA-494 inhibits proliferation and metastasis of osteosarcoma through repressing insulin receptor substrate-1[J]. Am J Transl Res, 2016, 8(8):3439-3447.
[5]刘奎, 孔繁九, 杜善梅,等. miR-29a在乳腺癌组织中的表达及其对乳腺癌细胞增殖和迁移的影响[J]. 临床检验杂志, 2015, 33(11):818-822.
[6]Kozomara A, Griffiths-Jones S. miRBase: annotating high confidence microRNAs using deep sequencing data[J]. Nucleic Acids Res,2014,42(Database issue):D68-D73.
[7]Zhao X, Zhou Y, Chen YU,etal. miR-494 inhibits ovarian cancer cell proliferation and promotes apoptosis by targeting FGFR2[J]. Oncol Lett, 2016, 11(6):4245-4251.
[8]Romano G, Acunzo M, Garofalo M,etal. MiR-494 is regulated by ERK1/2 and modulates TRAIL-induced apoptosis in non-small-cell lung cancer through BIM down-regulation[J]. Proc Natl Acad Sci USA, 2012,109(41):16570-16575.
[9]He W, Li Y, Chen X,etal. miR-494 acts as an anti-oncogene in gastric carcinoma by targeting c-myc[J]. J Gastroenterol Hepatol,2014,29(7):1427-1434.
[10]Song L, Liu D, Wang B,etal. miR-494 suppresses the progression of breast cancer in vitro by targeting CXCR4 through the Wnt/β-catenin signaling pathway[J]. Oncol Rep, 2015, 34(1):525-531.
[11]翁一鸣, 胡伟国, 宋启斌. 以分子分型为基础的乳腺癌内科治疗进展[J]. 肿瘤学杂志, 2017, 23(3):165-169.
[12]张艳秋, 王昳凡, 王简. HER-2阳性乳腺癌的新辅助治疗现状及展望[J]. 临床肿瘤学杂志, 2017, 22(3):264-271.
[13]刘卓, 李晓凤, 张美云. Apaf-1和Ki-67在乳腺癌组织中的表达及临床意义[J]. 临床肿瘤学杂志, 2017, 22(2):133-136.
[14]唐红辉, 徐海伟. 乳腺癌患者血清HER-2/neu蛋白化学发光免疫定量分析方法的建立[J]. 临床检验杂志, 2016, 34(7):548-551.
[15]Muftah AA, Aleskandarany MA, Al-Kaabi MM,etal. Ki67 expression in invasive breast cancer: the use of tissue microarrays compared with whole tissue sections[J]. Breast Cancer Res Treat, 2017, 164(2):341-348.
[16]Tu M, Liu X, Han B,etal. Vasohibin 2 promotes proliferation in human breast cancer cells via upregulation of fibroblast growth factor 2 and growth/differentiation factor 15 expression[J]. Mol Med Rep, 2014, 10(2):663-669.
2017-08-28)
(本文编辑:许晓蒙)
ExpressionofmiR-494inbreastcanceranditsclinicalsignificance
JINXue-qin1,2,LIUShui-yi2,LIXiao-yi2,CHENWei-qun2,ZHENHong-yan1,LUZhong-xin1,2
(1.SchoolofMedicine,JianghanUniversity,Wuhan430056,Hubei; 2.DepartmentofMedicalLaboratory,TheCentralHospitalofWuhan,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430014,Hubei,China)
ObjectiveTo investigate the expression levels of miR-494 in breast cancer tissues and cell lines, and its correlations with the clinical stages, metastasis and prognosis of breast cancer.MethodsThe expression levels of miR-494 in 5 breast cancer cell lines, including MDA-MB-231, MDA-MB-453, HCC-1937, MDA-MB-468 and MCF-7, and normal breast cell line HBL-100, were detected by quantitative real-time polymerase chain reaction (qRT-PCR). The breast cancer tissues and normal adjacent tissues from 54 patients with breast cancer were collected, and their expression levels of miR-494 were determined by qRT-PCR. Then, the correlations of miR-494 levels with clinical stages, metastasis and prognosis of breast cancer were analyzed.ResultsThe expression levels of miR-494 in MDA-MB-231, MDA-MB-453, HCC-1937, MDA-MB-468 and MCF-7 cells were significantly lower than that in HBL-100 cells (t=212.9, 37.73, 27.53, 10.61 and 19.46, respectively, and allP<0.05). The expression levels of miR-494 in breast cancer tissues were also significantly lower than that in normal adjacent tissues (t=5.80,P<0.01). Moreover, the expression of miR-494 was significantly related to the clinical stage (χ2=17.41,P<0.05), tumor grade (χ2=5.33,P<0.05), C-erbB-2 expression (χ2=9.83,P<0.05) and the percentage of Ki-67 positive cells (χ2=6.13,P<0.05) of breast cancer.ConclusionThe expression levels of miR-494 are significantly downregulated in breast cancer tissues and cell lines, and related to the clinical stage, metastasis and prognosis of breast cancer, indicating that miR-494 may serve as a new biomarker for the diagnosis and prognosis of breast cancer.
miR-494; breast cancer; prognosis
10.13602/j.cnki.jcls.2017.11.07
江汉大学硕士研究生科研创新基金项目(010-2015-01);湖北省自然科学基金重点项目(2015CFA078);湖北省科技支撑计划(对外科技合作类) (2015BHE022)。
靳雪芹,1983年生,女,硕士研究生,主要从事非编码RNA与肿瘤研究。
卢忠心,教授,博士,E-mail:lzx71@yahoo.com。
R737.4
A

