趋化因子受体在卵巢癌进展中的作用机制*
芮小慧,徐云,蒋敬庭
(苏州大学附属第三医院肿瘤生物诊疗中心,江苏省肿瘤免疫治疗工程技术研究中心,苏州大学细胞治疗研究院,江苏常州 213003)
·肿瘤与微环境检测·
趋化因子受体在卵巢癌进展中的作用机制*
芮小慧,徐云,蒋敬庭
(苏州大学附属第三医院肿瘤生物诊疗中心,江苏省肿瘤免疫治疗工程技术研究中心,苏州大学细胞治疗研究院,江苏常州 213003)
卵巢癌是妇科预后较差的恶性肿瘤,卵巢癌的形成和发展是多因素、多步骤协同完成的过程,包括细胞的转化、血管生成的前期肿瘤微环境形成、局部肿瘤细胞的生长、细胞外基质降解、肿瘤细胞突破血管基底膜进入人血液循环系统,形成肿瘤细胞向特定组织器官的非随机性转移。趋化因子受体参与肿瘤血管的生成,在肿瘤细胞粘附、增殖、侵袭和转移中起重要作用。趋化因子是卵巢癌进展的重要调节因子,趋化因子受体可作为治疗卵巢癌潜在的新靶点。
卵巢肿瘤;趋化因子受体;免疫反应
趋化因子(Chemokine)在炎症反应中可以促进白细胞向炎症部位聚集,研究证实其与受体结合后可在细胞的生长、发育和凋亡等过程中发挥重要作用,趋化因子受体(Chemokin receptor)可表达于不同类型的细胞[1]。卵巢癌腹腔转移是上皮性卵巢癌导致死亡的常见原因[2],肿瘤细胞从腹膜脱落后通过腹腔种植进入腹腔组织和器官,并在腹膜间皮细胞外基质种植且建立转移[3]。以上过程受人类G蛋白偶联受体(GPCRs)的调节,该家族约占全蛋白质编码基因组的4%[4],在卵巢癌的发生、发展中起到了重要作用。
1 趋化因子受体在卵巢癌中的生物学特性
人类G蛋白偶联受体根据序列同源和功能相似性分为6种,包括A,B, C, D, E和F类,其中A类又称视紫红质,其可分为α、β、γ和δ家族。趋化因子受体家族属于G蛋白偶联受体中的视紫红质家族中成员,被膜化蛋白相关趋化因子活化又称为化学趋化因子[5]。根据半胱氨酸位置将趋化因子分成4群(C,CC,CXC和CX3C),相应的趋化因子受体分别为CR,CCR,CXCR或CX3CR。其中C趋化因子缺乏半胱氨酸1和3。CXC家族的成员末端的2个半胱氨酸之间的单个氨基酸为鉴别点。CX3C趋化因子在第1、2个半胱氨酸之间存在3个氨基酸,而CC亚群组缺乏这种氨基酸[6]。
趋化因子与受体之间相互作用,首先结合N末端受体,其次结合灵活的趋化因子N端的胞外环和受体的跨膜段。趋化因子配体和受体结合后,受体的结构改变导致下游信号通路的启动,可促进肿瘤细胞粘附、增殖和转移[7-8]。某些趋化因子配体可结合、活化多种不同的受体,反之,部分趋化因子受体被多种不同的配体活化。而其他趋化因子如CXCL12,XCL1/2和CX3CL14仅结合和活化特有的受体CXCR4,XCR1和CX3CR1。另有研究表明,同一受体结合不同的趋化因子,可产生不同的生物学功能[9]。针对趋化因子受体相互作用触发信号转导机制,可研发对应的特异性靶向药物。为了增加趋化因子受体信号的复杂性,趋化因子受体可能会形成同质或异质的二聚体,进而促进不同的信号转导[7]。如被CXCL12活化的CXCR4串联表皮生长因子受体(EGFR)已被证实在卵巢癌中连接细胞增殖信号。细胞的粘附、增殖、迁移、血管生成和免疫逃逸是肿瘤发生种植和转移的重要条件,并在卵巢癌的发生、发展中起重要的作用[10]。
2 趋化因子受体在卵巢癌血管生成中的作用
血管生成是多种实体肿瘤的一个重要特征。卵巢癌腹膜转移需要持续的氧气和营养支持肿瘤的生长[11-13],由卵巢癌细胞可经旁分泌产生的趋化因子和表达趋化因子受体的内皮细胞相互作用刺激血管生成。CXCR1和CXCR2是2个主要的趋化因子受体,其表达于内皮细胞介导血管生成反应。蛋白酶激活受体1(PAR1)是G蛋白偶联受体,其胞外结构域表现蛋白质水解活性。基质金属蛋白酶1活化PAR1分泌趋化因子CXCL8(IL-8),CXCL1(GRO-α)和CCL2(MCP-1)促进肿瘤血管生成[14],这些趋化因子结合至表达CXCR1和CXCR2受体内皮细胞并诱导内皮细胞增殖、迁移和血管生成[15]。研究证实卵巢癌中CXCL8高表达,提示卵巢癌的不良预后与低生存率,并且CXCL8基因沉默可通过抗血管生成机制抑制肿瘤的生长。卵巢癌细胞自身表达CXCR2,通过丝裂原活化蛋白激酶(MAPK)信号转导和转录因子3(STAT3)依赖机制使血小板反应蛋白-1(TSP-1)活化减少,促进血管内皮生长因子(VEGF)增加肿瘤血管的生成,进而促进卵巢癌的生长[16]。另有研究证实,VEGF可上调CXCR4在血管内皮细胞的表达,低氧可诱导CXCR4配体CXCL12在肿瘤细胞的表达。在缺氧条件下,卵巢癌血管生成因子可增强肿瘤细胞表达CXCL12及CXCR4在血管内皮的表达[17]。在卵巢癌FVB/NJ免疫模型中,使用CXCR4的特异性RNA或小分子抑制剂AMD3100阻断CXCR4/CXCL信号轴可使肿瘤血管密度明显减少[18-19]。
血管生成过程中,肿瘤微环境的低氧应激可诱导损伤相关分子模式(DAMPs),这些分子可以触发肿瘤的免疫清除[20]。为了避免癌细胞清除过程中免疫系统血管的生成,卵巢的进程中存在一种特有的机制,其肿瘤细胞乏氧可通过缺氧诱导因子1(HIF1α)依赖机制诱导趋化因子配体28(CCL28)的表达,CCL28、CCR在调节性T细胞群表达并抑制免疫反应。在乏氧环境下增加CCL28可使CCR10+T调节细胞增加,进而保护肿瘤细胞避免被清除并增加肿瘤血管生成[21]。
3 趋化因子受体在卵巢癌的发生与发展中的作用
趋化因子受体CX3CR1是趋化因子受体家族新成员,在原发性卵巢癌和转移性卵巢癌中表达[22]。CXCR1被特异性配体CX3CL1活化,这种趋化因子配体存在可溶性形式和膜结合形式,腹膜间皮细胞表达CX3CL1主要为膜结合形式。在活性抗体阻断CX3CL1以及向卵巢癌细胞转染siRNA下调表达CX3CR1的情况下,卵巢癌细胞对间皮细胞的粘附明显下降[22]。趋化因子轴在卵巢癌腹腔转移的调控中起重要作用,在卵巢癌中阻断CXCL1/CX3CR1的相互作用,可减少因转移细胞粘附于腹膜腔器官和组织造成的继发性损伤,降低肿瘤转移。此外,还发现CX3CL1/CX3CR1轴促进卵巢癌细胞粘附及增殖,进一步提示CX3CL1/CX3CR1轴是卵巢癌转移的主要信号通路[23],趋化因子及配体的表达提示此轴在卵巢癌中的重要性。
趋化因子C家族中淋巴细胞趋化因子成员XCR1在卵巢癌的转移中起重要作用[24]。该受体在正常的卵巢组织中不表达,仅在原发及转移性卵巢组织中表达。XCL1和XCL2结合活化XCR1,促进卵巢癌细胞增殖和转移。在卵巢癌患者腹水中的卵巢肿瘤细胞表达XCL1和XCL2,提示XCL/XCR轴可促进肿瘤增殖、扩张和转移。有学者利用腹腔注射卵巢癌细胞构建异种移植小鼠模型,结果发现卵巢癌转移至腹和膈依赖于卵巢癌细胞表达XCR1,提示对淋巴细胞趋化因子依赖的机制支持转移细胞归巢[24]。
临床上常在肿瘤微环境基质细胞中监控恶性细胞表型,其机制与部分趋化因子受体密切相关[25-27]。原位肿瘤细胞可产生细胞因子淋巴毒素,并基于NF-κB信号通路依赖机制激活基质释放趋化因子CXCL11,CXCL11结合表达同源受体CXCR3的肿瘤细胞,并能促进细胞的增殖和迁移[28]。此外,过表达CXCR3与肿瘤分级和淋巴结转移密切相关,提示CXCL11/CXCR3促进卵巢癌的转移[28]。
CXCR4属于CXC家族趋化因子受体,可受配体CXCL12活化。高级别上皮卵巢癌(HGSOC)包含CXCR4扩增基因位点突变及TP53突变,可导致早期高级别上皮卵巢癌的进展,也可导致卵巢癌染色体不稳定性[29]。CXCR4在人卵巢癌组织中过表达,其配体CXCL12在卵巢癌患者腹水中过表达[29-31]。在腹膜转移模型中,可通过β1整合素及NF-κB依赖信号通路上调细胞CXCR4的表达[31]。CXCL12诱导细胞内钙流入,导致细胞趋化和促进细胞繁殖,并在卵巢癌细胞上改变β1整合素的表达。同时,CXCL12可借助αvβ6整合素信号依赖机制,通过下游效应因子p38 MAPK和PI3K/Atk上调尿激酶型纤溶酶原激活物(uPA)表达增强细胞侵袭。同时,CXCR4和EGFR串联可增强基质金属蛋白酶9(MMP-9)的表达[32]。CXCR4调节蛋白水解酶,削弱uPA和MMP-9的分泌[33]。在卵巢癌肿瘤干细胞中,CCL5与其受体CCR3和CCR5通过NF-κB信号通路诱导MMP-9表达[34],CXCR4的表达与卵巢癌患者的生存率降低相关[30]。有学者利用卵巢癌小鼠模型,使用RNA干扰和CXCR4特异性抑制剂AMD3100可明显降低腹腔转移并减少大网膜种植[18]。CXCL12/CXCR4轴功能障碍增加肿瘤细胞的凋亡和坏死。
CXCR4肽拮抗剂CTCE-9908通过细胞周期G2-M期阻滞与异常的有丝分裂,导致细胞的凋亡。CXCL12可以结合和活化另一个趋化因子受体CXCR7,增加了其功能的复杂性。CXCR4、CXCR6受体及其配体CXCL16在卵巢癌中呈高表达,在淋巴结转移的卵巢癌中多同时表达CXCR4和CXCR6,而高表达CXCL16与患者的生存期呈负相关[30]。
4 趋化因子受体在卵巢癌诊断和治疗中的应用
CA125是一种敏感性较高且临床应用较为广泛的卵巢癌标志物,但因其亦可用于子宫内膜癌、宫颈癌、肠癌以及乳腺癌等其他肿瘤的检测,所以特异性较低。因此,仍然需要探寻具有更高敏感性和特异性的卵巢癌标志物以提高卵巢癌的早期诊断水平。研究发现,卵巢癌患者外周血中CXCR4和CXCR7的表达水平明显高于体检健康者,这表明趋化因子受体是一种潜在的卵巢癌标志物且具有相对较高的敏感性[35-36]。此外,研究表明,在胃癌和肺癌患者的外周血中CXCR4和CXCR7的表达水平亦高于体检健康者[37-39]。由此可见,与CA125相比,趋化因子受体可能是一种敏感性较高但特异性较低的卵巢癌标志物。趋化因子受体与CA125的联合应用有助于降低卵巢癌早期诊断的假阴性率,从而提高卵巢癌患者的预后。
趋化因子受体在卵巢癌发生、发展中具有重要的作用,所以部分趋化因子的衍生物或抑制剂具有潜在的临床应用前景。目前,已有大量研究证实趋化因子受体可以作为卵巢癌治疗的新靶点。如对化疗抵抗的小鼠卵巢癌模型使用CXCR4拮抗剂后发现,其原位抗肿瘤效应得到明显增强,肿瘤体积明显缩小[40]。在小鼠卵巢癌模型中,CCR4单抗可以通过调节肿瘤浸润Treg细胞,增强机体抗肿瘤免疫反应从而抑制肿瘤的生长[41]。与单独应用索菲替尼相比,CXCR2抑制剂与索菲替尼的联合应用可以明显增强抗肿瘤效应,且肿瘤的血管生成也会被进一步抑制[42]。由此可见,以趋化因子受体为靶点的免疫治疗可能成为一种新的卵巢癌治疗手段。本文就卵巢癌中相关趋化因子受体的临床意义与主要的作用机制的总结见表1。
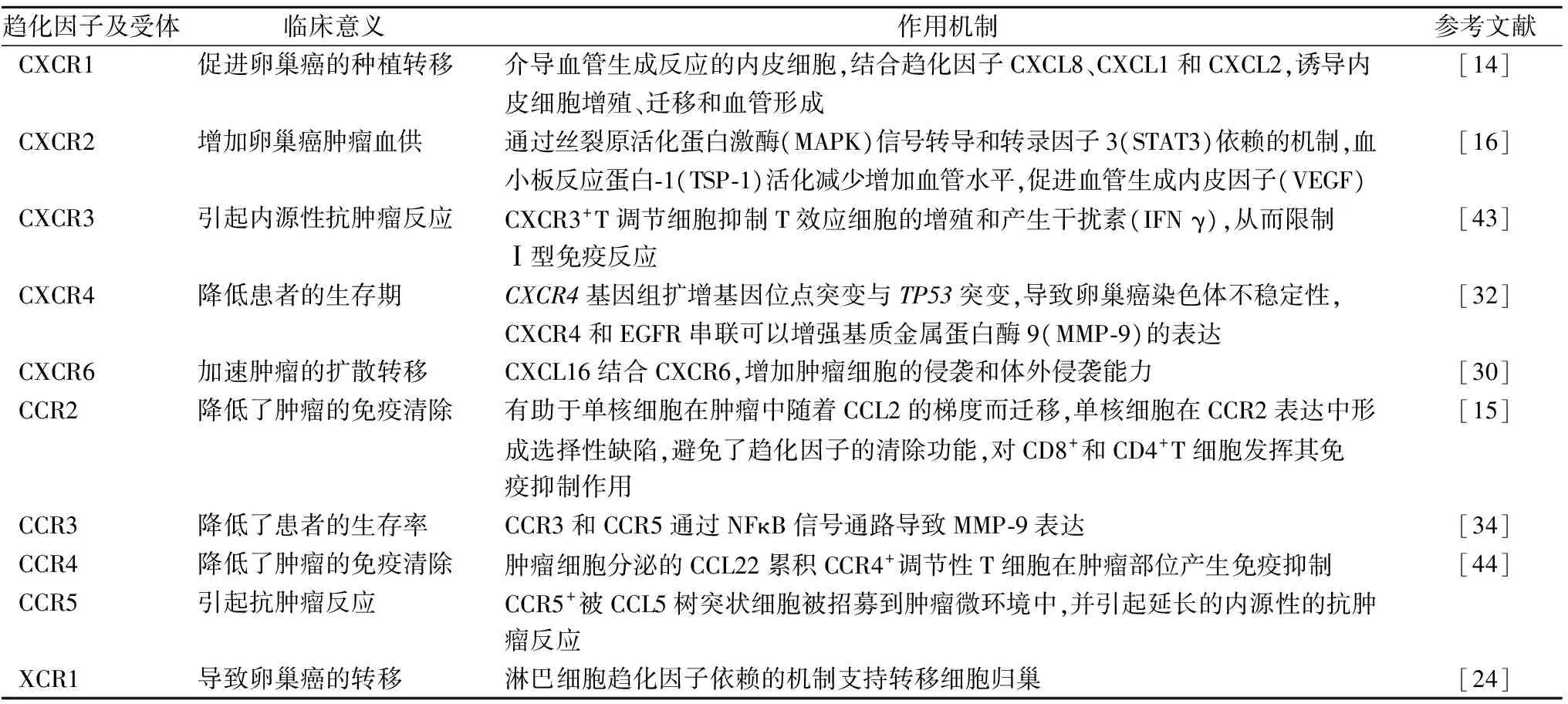
表1 卵巢癌中相关趋化因子受体的临床意义与作用机制
5 展望
卵巢癌的生长、侵袭和转移是多因素、多步骤的协同过程,包括细胞的转化、血管生成的前期环境形成、局部肿瘤细胞的生长、细胞外基质降解、肿瘤细胞突破血管基底膜进入血液循环系统,形成肿瘤细胞向特定组织器官的非随机性转移。趋化因子及其受体可参与肿瘤发生的多个环节,也是卵巢癌进展的主要调节因子,研究趋化因子受体可作为治疗卵巢癌潜在的靶点。
[1]Salcedo R, Resau JH, Halverson D,etal. Differential expression and responsiveness of chemokine receptors (CXCR1-3) by human microvascular endothelial cells and umbilical vein endothelial cells[J]. FASEB J, 2000, 14(13):2055-2064.
[2]Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1):11-30.
[3]Furue M. Epithelial tumor, invasion and stroma[J]. Ann Dermatol, 2011, 23(2):125-131.
[4]Furukawa S, Soeda S, Kiko Y,etal. MCP-1 promotes invasion and adhesion of human ovarian cancer cells[J]. Anticancer Res, 2013, 33(11):4785-4790.
[5]Latek D, Modzelewska A, Trzaskowski B,etal. G protein-coupled receptors--recent advances[J]. Acta Biochim Pol, 2012, 59(4):515-529.
[6]Kiefer F, Siekmann AF. The role of chemokines and their receptors in angiogenesis[J]. Cell Mol Life Sci, 2011, 68(17):2811-2830.
[7]Raman D, Sobolik-Delmaire T, Richmond A. Chemokines in health and disease[J]. Exp Cell Res, 2011, 317(5):575-589.
[8]Raman D, Sai J, Neel NF,etal. LIM and SH3 protein-1 modulates CXCR2-mediated cell migration[J]. PLoS One, 2010, 5(4):e10050.
[9]Schall TJ, Proudfoot AE. Overcoming hurdles in developing successful drugs targeting chemokine receptors[J]. Nat Rev Immunol, 2011, 11(5):355-363.
[10]Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5):646-674.
[11]Gavalas NG, Liontos M, Trachana SP,etal. Angiogenesis-related pathways in the pathogenesis of ovarian cancer[J]. Int J Mol Sci, 2013, 14(8):15885-15909.
[12]Musrap N, Diamandis EP. Revisiting the complexity of the ovarian cancer microenvironment--clinical implications for treatment strategies[J]. Mol Cancer Res, 2012, 10(10):1254-1264.
[13]Bamias A, Pignata S, Pujade-Lauraine E. Angiogenesis: a promising therapeutic target for ovarian cancer[J]. Crit Rev Oncol Hematol, 2012, 84(3):314-326.
[14]Agarwal A, Tressel SL, Kaimal R,etal. Identification of a metalloprotease-chemokine signaling system in the ovarian cancer microenvironment: implications for antiangiogenic therapy[J]. Cancer Res, 2010, 70(14):5880-5890.
[15]Wu K, Cui L, Yang Y,etal. Silencing of CXCR2 and CXCR7 protects against esophageal cancer[J]. Am J Transl Res, 2016, 8(8):3398-3408.
[16]Yang G, Rosen DG, Liu G,etal. CXCR2 promotes ovarian cancer growth through dysregulated cell cycle, diminished apoptosis, and enhanced angiogenesis[J]. Clin Cancer Res, 2010, 16(15):3875-3886.
[17]Wu Y, Zhang C, Xu W,etal. CXC motif chemokine receptor 4 gene polymorphism and cancer risk[J]. Medicine (Baltimore), 2016, 95(49):e5317.
[18]Righi E, Kashiwagi S, Yuan J,etal. CXCL12/CXCR4 blockade induces multimodal antitumor effects that prolong survival in an immunocompetent mouse model of ovarian cancer[J]. Cancer Res, 2011, 71(16):5522-5534.
[19]Wu N, Xu L, Yang Y,etal. Tetramethylpyrazine-mediated regulation of CXCR4 in retinoblastoma is sensitive to cell density[J]. Mol Med Rep, 2017,15(5):2481-2488.
[20]Lotfi R, Lee JJ, Lotze MT. Eosinophilic granulocytes and damage-associated molecular pattern molecules (DAMPs): role in the inflammatory response within tumors[J]. J Immunother, 2007, 30(1):16-28.
[21]Facciabene A, Peng X, Hagemann IS,etal. Tumour hypoxia promotes tolerance and angiogenesis via CCL28 and T(reg) cells[J]. Nature, 2011, 475(7355):226-230.
[22]Kim M, Rooper L, Xie J,etal. Fractalkine receptor CX(3)CR1 is expressed in epithelial ovarian carcinoma cells and required for motility and adhesion to peritoneal mesothelial cells[J]. Mol Cancer Res, 2012, 10(1):11-24.
[23]Gaudin F, Nasreddine S, Donnadieu AC,etal. Identification of the chemokine CX3CL1 as a new regulator of malignant cell proliferation in epithelial ovarian cancer[J]. PLoS One, 2011, 6(7):e21546.
[24]Kim M, Rooper L, Xie J,etal. The lymphotactin receptor is expressed in epithelial ovarian carcinoma and contributes to cell migration and proliferation[J]. Mol Cancer Res, 2012, 10(11):1419-1429.
[25]Joyce JA, Pollard JW. Microenvironmental regulation of metastasis[J]. Nat Rev Cancer, 2009, 9(4):239-252.
[26]Junttila MR, de Sauvage FJ. Influence of tumour micro-environment heterogeneity on therapeutic response[J]. Nature, 2013, 501(7467):346-354.
[27]Schauer IG, Sood AK, Mok S,etal. Cancer-associated fibroblasts and their putative role in potentiating the initiation and development of epithelial ovarian cancer[J]. Neoplasia, 2011, 13(5):393-405.
[28]Lau TS, Chung TK, Cheung TH,etal. Cancer cell-derived lymphotoxin mediates reciprocal tumour-stromal interactions in human ovarian cancer by inducing CXCL11 in fibroblasts[J]. J Pathol, 2014, 232(1):43-56.
[29]Archibald KM, Kulbe H, Kwong J,etal. Sequential genetic change at the TP53 and chemokine receptor CXCR4 locus during transformation of human ovarian surface epithelium[J]. Oncogene, 2012, 31(48):4987-4995.
[30]Guo L, Cui ZM, Zhang J,etal. Chemokine axes CXCL12/CXCR4 and CXCL16/CXCR6 correlate with lymph node metastasis in epithelial ovarian carcinoma[J]. Chin J Cancer, 2011, 30(5):336-343.
[31]Barbolina MV, Kim M, Liu Y,etal. Microenvironmental regulation of chemokine (C-X-C-motif) receptor 4 in ovarian carcinoma[J]. Mol Cancer Res, 2010, 8(5):653-664.
[32]Guo Z, Cai S, Fang R,etal. The synergistic effects of CXCR4 and EGFR on promoting EGF-mediated metastasis in ovarian cancer cells[J]. Colloids Surf B Biointerfaces, 2007, 60(1):1-6.
[33]Miyanishi N, Suzuki Y, Simizu S,etal. Involvement of autocrine CXCL12/CXCR4 system in the regulation of ovarian carcinoma cell invasion[J]. Biochem Biophys Res Commun, 2010, 403 (1):154-159.
[34]Long H, Xie R, Xiang T,etal. Autocrine CCL5 signaling promotes invasion and migration of CD133+ ovarian cancer stem-like cells via NF-kappaB-mediated MMP-9 upregulation[J]. Stem Cells, 2012, 30(10):2309-2319.
[35]Liu CF, Liu SY, Min XY,etal. The prognostic value of CXCR4 in ovarian cancer: a meta-analysis[J]. PLoS One, 2014, 9(3):e92629.
[36]Jaszczynska-Nowinka K, Rucinski M, Ziolkowska A,etal. Expression of SDF-1 and CXCR4 transcript variants and CXCR7 in epithelial ovarian cancer[J]. Oncol Lett, 2014, 7(5):1618-1624.
[37]Jin JJ, Dai FX, Long ZW,etal. CXCR6 predicts poor prognosis in gastric cancer and promotes tumor metastasis through epithelial-mesenchymal transition[J]. Oncol Rep, 2017, 37(6):3279-3286.
[38]Ke C, Ren Y, Lv L,etal. Association between CXCL16/CXCR6 expression and the clinicopathological features of patients with non-small cell lung cancer[J]. Oncol Lett, 2017, 13(6):4661-4668.
[39]Xin Q, Zhang N, Yu HB,etal. CXCR7/CXCL12 axis is involved in lymph node and liver metastasis of gastric carcinoma[J]. World J Gastroenterol, 2017, 23(17):3053-3065.
[40]Komorowski MP, McGray AR, Kolakowska A,etal. Reprogramming antitumor immunity against chemoresistant ovarian cancer by a CXCR4 antagonist-armed viral oncotherapy[J]. Mol Ther Oncolytics, 2016, 3:16034.
[41]Chang DK, Peterson E, Sun J,etal. Anti-CCR4 monoclonal antibody enhances antitumor immunity by modulating tumor-infiltrating Tregs in an ovarian cancer xenograft humanized mouse model[J]. Oncoimmunology, 2016, 5(3):e1090075.
[42]Devapatla B, Sharma A, Woo S. CXCR2 Inhibition combined with sorafenib improved antitumor and antiangiogenic response in preclinical models of ovarian cancer[J]. PLoS One, 2015, 10(9):e0139237.
[43]Redjimi N, Raffin C, Raimbaud I,etal. CXCR3+ T regulatory cells selectively accumulate in human ovarian carcinomas to limit type I immunity[J]. Cancer Res, 2012, 72(17):4351-4360.
[44]Fialova A, Partlova S, Sojka L,etal. Dynamics of T-cell infiltration during the course of ovarian cancer: the gradual shift from a Th17 effector cell response to a predominant infiltration by regulatory T-cells[J]. Int J Cancer, 2013, 132(5):1070-1079.
2017-06-19)
(本文编辑:许晓蒙)
10.13602/j.cnki.jcls.2017.11.09
国家科技支撑计划(2015BAI12B12);国家自然科学基金资助项目(31570877、31570908);海外及港澳学者合作研究基金(31428005);江苏省条件建设与民生科技专项资金项目(BL2014034);江苏省肿瘤免疫治疗工程技术研究中心(BM2014404);江苏省重点研发计划项目(BE2015633)。
芮小慧,1978年生,女,副主任医师,博士研究生,主要从事肿瘤治疗及妇科学研究。
蒋敬庭,教授,博士,博士研究生导师,E-mail:jiangjingting@suda.edu.cn。
R737.31
A

