葡聚糖糖基化处理对绿豆蛋白抗氧化性影响研究
江连洲,张潇元,伍 丹,张菀坤,张 璟,卢 燕,全惟诚,米 思,刘 爽,王中江
(东北农业大学食品学院,哈尔滨 150030)
葡聚糖糖基化处理对绿豆蛋白抗氧化性影响研究
江连洲,张潇元,伍 丹,张菀坤,张 璟,卢 燕,全惟诚,米 思,刘 爽,王中江
(东北农业大学食品学院,哈尔滨 150030)
以绿豆分离蛋白(MBPI)和葡聚糖为原料,通过湿热法制备MBPI-Dextran共价复合物。本研究通过测定产物的还原力、DPPH自由基清除能力、超氧阴离子自由基、羟自由基清除能力共同评价糖基化反应对MBPI抗氧化能力的影响。结果表明:MBPI-Dextran共价复合物具有一定的抗氧化能力,特别是90℃条件下反应得到的产物,抗氧化能力较80℃产物显著提升,这与美拉德反应程度有关,较高温度下美拉德反应进程加快,促使更多具有抗氧化能力的物质生成。因此,糖基化改性后的绿豆蛋白在抗氧化能力研究上具有一定的应用价值。
绿豆蛋白;葡聚糖;糖基化处理;抗氧化性
不同品种的绿豆中蛋白含量为20%~30%[1],所含蛋白质中60%以上都是水溶性球蛋白[2]。美拉德反应被广泛认为是有效和安全的提高蛋白质功能性质的方法[3-4]。目前的研究较多集中于利用生物酶解技术来制备绿豆肽,极少考虑利用糖基化对绿豆中的蛋白质进行改性[5-6]。本研究通过对糖基化改性后绿豆蛋白的抗氧化性进行研究,运用多种分析检测手段,探讨糖基化反应在绿豆分离蛋白中对其抗氧化能力所起的影响,同时对其作用机理进行探究,以期为拓展绿豆蛋白的应用范围提供理论依据。
1 材料与方法
1.1 材料与试剂
绿豆分离蛋白,实验室碱溶酸沉法自制(蛋白质含量90.76%);葡聚糖,中国医药集团上海化学试剂有限公司;邻苯二甲醛(OPA),天津市科密欧化学试剂厂;氢氧化钠、盐酸、磷酸二氢钠、磷酸氢二钠:分析纯试剂。
1.2 主要仪器设备
PH SJ-4A型实验室pH计,中国上海雷磁公司;JJ-1增力电动搅拌器,江苏省金坛市金城国胜实验仪器厂;TD5M-WS台式大容量离心机,上海卢湘仪离心机仪器有限公司;722型可见分光光度计,上海光谱仪器有限公司。
1.3 试验方法
1.3.1绿豆分离蛋白的制备 绿豆→浸泡12h(料液比为1∶ 10,4℃)→去皮→磨浆→用2mol/L NaOH调节pH为9.0→室温下搅拌20min→10 000×g离心30min(4℃)→上清液用2mol/L HCl调节pH为4.0→10 000×g离心30min(4℃)→沉淀加水分散→用2mol/L NaOH调节pH值至中性→真空冷冻干燥(-50℃)→绿豆分离蛋白。
1.3.2绿豆分离蛋白—糖接枝物的制备 将绿豆分离蛋白和葡聚糖(1/1)溶解于磷酸盐缓冲溶液中,搅拌2h至完全溶解,置于水浴锅中反应,反应结束后迅速冷却至室温,离心后上清液置于蒸馏水中透析24h(4℃),冻干成粉后置于冰箱中备用。
1.3.3接枝度测定 采用OPA法。配制OPA试剂,此试剂要现配现用。准确称取40.0 mg的OPA溶解于1.0 mL甲醇中,再加入20%(w/w)的十二烷基硫酸钠(SDS)2.5 mL,硼砂(0.1 mol/L)25.0 mL,β-巯基乙醇100 μL最后用蒸馏水定容到50 mL。在测定过程中,取1支干净试管放入4.0 mL的OPA试剂以及200 μL的样品,混匀,置于35℃的恒温水浴锅中水浴2 min,并用可见分光光度计于340nm下测出吸光值A340。同时,另取一支试管中放入4.0 mL OPA试剂和200 μL水作为空白对照。
接枝度可以用式(1)计算:
DG(%)=[(A0-A1)/A0]×100
(1)
式(1)中:A0—接枝反应前溶液的吸光值;A1—接枝反应后溶液的吸光值
1.3.4接枝产物褐变程度的测定 用0.1% SDS(w/w)将样品液稀释至蛋白浓度为0.2%(w/v),以稀释液做空白,在420 nm下测定吸光值A420。
1.3.5DPPH自由基清除能力测定 根据Benjakul S[7]的方法对接枝产物的DPPH自由基清除能力进行测定。当日配制0.1 mmol/L DPPH-乙醇溶液,避光保存。取2 mL的上述溶液,加入1 mL一定蛋白浓度的蛋白或者接枝物溶液,混合均匀后,25℃下避光反应30 min,然后测定溶液在517 nm处的吸光值。对照中样品溶液由去离子水替代,空白中DPPH-乙醇溶液由无水乙醇替代。DPPH自由基清除能力根据式(2)计算:
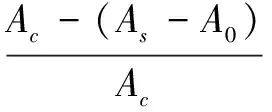
(2)
式(2)中:Ac—对照的吸光值;AS—样品溶液的吸光值;A0—空白的吸光值
1.3.6还原力测定 参照Oyaizu的方法[8]对接枝产物的还原力进行测定。取样品0.5mL(5mg/mL),加入浓度为0.2mol/L、pH值为6.6的磷酸盐缓冲液2.5mL以及1%的铁氰化钾溶液2.5mL,充分搅拌。在恒温水浴锅内将混合物在5℃条件下保持恒温20min后加入冰块进行冷却,再加入10%的三氯乙酸溶液2.5mL,将样液置于3 000r/min离心机下离心10min。随后用移液枪取上清液2.5mL,蒸馏水2.5mL以及0.1%的氯化铁溶液0.5mL,充分搅拌,静置10min后,并用可见分光光度计在700nm处测定溶液的吸光值。
1.3.7羟基自由基(OH·)清除能力的测定 通过Fenton体系模型[9]测定羟基自由基(OH·)的清除能力。吸取9.0mmol/L FeSO4和9.0mmol/L水杨酸乙醇溶液各2.0mL,然后加入10mg/mL样品液2mL,最后加入2mL 8.8mmol/L H2O2。对照液中样品液由去离子水替代,并于37℃下保持恒温30min。以蒸馏水为空白,用可见分光光度计在510nm处测定其吸光值。
对OH·清除率的公式如式(3):
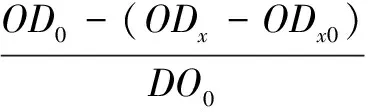
(3)
式(3)中:OD0——空白对照液吸光度值;ODx——加入样品液后吸光值;ODx0——样品的本底吸光度值

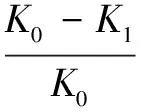
(4)
1.4 数据统计及分析
至少进行3次试验,利用Origin9.1软件、OMNIC软件包等进行数据分析,图表处理及图谱分析处理。
2 结果与分析
2.1 反应时间对糖基化反应接枝度和褐变程度的影响
图1表明,产物的接枝度在反应进行过程中逐渐增加。这是因为,在初期,蛋白质链上的ε-氨基基团并未完全暴露,随着糖基化反应时间延长,ε-氨基基团不断暴露出来,与还原性羧基末端发生反应程度增加,从而增加产物的接枝度[11-12]。游离氨基和还原性羰基之间产生的化学反应同时也能提高产物的褐变程度。美拉德反应的高级阶段涉及Amadori产物的降解,和生成被称为“类黑精”的有色的高分子化合物[13]。同时,褐变程度也在反应进行的过程中逐渐增加,这表明有部分美拉德反应的高级产物生成。
图2为90℃条件下反应的接枝度先迅速增加而后增加速度变缓,这是因为,温度过高在促进蛋白和多糖之间反应的同时,也使蛋白质之间发生了一定程度的聚集,从而不利于反应的继续进行。随反应时间延长产物的褐变程度急剧增加,这表明90℃下美拉德反应的高级产物生成量逐渐增加。反应时间过长导致产物出现不良的色泽和气味,这会限制其在食品工业中的应用,因此,控制反应的时间和温度在一定范围内是十分必要的。
2.2 还原力
由图3可知,产物的还原力随着反应时间的延长缓慢升高。研究表明,美拉德反应初级阶段的Amadori热解产物[14-15]、中间产物还原酮[16]、高级阶段产物裂解形成“类黑精[17]”都具有一定的还原能力,此外,焦糖化反应产物也具有一定的还原能力[18]。其中,中间产物还原酮是起到还原能力的主要物质[19]。80℃条件下随着反应时间延长,产物接枝度不断增大,中间产物还原酮积累增多,因此,产物的还原力不断增大。Limsuwanmanee J等[18]研究发现,美拉德反应产物中羟基基团的存在与其还原性呈相关性。Daglia等[20]研究表明,美拉德反应产物是一种特殊的由许多不同分子量的化合物组成的物质,特别是高分子量化合物。这种高分子量化合物是使产物表现出抗氧化性质的主要物质。由图4可知,在反应开始1h内产物的还原能力增加较小,随反应时间延长还原力迅速上升,并在反应4h后达到峰值,继续延长反应时间,产物还原力有略微的下降,但仍处于较高水平。整体上90℃下产物的还原能力较80℃条件下产物有所提高,这可能是由于90℃下美拉德反应速率提高,产物褐变程度进一步增大,美拉德高级产物积累由此增多而导致。有研究表明,高级美拉德产物中的这些羟基基团也是使其表现出还原能力的重要物质[16]。反应时间继续延长,产物还原力下降,这可能是因为过度热处理一部分具有还原能力的产物分解所致。
2.3 DPPH自由基清除能力
图5结果表明,在美拉德反应过程中,中间产物和终产物“类黑精”均可作为氢供体,其中高级阶段产物“类黑精”主要起消除自由基作用[21-22]。随着美拉德反应时间延长,产物的褐变程度逐渐增强,DPPH自由基清除能力也随之增大。图6结果表明,在反应开始1h内,DPPH自由基清除能力上升幅度较小,反应2h后急剧增加,反应进行到3h时,产物DPPH自由基清除能力达到峰值,之后DPPH自由基清除能力缓慢下降。研究表明,高级阶段产物“类黑精”主要起清除自由基作用。在反应开始阶段,DPPH自由基清除能力提升并不明显,这是由于美拉德反应高级阶段产物生成量有限;随着时间延长,高级产物积累增多,DPPH自由基清除能力随之增大,但反应时间过长,DPPH自由基清除能力也会下降,这可能是由于过度的热处理,蛋白质发生剧烈聚集,不利于自由基清除反应的发生。90℃下产物相比于80℃反应产物DPPH清除能力有所提高,这是由于90℃下产物反应程度更高,在美拉德反应过程中积累了更多高级产物“类黑精”。但整体而言,MBPI-葡聚糖共价复合物DPPH自由基清除能力水平略低。有报道称,DPPH自由基是一类相对疏水的自由基,较难作用于蛋白质、多糖类大分子,从而导致其难以与MBPI及MBPI-葡聚糖共价复合物作用,使样品整体的DPPH自由基清除处于较低水平[23]。
2.5 羟自由基(·OH)清除能力
由图9、10可知,90℃下产物反应开始1h时,·OH清除能力迅速提升,之后随着反应时间的延长呈现先缓慢上升而后下降的趋势,反应4h时产物的·OH清除能力达到峰值,为未处理MBPI的1.46倍,随着反应时间的延长,·OH清除能力出现下降,研究发现是由于美拉德反应产物中具有·OH清除能力的物质在长时间高温加热的环境下被热分解。反应一定时间后80℃与90℃产物的·OH清除能力相当,表明糖基化反应产物对·OH清除能力的影响有限。整体上MBPI-葡聚糖共价复合物的·OH清除能力高于MBPI,原因可能是,MBPI与葡聚糖共价结合后导致分子量变大以及螯合Fe2+的能力增强,使MBPI无法产生羟自由基,进一步阻断了反应的继续进行,最终表现为其清除能力的增强[24]。

图1 80℃下反应时间对接枝度及褐变程度的影响

图2 90℃下反应时间对接枝度及褐变程度的影响

图3 80℃下反应时间对MBPI-Dextran共价复合物还原力的影响
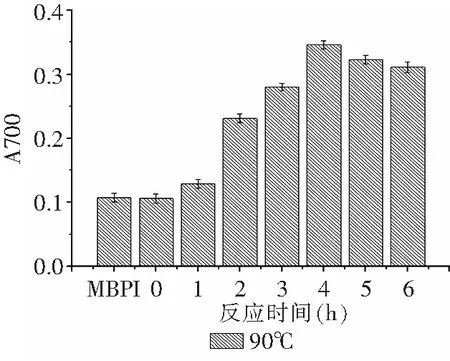
图4 90℃下反应时间对MBPI-Dextran共价复合物还原力的影响
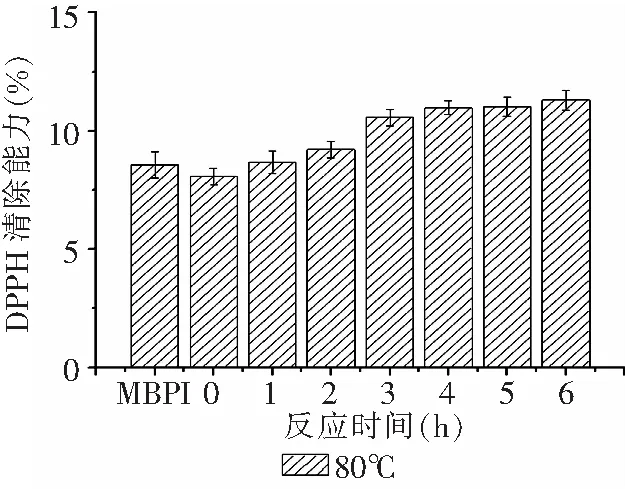
图5 80℃下反应时间对MBPI-Dextran共价复合物DPPH自由基清除能力的影响

图6 90℃下反应时间对MBPI-葡聚糖共价复合物DPPH自由基清除能力的影响

图7 80℃下反应时间对MBPI-Dextran共价复合物超氧自由基清除能力的影响
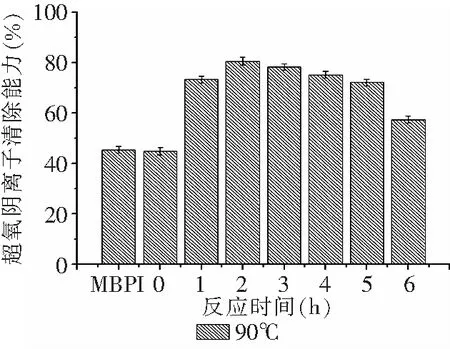
图8 90℃下反应时间对MBPI-Dextran共价复合物超氧自由基清除能力的影响

图9 80℃下反应时间对MBPI-Dextran共价复合物DPPH自由基清除能力的影响
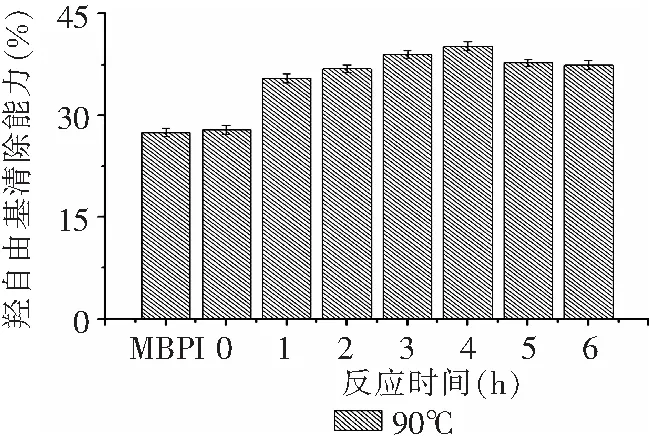
图10 90℃下反应时间对MBPI-Dextran共价复合物DPPH自由基清除能力的影响
3 结论

[1]R.N.Adsule,et al.Chemistry and technology of green gram(Vigna radiata L.Wilczek)[J].Critical Reviews in Food Science and Nutrition,1986,25(1):73-105.
[2]邓志汇,王娟.绿豆皮与绿豆仁的营养成分分析及对比[J].现代食品科技,2010,26(6):656-659.
[3]Oliveira F C,et al.Food Protein-Polysaccharide Conjugates obtained via the Maillard Reaction:A Review[J].Critical Reviews in Food Science and Nutrition,2016,56(7):1108.
[4]And M T,Saeki H.Effect of Maillard Reaction with Glucose and Ribose on Solubility at Low Ionic Strength and Filament-Forming Ability of Fish Myosin[J].J Agric Food Chemistry,2001,49(7):3403-3407.
[5]Eladawy T A.Functional properties and nutritional quality of acetylated and succinylated mung bean protein isolate[J].Food Chemistry,2000,70(1):83-91.
[6]Li C,et al.Comparative studies on the physicochemical properties of peanut protein isolate-polysaccharide conjugates prepared by ultrasonic treatment or classical heating[J].Food Research International,2014(57):1-7.
[7]Benjakul S,et al.Antioxidative activity of caramelisation products and their preventive effect on lipid oxidation in fish mince[J].Food Chemistry,2005,90(1-2):231-239.
[8]Choi Y,Jeong H-S,Lee J.Antioxidant activity of methanolic extracts from some grains consumed in Korea[J].Food Chemistry,2007,103(1):130-138.
[9]Halliwell B,Gutteridge J M.Role of free radicals and catalytic metal ions in human disease:An overview[J].Methods in Enzymology,1990,186(186):1-85.
[10]张宏,谭竹钧.四种邻苯三酚自氧化法测定超氧化物歧化酶活性方法的比较[J].内蒙古大学学报(自然科学版),2002,33(6):677-681.
[11]Geng X,et al.Preparation and characterization of ovalbumin and carboxymethyl cellulose conjugates via glycosylation[J].Food Hydrocolloids,2014,37(37):86-92.
[12]Zhuo X Y,Qi J R,Yin S W,et al.Formation of soy protein isolate-dextran conjugates by moderate Maillard reaction in macromolecular crowding conditions[J].Journal of the Science of Food and Agriculture,2013,93(2):316-323.
[13]O’Regan J,Mulvihill D M.Preparation,characterisation and selected functional properties of sodium caseinate-maltodextrin conjugates[J].International Journal of Dairy Technology,2009,115(4):1257-1267.
[14]Gu F,et al.Characteristics and antioxidant activity of ultrafiltrated Maillard reaction products from a casein-glucose model system[J].Food Chemistry ,2009,117(1):48-54.
[15]Hwang J-Y,Shue Y-S,Chang H-M.Antioxidative activity of roasted and defatted peanut kernels[J].Food Research International,2001,34(7):639-647.
[16]Rao M,et al.Antioxidant potential of Maillard reaction products formed by irradiation of chitosa-glucose solution[J].Carbohydrate Polymers,2011,83(2):714-719.
[17]Dong S,et al.Characteristics and antioxidant activity of hydrolyzed β-lactoglobulin-glucose Maillard reaction products[J].Food Research International,2012,46(1):55-61.
[18]Limsuwanmanee J,et al.Antioxidant activity of Maillard reaction products derived from stingray non-protein nitrogenous fraction and sugar model systems[J].LWT-Food Science and Technology,2014,57(2):718-724.
[19]Liu P,et al.Sensory characteristics and antioxidant activities of Maillard reaction products from soy protein hydrolysates with different molecular weight distribution[J].Food and Bioprocess Technology,2012,5(5):1775-1789.
[20]Daglia M,Papetti A,Aceti C,et al.Isolation of high molecular weight components and contribution to the protective activity of coffee against lipid peroxidation in a rat liver microsome system[J].Journal of Agricultural and Food Chemistry,2008,56(24):11653-11660.
[21]Shon M-Y,Kim T-H,Sung N-J.Antioxidants and free radical scavenging activity of Phellinus baumii extracts[J].Food Chemistry,2003,82(4):593-597.
[22]Wang H-Y,Qian H,Yao W-R.Melanoidins produced by the Maillard reaction:Structure and biological activity[J].Food Chemistry,2011,128(3):573-584.
[23]Pachekrepapol U,et al.Interactions between acidified dispersions of milk proteins and dextran or dextran sulfate[J].Journal of Dairy Science,2014,97(9):5371-5382.
[24]王文琼.改性乳清蛋白抗氧化性及山核桃油微胶囊制备[D].东北林业大学,2013.
[25]Chance B,Sies H,Boveris A.Hydroperoxide metabolism in mammalian organs[J].Physiological Reviews,1979,59(3):527-605.
(责任编辑 李婷婷)
The Inoxidizability of Mung Bean Protein with Dextran Glycosylation Process
JIANG Lian-zhou,ZHANG Xiao-yuan,WU Dan,ZHANG Wan-kun,ZHANG Jing,LU Yan,QUAN Wei-cheng,MI Si,LIU Shuang,WANG Zhong-jiang
(College of Food Science,Northeast Agricultural Univeristy,Harbin 150030,China)

mung bean protein;dextran;glycosylation process;inoxidizability
国家自然科学基金面上项目(项目编号:31671807、3157101375);十三五重点研发专项“中华传统食品工业化加工关键技术研究与装备开发”(项目编号:2016YED0400402);方便即食豆制品制造关键技术研究及新产品创制(项目编号:2016YFD0400702);霍英东教育基金会高等院校青年教师基金(项目编号:20152325210002)。
江连洲(1960— ),男,博士,教授,研究方向:粮食、油脂及植物蛋白工程。
王中江(1987— ),男,博士,研究方向:粮食、油脂及植物蛋白工程。

