氯胺酮通过改变Fos和Bcl-2表达减轻缺氧对大鼠海马群峰电位的抑制*
彭 坚, 陈 堃, 廖明锋, 张志发, 徐 萍, 李 璐, 吴娅琴, 龙 思, 王学仁△
1华中科技大学同济医学院附属同济医院麻醉学教研室,武汉 430030 2武汉市第三医院麻醉科,武汉 430060 3华中科技大学同济医学院附属协和医院神经内科,武汉 430022
氯胺酮通过改变Fos和Bcl-2表达减轻缺氧对大鼠海马群峰电位的抑制*
彭 坚1,2, 陈 堃1, 廖明锋1, 张志发1, 徐 萍3, 李 璐1, 吴娅琴1, 龙 思1, 王学仁1△
1华中科技大学同济医学院附属同济医院麻醉学教研室,武汉 4300302武汉市第三医院麻醉科,武汉 4300603华中科技大学同济医学院附属协和医院神经内科,武汉 430022
目的通过观察氯胺酮处理对缺氧引起的大鼠海马诱发群峰电位、神经元Fos、Bcl-2表达的影响,探讨氯胺酮对神经元缺氧性损伤保护作用机制。方法脑片以及培养细胞随机分为3组:对照组(不进行缺氧处理)、缺氧组和氯胺酮组(缺氧前于培养液中加入氯胺酮,终浓度为20 μmol/L,其它处理同缺氧组)。脑片记录:成年雄性Wistar大鼠麻醉后取海马切片,进行CA3区Schaffer侧支刺激,记录CA1区椎体细胞诱发电位。新生大鼠海马神经元培养7~11 d,分组处理后进行免疫组化染色,计算Fos、Bcl-2阳性细胞率。结果氯胺酮预处理后,海马脑片群峰电位开始减小和完全消失的时间延迟;培养海马神经细胞Fos表达阳性率、平均吸光度值与缺氧组比较明显减少(均P<0.05);海马神经细胞Bcl-2表达阳性率、平均吸光度值与缺氧组比较明显增加(均P<0.05)。结论氯胺酮预处理对大鼠海马群峰电位的保护作用可能是通过减少缺氧后Fos表达、增加Bcl-2表达来实现的。
氯胺酮; 大鼠海马神经元; Fos; Bcl-2; 群峰电位; 缺氧
围术期脑缺血缺氧可以导致暂时或永久性脑功能障碍,在一些特殊类型手术如心脏或者颈动脉内膜剥脱术,其发生率可以高达4%~5%[1-2]。有研究提示氯胺酮可减轻神经元缺血缺氧性损伤,有神经保护作用[3-4]。不同脑区的神经元对缺氧损伤的敏感性有一定差异,海马CA1区椎体细胞是对缺氧非常敏感的神经元之一,因此海马神经元经常被用于缺氧研究[5]。c-fos是一种即刻早期反应基因,在神经元活动时表达活跃,被广泛用作神经元活动的标志物。缺氧可以刺激细胞c-fos表达,表达的Fos蛋白与Jun蛋白形成异源二聚体AP-1,AP-1与DNA特异性位点结合,对靶基因发挥转录调控作用[6]。Bcl-2是一种线粒体的调节因子,调控线粒体外膜通透性,增加Bcl-2表达可以抑制缺氧损伤[7]。本研究拟探讨氯胺酮处理对缺氧引起的大鼠海马群峰电位、神经元Fos、Bcl-2表达的影响,探讨氯胺酮保护缺氧性神经突触抑制的机制。
1 材料与方法
1.1 大鼠海马脑片制作
取雄性成年Wistar大鼠(同济医学院实验动物中心提供,体重120~200 g),麻醉下断头,取脑置于4 ℃、95% O2+5% CO2饱和的人工脑脊液中,仔细剥出双侧海马,垂直于海马长轴切成400 μm厚度的薄片。将全部脑片置于34℃人工脑脊液内,通入95% O2+5% CO2混合气,孵育1.5~2 h待用。
1.2 原代大鼠海马神经元的培养
取当天新生Wistar大鼠(同济医学院实验动物中心提供),75%乙醇消毒,无菌条件下断头取脑,分离出双侧海马并剪碎,0.125%胰蛋白酶37℃消化30 min。显微镜下观察,细胞间连接透亮后终止消化,200 μm滤网筛除未消化的组织块,收集滤液离心,吸弃上清夜,用种植培养液(DMEM/F12 80%、胎牛血清10%、马血清10%、谷氨酰胺100 μg/mL,加入青链霉素使其终浓度为1%)稀释细胞接种于24孔培养板,置于37 ℃、10% CO2培养箱,3~5 d后,加入细胞分裂抑制剂阿糖胞苷3 μg/mL,抑制非神经细胞增殖,作用24 h更换饲养培养液(DMEM/F12 90%、马血清10%、谷氨酰胺100 μg/mL,加入青链霉素使其终浓度为1%),以后每3 d更换培养液1次,第7~11天备用。
1.3 脑片诱发电位记录和实验分组
孵育后的脑片随机分为3组(n=8):对照组、缺氧组和氯胺酮组。脑片置于半浸式浴槽中,通入95% O2+5% CO2混合气,流量200 mL/min。由三道电子刺激器(Kohden SEN7130,日本)输出方波信号,波宽100 μm,电流强度0.1~0.4 mA。经隔离器直径40 μm的绝缘不锈钢丝制成的双极电极,进行CA3区Schaffer侧支刺激,记录电极为自制玻璃微电极,内充4 mol/L NaCl,电极电阻4~15 MΩ,电信号经微电极放大器(Kohden MEZ8201,日本)放大后显示在示波器(Kohden VC-10)上监测,记录CA1区椎体细胞诱发群峰电位(population spike,PS),联机存储处理。对照组:不进行缺氧处理;缺氧组:实验时通入90% N2+10% CO2200 mL/min混合气置换,即开始缺氧;氯胺酮组:缺氧前于灌注液加入氯胺酮(批号:KH091201,江苏恒瑞医药股份有限公司),终浓度为20 μmol/L,随后处理同缺氧组。记录群峰电位开始减小和完全消失的时间。
1.4 培养的海马神经元免疫组织化学染色和实验分组
细胞以5×105~1×106/mL的密度接种于35 mm培养皿,采用随机数字表法分为3组(n=12):对照组、缺氧组和氯胺酮组。对照组:不进行缺氧处理;缺氧组:于培养液中通入90% N2+10% CO250 mL/min缺氧5 min;氯胺酮组:缺氧前1 h,于培养液中加入氯胺酮(批号:KH091201,江苏恒瑞医药股份有限公司),终浓度为20 μmol/L,随后处理同缺氧组。按以下程序行免疫组织化学染色:0.03% H2O2甲醇室温下孵育30 min,正常单血清1∶10 37 ℃作用1 h;加入羊抗Fos(n=6)或者兔抗Bcl-2(n=6)血清(1∶100)中4℃孵育72 h;生物素化兔抗羊IgG(1∶100)或羊抗兔IgG(1∶100)37 ℃作用1 h;链霉亲和素-生物素复合物(1∶100)37 ℃作用1 h,用葡萄糖氧化酶-硫酸镍胺法显色10 min。免疫组织化学图像分析:随机抽取50个相邻视野,在显微镜下分别计数视野中Fos免疫反应和Bcl-2免疫反应阳性和阴性神经元数目,计算阳性神经元所占百分比。应用TTTY-400TC真彩色细胞图像分析仪对各组阳性神经元进行平均吸光度分析。
1.5 统计学处理

2 结果
2.1 氯胺酮预处理对缺氧抑制海马脑片群峰电位的影响
由于海马CA3区和CA1区椎体细胞之间具有突触联系,当局部刺激CA3区侧支通路时,在CA1椎体细胞层可记录到一个幅度较大的群峰电位(population spike,PS),系经突触传递诱发的椎体细胞群体的细胞外电位。在PS之前先出现一个小的去极化电位,为突触前排放(presynaptic volley,PV)。与以前研究结果相似,缺氧可以使海马脑片诱发电位迅速减小并逐渐消失[8],我们的观察发现缺氧2~3 min后PS波幅即开始降低,时程增加,波宽变大,随后逐渐消失。PS消失后,PV随之消失(图1)。本研究首先观察了20 μmol/L氯胺酮对正常海马脑片群峰电位幅度的影响,具体方法是:以灌注加有氯胺酮的人工脑脊液前记录的最后时间点的PS幅值为A1,灌注含有氯胺酮人工脑脊液10 min后记录PS幅值为A2。以A1为100%进行比较,发现A2相对平均值为(99.43±3.36)%(n=10),二者差异无统计学意义。进一步观察氯胺酮对缺氧抑制海马脑片群峰电位的影响发现:与缺氧组比较,氯胺酮预处理后,可以使海马脑片群峰电位缺氧后开始减小和完全消失的时间均延迟(均P<0.05),见表1。
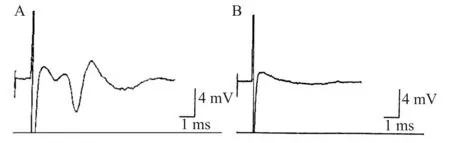
A:开始缺氧前记录的海马脑片群峰电位;B:缺氧后群峰电位消失图1 不同时间点记录的海马脑片群峰电位Fig.1 Population spikes measured in hippocampal slices

组别n群峰电位减小时间(min)消失时间(min)对照组8--缺氧组82.38±0.804.74±1.19氯胺酮组83.99±1.18#7.41±2.04#
与缺氧组比较,#P<0.05
2.2 氯胺酮预处理对缺氧条件下海马神经元Fos表达的影响
与对照组比较,缺氧组和氯胺酮组海马神经元Fos表达阳性的细胞数明显增多,其平均吸光度明显增强(均P<0.05);与缺氧组比较,氯胺酮组的培养海马神经细胞FOS表达阳性的细胞数明显减少,其平均吸光度明显减低(P<0.05),见图2和表2。

A:对照组;B:缺氧组;C:氯胺酮组图2 体外培养海马神经元Fos蛋白的表达变化(×400)Fig.2 Changes of Fos protein expression in cultured hippocampal neurons(×400)

组别Fos阳性细胞(%)平均吸光度值对照组3.32±1.510.11±0.03缺氧组78.82±9.61*1.24±0.16*氯胺酮组66.72±9.23*#0.98±0.15*#
与对照组比较,*P<0.05;与缺氧组比较,#P<0.05
2.3 氯胺酮预处理对缺氧条件下海马神经元Bcl-2表达的影响
与对照组比较,缺氧组和氯胺酮组海马神经元Bcl-2阳性的细胞数明显增多,平均吸光度明显升高(均P<0.05);与缺氧组比较,氯胺酮组的培养海马神经细胞Bcl-2阳性的细胞数明显增多,平均吸光度明显增强(P<0.05),见图3和表3。
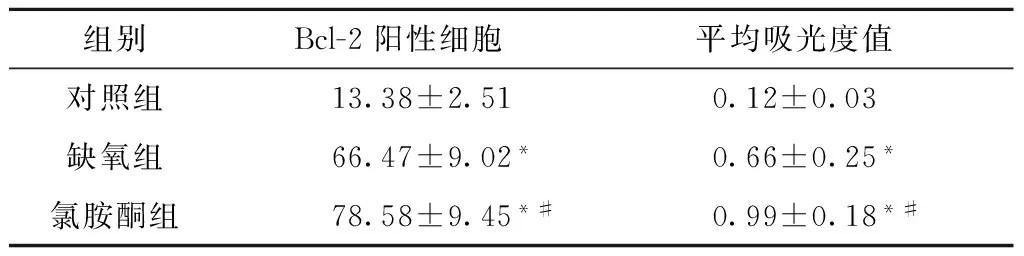
组别Bcl-2阳性细胞平均吸光度值对照组13.38±2.510.12±0.03缺氧组66.47±9.02*0.66±0.25*氯胺酮组78.58±9.45*#0.99±0.18*#
与对照组比较,*P<0.05;与缺氧组比较,#P<0.05
3 讨论
海马是对缺氧最敏感的脑区之一,海马细胞和纤维排列有序,海马细胞易于分离、离体脑片制作简单且方便观察突触功能,因此无论是培养海马神经元还是离体海马脑片均被广泛用于缺氧研究[8-9]。参考文献[4,10],并考虑到培养液内血清白蛋白可结合部分氯胺酮分子,本研究氯胺酮浓度选择为20 μmol/L。
缺氧后PS及随后的PV消失分别是脑细胞突触功能受阻和神经元兴奋性消失的特征。当人工脑脊液中氧气为氮气所代替时,由于氧分压急剧下降,大约75%神经组织的氧分压下降到0~2.67 kPa,在数分钟内氧分压下降到激活突触后神经元的阈值之下,PS即被阻断。研究认为突触传递抑制的主要原因是突触前Ca2+通道失活,次要原因是突触前Na+通道激活[11]。本实验的结果表明,在不缺氧的情况下,氯胺酮使用前后脑片PS幅值无明显变化,不抑制突触传递。经20 μmol/L氯胺酮预处理可以明显延长脑片在缺氧时PS减小和消失时间。说明此浓度的氯胺酮可以保护缺氧引起的神经突触抑制。
大多数种类的细胞在正常条件下,只有较低水平的Fos表达。缺氧可以刺激Fos表达,表达的Fos蛋白与Jun蛋白形成异源二聚体AP-1,AP-1与DNA特异性位点结合,对靶基因发挥转录调控作用[6]。由于脑缺血缺氧诱导Fos在脑内快速而短暂的表达,其mRNA及蛋白被认为是细胞对缺血损伤的敏感标记[12]。在本实验中对照组Fos表达水平低,缺氧组和氯胺酮组经过缺氧处理后Fos表达水平明显高于对照组,但是氯胺酮组Fos表达水平低于缺氧组,说明氯胺酮处理可以降低Fos表达水平。
Bcl-2蛋白是线粒体的调节因子,在脑缺血后抑制神经元凋亡。Bcl-2在调控线粒体膜通透性中起着非常重要的作用,可以防止线粒体膜电位的耗散[13-14]。本实验发现,氯胺酮预处理可以明显增加Bcl-2的表达水平。
NMDA受体在介导缺氧后神经突触抑制和神经元损伤发生中起到非常重要的作用。缺氧导致NMDA受体兴奋,细胞内钙离子浓度升高,突触前特定的钙通道受阻,突触传递终止。氯胺酮是NMDA受体阻滞剂[3-4],可以通过非竞争性抑制NMDA受体减慢细胞内钙离子升高速度,使得Fos表达降低可以改变Fos蛋白激活的下游机制,Bcl-2表达增加可以稳定线粒体膜,防止线粒体功能丧失。这些因素共同延缓了缺氧时的神经突触功能的抑制。
综上所述,氯胺酮预处理可以减轻缺氧性海马神经突触功能抑制,其机制与氯胺酮阻止NMDA受体,降低Fos、增加Bcl-2表达相关。
[1] Mashour G A,Woodrum D T,Avidan M S.Neurologic complications and anaesthesia[J].Br J Anaesth,2015,114(2):194-203.
[2] Bartels K,Karhausen J,Clambey E T,et al.Perioperative organ injury[J].Anesthesiology,2013,119(6):1474-1489.
[3] Engelhard K,Werner C,Eberspacher E,et al.The effect of the alpha 2-agonist dexmedetomidine and the-methyl-D-aspartate antagonist S(+)-ketamine on the expression of apoptosis-regulating proteins after incomplete cerebral ischemia and reperfusion in rats[J].Anesth Analg,2003,96(2):524-531.
[4] Hudetz J A,Pagel P S.Neuroprotection by ketamine:A review of the experimental and clinical evidence[J].J Cardiothorac Vasc Anesth,2010,24(1):131-142.
[5] Zhou C,Bell J J L,Sun H,et al.Hypoxia-induced neonatal seizures diminish silent synapses and long-term potentiation in hippocampal CA1 neurons[J].J Neurosci,2012,31(50):18211-18222.
[6] Yuan G,Adhikary G,McCormick A A,et al.Role of oxidative stress in intermittent hypoxia-induced immediate early gene activation in rat PC12 cells[J].J Physiol,2004,557(3):773-783.
[7] Gross A.BCL-2 family proteins as regulators of mitochondria metabolism[J].Biochim Biophys Acta,2016,1857(8):1243-1246.
[8] Wang T,Raley-Susman K M,Wang J,et al.Thiopental attenuates hypoxic changes of electrophysiology,biochemistry,and morphology in rat hippocampal slice CA1 pyramidal cells[J].Stroke,1999,30(11):2400-2407.
[9] Vieira M,Fermandes J,Carreto L,et al.Ischemic insults induce necroptotic cell death in hippocampal neurons through the up-regulation of endogenous RIP3[J].Neurobio Dis,2014,68:26-36.
[10] 高春霖,王惠军,薛玉良,等.氯胺酮对缺氧复氧诱导胎鼠大脑皮层神经细胞谷氨酸释放的影响[J].中华麻醉学杂志,2006,26(6):561-563.
[11] Lee K Y,Chung H J.NMDA receptors andL-type voltage-gated Ca+channels mediate the expression of bidirectional homeostatic intrinsic plasticity in cultured hippocampal neurons[J].Neuroscience,2014,277(10):610-623.
[12] Kawahara N,Wang Y,Mukasa A,et al.Genome-wide gene expression analysis for induced ischemic tolerance and delayed neuronal death following transient global ischemia in rats[J].J Cereb Blood Flow Metab,2004,24(2):212-223.
[13] Gross A.BCL-2 family proteins as regulators of mitochondria metabolism[J].Biochim Biophys Acta,2016,1857(8):1243-1246.
[14] Soane L,Fiskum G.Inhibition of mitochondrial neural cell death pathways by protein transduction of Bcl-2 family proteins[J].J Bioenerg Biomembr,2005,37(3):179-190.
KetamineAlleviatesHypoxia-inducedInhibitionofPopulationSpikesofRatHippocampusbyChangingExpressionofFosandBcl-2
Peng Jian1,2,Chen Kun1,Liao Mingfeng1et al
1DepartmentofAnesthesiology,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China2DepartmentofAnesthesiology,WuhanNo.3Hospital,Wuhan430060,China
ObjectiveTo discuss the protective role of ketamine in hypoxia-induced damage of neurons by examining the effect of ketamine on population spikes in hypoxia and the expression of Fos and Bcl-2 in rat hippocampus.MethodsThe hippocampal slices and cultured hippocampal neurons were randomly divided into three groups:control group,in which no hypoxic treatment was given;hypoxia group and ketamine group.In the ketamine group,the slices and the neurons were treated with 20 μmol/L ketamine before inducement of hypoxia.The hippocampal slices were obtained from adult male Wistar rats after anesthetization.The Schaffer collaterals in CA3 area were stimulated and the evoked potentials were recorded in CA1 area.The hippocampal neurons of new-born rats were cultured for 7-11 days and staining was performed in neurons in different groups by using anti-goat Fos and anti-rabbit Bcl-2 serum,and the absorbance was detected.ResultsThe decrease in the population spikes and the total disappearance of the spikes were delayed in hippocampal slices pretreated with ketamine.The positive expression rate of Fos and the average absorbance value were significantly lower in ketamine group than in anoxic group(P<0.05),whereas the positive expression rate of Bcl-2 expression and the average absorbance value were significantly higher in ketamine group than in hypoxia group(P<0.05).ConclusionPretreatment with ketamine alleviates hypoxia-induced inhibition of population spikes by decreasing Fos and increasing Bcl-2 expression.
ketamine; rat hippocampal neuron; Fos; Bcl-2; population spike; hypoxia
*国家自然科学基金资助项目(No.81371251)
彭 坚,男,1968年生,副主任医师,E-mail:pengjian699@aliyun.com
△通讯作者,Corresponding author,E-mail:xrwang@hust.edu.cn
R364.4
10.3870/j.issn.1672-0741.2017.05.004
(2017-05-16 收稿)

