15脱氧前列腺素J2对人肝癌细胞增殖和凋亡的影响及其机制*
吴志强, 熊 焰, 刘 , 伍仕敏
1武汉市医疗救治中心检验科,武汉 430023 2华中科技大学同济医学院附属普爱医院,武汉市临床检验中心,武汉 430033
15脱氧前列腺素J2对人肝癌细胞增殖和凋亡的影响及其机制*

1武汉市医疗救治中心检验科,武汉 4300232华中科技大学同济医学院附属普爱医院,武汉市临床检验中心,武汉 430033
目的研究15脱氧前列腺素J2(15-deoxy-Δ12,14-prostaglandin J2,15d-PGJ2)对体外培养的人肝癌HepG2细胞增殖和凋亡的影响,并探讨其作用机制。方法不同浓度的15d-PGJ2干预体外培养的HepG2细胞,采用MTT比色法检测细胞增殖能力,3H-TdR掺入实验检测细胞DNA合成速率,RT-PCR和Western blot检测PPARγ mRNA和蛋白表达情况,流式细胞术检测细胞凋亡率和细胞周期;使用GW9662和/或转染pSG5-PPARγ真核表达质粒来观察PPARγ通路在15d-PGJ2抑制HepG2细胞增殖中的作用,并使用pGCsi-PPARγ转染观察PPARγ沉默后15d-PGJ2对HepG2细胞增殖作用的影响;最后采用凝胶迁移电泳实验(EMSA)检测NF-κB的DNA结合活性。结果15d-PGJ2作用于HepG2细胞后能够导致使细胞增殖受到抑制、DNA合成速率减慢,并诱导了细胞凋亡,此作用呈一定的剂量依赖关系;在上述过程中,G0/G1期细胞比例明显增加,S期细胞比例明显减少,但PPARγ mRNA和蛋白的表达并没有显著变化。GW9662可以部分拮抗15d-PGJ2的增殖抑制作用,但转染pSG5-PPARγ可以逆转GW9662的作用;15d-PGJ2在20 μmol/L时对pGCsi-PPARγ转染的HepG2细胞仍可以表现出增殖抑制效应,EMSA结果表明其在50 μmol/L时明显抑制了NF-κB的DNA结合活性。结论15d-PGJ2能够抑制HepG2细胞的增殖、诱导其凋亡并干扰细胞周期,表现出明显的抑瘤作用,此过程涉及PPARγ依赖途径和非依赖途径,而其中PPARγ非依赖途径可能与其抑制NF-κB的作用有关。
肝细胞癌; 过氧化体增殖物激活型受体γ; 15脱氧前列腺素J2; 细胞增殖; 凋亡; 细胞周期; 核因子-κB;
肝细胞癌(hepatocellular carcinoma,HCC)是高死亡率的原发性肝癌,是临床常见的恶性肿瘤,在肿瘤相关的致死性疾病中排名第3位[1]。过氧化物酶体增殖物激活型受体γ(peroxisome proliferator-activated receptor γ,PPARγ)是一类配体依赖的转录因子,属于核激素受体超家族成员。近年来多项研究表明,PPARγ被其配基激活后,能够调节多种人类肿瘤细胞的增殖、分化以及凋亡[2-4]。15脱氧前列腺素J2(15-deoxy-Δ12,14-prostaglandin J2,15d-PGJ2)是花生四烯酸环氧合酶途径代谢产物之一,也是体内PPARγ的特异性内源性配基[5]。本研究旨在通过观察不同浓度15d-PGJ2干预对体外培养人肝癌HepG2细胞的增殖、DNA合成速率和凋亡的影响以及上述过程中细胞周期的变化,探究上述过程是否具有PPARγ依赖性及其详细机制,从而进一步探讨PPARγ作为肝细胞癌防治新靶点的可能性。
1 材料和方法
1.1 实验试剂
本研究所使用HepG2细胞株、GW9662和pSG5-PPARγ由北京军事医学科学院刘永学研究员提供;实验中针对PPARγ编码基因(NM 005037,GI:116284367)CDS区的shRNA(pGCsi-PPARγ)由上海吉凯基因化学技术有限公司设计、合成并筛选;15d-PGJ2购自Oncogene公司;RT-PCR试剂盒、DNA Marker DL2000购自TaKaRa公司;RPMI-1640培养液购自Hyclone公司;新生小牛血清、胰蛋白酶购自Gibco公司;TRIzol、LipofectamineTM2000购自Invitrogen公司;G418 Sulfate购自Amresco公司;3H-TdR购自北京原子高科技术应用股份有限公司;噻唑蓝购自Amersham Life Science公司;羊抗PPARγ多抗、羊抗actin多抗、ECL检测试剂盒购自Santa Cruz公司;核蛋白提取试剂盒购自碧云天公司;EMSA检测试剂盒购自Pierce公司;Annexin Ⅴ-FITC Kit、Coulter©DNA PrepTMReagents Kit以及IntraPrepTMPermeabilization Reagent购自Backman Coulter公司;FITC结合的激活的Caspase-3单克隆抗体购自BD公司;其他均为分析纯试剂。
1.2 实验仪器
高速冷冻离心机(Centrifuge 5417R)购自Eppendorf公司;PCR扩增仪、垂直电泳系统和电转系统购自Bio-Rad公司;Multiskan MK3酶标仪购自Labsystems Dragon公司;凝胶成像分析系统Gis-2009 system购自Tanon公司;DYY-Ⅲ2稳压稳流电泳仪购自北京六一仪器厂;DU©-640核酸蛋白分析仪、LS-6500液体闪烁计数仪以及EPICS-XL流式细胞仪购自Beckman Coulter公司。
1.3 实验方法
1.3.1 细胞培养及处理 HepG2细胞使用含10%小牛血清的RPMI-1640培养液于37℃、5% CO2环境下培养2~3 d,等到细胞60%~70%融合时,用PBS洗涤3次后更换无血清培养液培养24 h,最后加入15d-PGJ2至不同终浓度,再培养48 h后收集细胞。需要观察GW9662作用时,在加入15d-PGJ2前1 h加入GW9662。
1.3.2 细胞转染 收集对数生长期的HepG2细胞,加入0.2%的胰蛋白酶用于消化,再以1×108/L密度接种于24孔板,待细胞融合至90%时,使用LipofectamineTM2000进行细胞转染,并于48 h后收集细胞,该过程均严格按照说明书操作。
1.3.3 噻唑蓝(MTT)比色实验 前处理操作同1.3.1,在培养结束前4 h,每孔加入5 g/L MTT溶液20 μL,待4 h后吸弃上清液,加入二甲基亚砜,并保证终浓度在150 mL/孔,轻振荡10 min,用酶标仪测定492 nm处的吸光度值。
1.3.43H-胸腺嘧啶(3H-TdR)掺入实验 前处理操作同1.3.1,在加入15d-PGJ2的30 min后,每孔加入18.5 kBq3H-TdR,继续培养48 h,PBS洗涤,再加入10%三氯醋酸1 mL,于4℃放置60 min后收集沉淀物,使用95%乙醇洗涤,然后用0.15 mol/L NaOH 20 μL重悬,收集细胞到玻璃纤维滤膜上。烘干滤膜后放入闪烁瓶中,并加入闪烁液3 mL,使用LS-6500液体闪烁计数仪进行检测。
1.3.5 细胞凋亡检测 收集对照细胞及经实验处理的细胞,使用PBS洗涤,用1×结合缓冲液调整细胞密度至1×108/L。于30 min内完成流式细胞仪检测并记录,全部过程严格按照AnnexinⅤ-FITC Kit说明书进行操作。
1.3.6 PPARγ mRNA检测 采用TRIzol试剂提取总RNA,于核酸分析仪检测其纯度及浓度并记录,此过程严格按照TaKaRa RT-PCR试剂盒说明书操作。GAPDH引物序列:上游,5′-ACGGATTTGGTCGTATTGGG-3′;下游,5′-TGAT-TTTGGAGGGATCTCGC-3′,扩增片段为230 bp。PPARγ扩增引物序列:上游,5′-GCATTCTGGCCCACCAAC-3′;下游,5′-CTGAAACCGACAG-TACTG-3′,扩增片段为484 bp。PCR反应程序为:95℃预变性5 min;95℃ 45 s、48℃ 1 min、72℃1 min,反应循环28个;72℃延伸8 min。扩增结束后取扩增产物进行2%琼脂糖凝胶电泳,使用凝胶成像系统分析吸光度值,以待测基因与相应内参基因吸光度比值作为mRNA相对表达量。
1.3.7 Western blot检测 收集对照细胞及处理后的细胞,加入50 μL预冷裂解液后提取细胞内蛋白,采用Bradford法进行蛋白定量并记录结果。采用5%SDS-聚丙烯酰胺凝胶进行电泳,后转PVDF膜,封闭4 h,将膜转入含一抗(1∶100稀释羊抗PPARγ抗体)的TTBS液体中,孵育时间2 h;洗膜3次,后将膜转入含马抗羊二抗(辣根过氧化物酶标记,1∶2 000稀释)的TTBS液体中,孵育时间40 min;洗膜3次,ECL显色,使用凝胶成像分析系统进行结果分析。以目的条帯与内参条帯的吸光度比值作为蛋白的相对表达量。
1.3.8 细胞周期检测 收集对照细胞及处理后的细胞,使用PBS洗涤2次,调整细胞密度至1×108/L。此过程严格按照Coulter©DNA PrepTMReagents Kit说明书操作,2 h内上流式细胞仪检测。
1.3.9 凝胶迁移电泳(electrophoretic mobility sh-ift assay,EMSA) 收集对照细胞及处理后的细胞,提取核蛋白,此过程严格按照核蛋白提取试剂盒说明书操作。蛋白与探针反应体系如下:10×bindingbuffer 2 μL、50%glycerol 1 μL、1 μg/μL poly(dI∶
dC)1 μL、1% NP-40 1 μL、100 mmol/L MgCl21 μL、1 mol/L KCL 1 μL、200 mmol/L EDTA 1 μL、Biotin-DNA 0.2 μmol/μL 2 μL、Protein提取物10 μL,总体系为20 μL。于120 V预电泳,时间1 h,后将5 μL上样缓冲液加入样品混合液中,于180 V电泳30~45 min,后将尼龙膜放入0.5×TBE中平衡10 min,待电泳完成后于380 mA进行电转移30 min。转膜过程完成后于紫外灯下作用20 min后,用封闭液作用20 min。将预先稀释的抗体与膜作用30 min,使用1×洗脱液洗涤3次,后用平衡液作用5 min,最后进行ECL发光检测。
1.4 统计学方法
2 结果
2.1 15d-PGJ2对细胞增殖的影响
如表1所示,MTT比色结果显示,15d-PGJ2对HepG2细胞增殖有明显抑制作用,并且随着15d-PGJ2浓度的增高,其抑制作用逐渐增强,呈一定的剂量依赖关系。
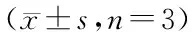
表1 15d-PGJ2对细胞增殖、3H-TdR掺入和凋亡的影响Table 1 Effects of 15d-PGJ2 on cell growth,3H-TdR uptake and cell apoptosis(±s,n=3)
与对照(con)组比较,**P<0.01;与20 μmol/L组比较,#P<0.05。
2.2 15d-PGJ2对细胞DNA合成速率的影响
如表1所示,3H-TdR的掺入实验表明,15d-PGJ2对HepG2细胞3H-TdR掺入有显著抑制作用,随着15d-PGJ2浓度的增高,其抑制作用逐渐增强,也呈一定的剂量依赖关系。由于15d-PGJ2具有抑制HepG2细胞的增殖效应,推测其抑制HepG2细胞3H-TdR的掺入主要是通过抑制细胞数量得以实现。
2.3 15d-PGJ2对细胞凋亡的影响
如图1和表1所示,Annexin Ⅴ-FITC流式细胞术结果显示,15d-PGJ2能够诱导HepG2细胞凋亡,并且随着15d-PGJ2浓度的增高,其诱导作用逐渐增强,呈一定的剂量依赖关系。
2.4 15d-PGJ2对PPARγ mRNA和蛋白表达的影响
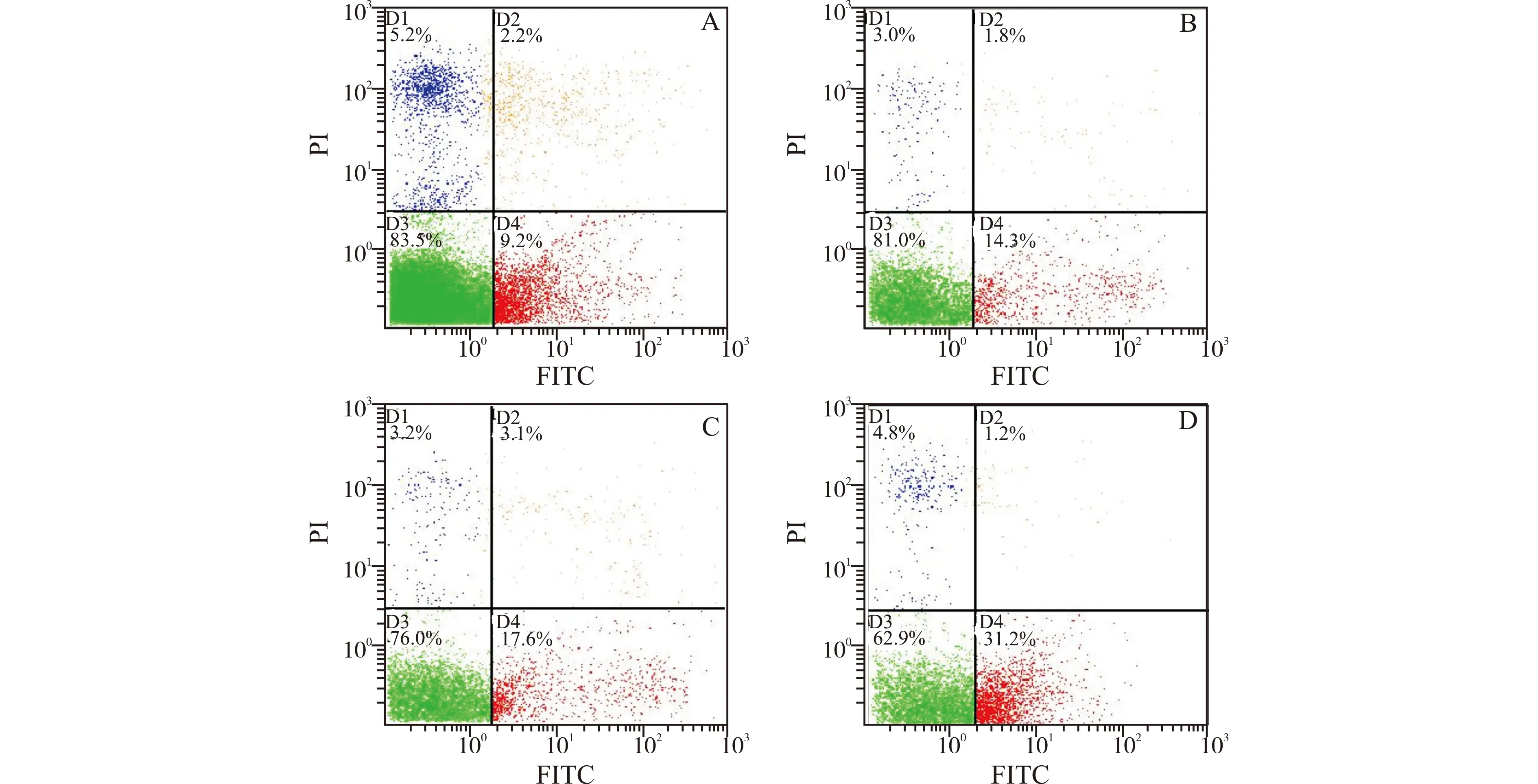
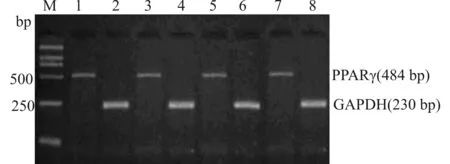
如图2、3所示,RT-PCR和Western blot分析表明,不同浓度的15d-PGJ2处理对HepG2细胞PPARγ mRNA和蛋白表达没有明显影响(表2)。
2.5 15d-PGJ2对细胞周期的影响
如表2和图4所示,流式细胞术结果表明,15d-PGJ2作用HepG2细胞48 h后可干扰细胞周期。与对照组相比,15d-PGJ2可导致G0/G1期细胞增加,S期细胞减少,且呈一定的剂量依赖性,G2/M期细胞则无明显变化。
A:对照组(con);B:10 μmol/L 15d-PGJ2处理组;C:20 μmol/L 15d-PGJ2处理组;D:50 μmol/L 15d-PGJ2处理组图1 15d-PGJ2对HepG2细胞凋亡的影响Fig.1 Effect of 15d-PGJ2 on the apoptosis of HepG2 cells
M:Marker;1,2:对照组(con);3,4:10 μmol/L 15d-PGJ2处理组;5,6:20 μmol/L 15d-PGJ2处理组;7,8:50 μmol/L 15d-PGJ2处理组图2 15d-PGJ2对HepG2细胞PPARγ mRNA表达的影响Fig.2 Effect of 15d-PGJ2 on the expression of PPARγ mRNA in HepG2 cells
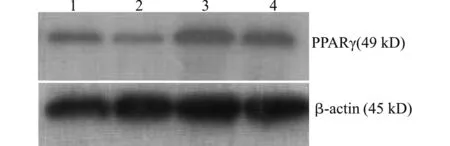
1:对照组(con);2:10 μmol/L 15d-PGJ2处理组;3:20 μmol/L 15d-PGJ2处理组;4:50 μmol/L 15d-PGJ2处理组图3 15d-PGJ2对HepG2细胞PPARγ蛋白表达的影响Fig.3 Effect of 15d-PGJ2 on the expression of PPARγ protein in HepG2 cells
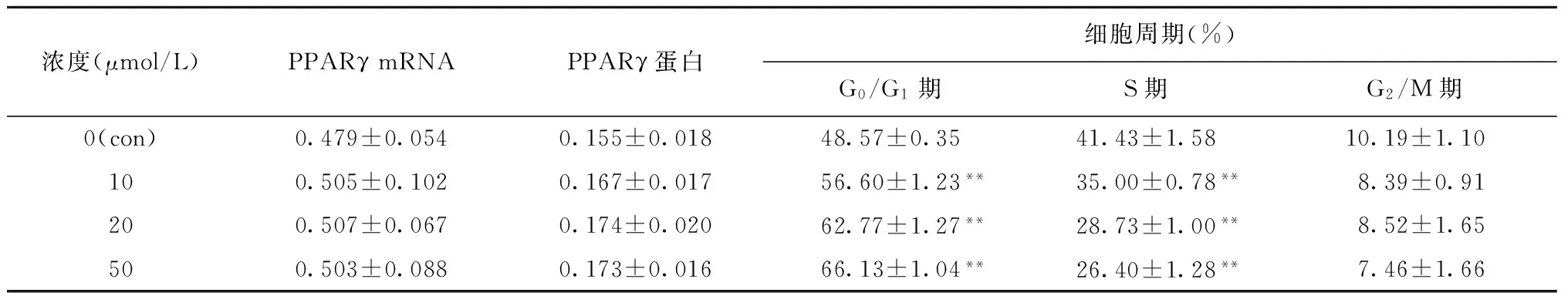
浓度(μmol/L)PPARγmRNAPPARγ蛋白细胞周期(%)G0/G1期S期G2/M期0(con)0.479±0.0540.155±0.01848.57±0.3541.43±1.5810.19±1.10100.505±0.1020.167±0.01756.60±1.23**35.00±0.78**8.39±0.91200.507±0.0670.174±0.02062.77±1.27**28.73±1.00**8.52±1.65500.503±0.0880.173±0.01666.13±1.04**26.40±1.28**7.46±1.66
与con组比较,**P<0.01
2.6 PPARγ依赖途径参与15d-PGJ2对HepG2细胞增殖的抑制作用
根据前述实验结果,选择20 μmol/L为15d-PGJ2抑制HepG2细胞增殖的有效浓度,观察PPARγ拮抗剂GW9662对15d-PGJ2作用的影响。如图5所示,GW9662在30 μmol/L时明显拮抗了15d-PGJ2对HepG2细胞增殖的抑制作用,但拮抗作用并不完全,15d-PGJ2+GW9662组对HepG2细胞仍表现出一定的增殖抑制作用。而pSG5-PPARγ表达质粒(PPARγ过表达)转染后,可以逆转GW9662的上述作用。单独GW9662或pSG5-PPARγ表达质粒瞬时转染对HepG2细胞的增殖无明显影响。这些结果初步表明,15d-PGJ2抑制HepG2细胞增殖的作用部分经由PPARγ依赖途径,但因GW9662并未完全拮抗15d-PGJ2的作用,提示可能同时存在PPARγ非依赖途径。
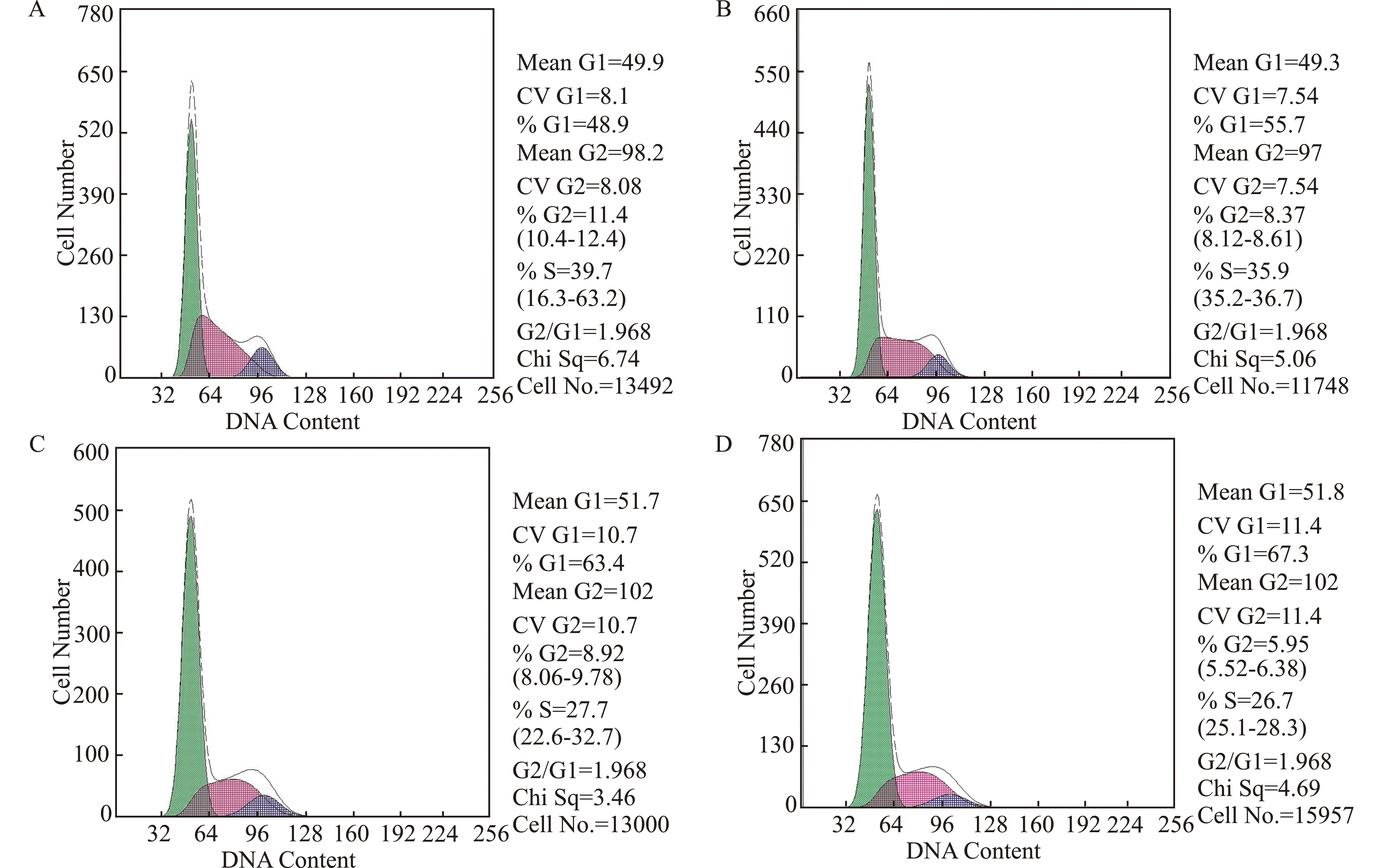
A:对照组(con);B:10 μmol/L 15d-PGJ2处理组;C:20 μmol/L 15d-PGJ2处理组;D:50 μmol/L 15d-PGJ2处理组图4 15d-PGJ2对HepG2细胞周期的影响Fig.4 Effect of 15d-PGJ2 on the cell cycle of HepG2
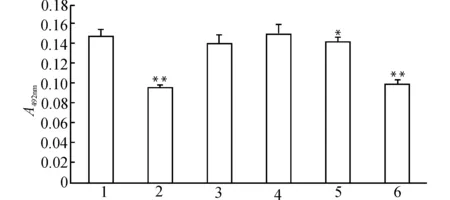
1:con;2:15d-PGJ2;3:GW9662;4:PSG5-PPARγ;5:15d-PGJ2+GW9662;6:15d-PGJ2+GW9662+PSG5-PPARγ;与con组比较,*P<0.05 **P<0.01图5 PPARγ依赖途径参与15d-PGJ2对HepG2细胞的增殖抑制作用Fig.5 Involvement of PPARγ-dependent pathway in the 15d-PGJ2-induced inhibition of HepG2 cell growth
2.7 PPARγ非依赖途径参与15d-PGJ2对HepG2细胞的增殖抑制作用
为证实PPARγ非依赖途径的存在,本研究将PPARγ小干扰RNA(pGCsi-PPARγ)转染HepG2细胞,将PPARγ沉默后观察15d-PGJ2(20 μmol/L)对HepG2细胞增殖的作用。结果表明,相同浓度的15d-PGJ2处理对pGCsi-PPARγ转染组的增殖抑制作用较非转染组明显减弱(P<0.01),但与对照组(con)相比,细胞增殖仍然受到一定程度的抑制。而单独con siRNA或pGCsi-PPARγ转染对HepG2的细胞增殖无影响(图6)。此结果进一步证实,15d-PGJ2体外对HepG2细胞的增殖抑制作用不依赖PPARγ的表达,存在PPARγ非依赖途径。
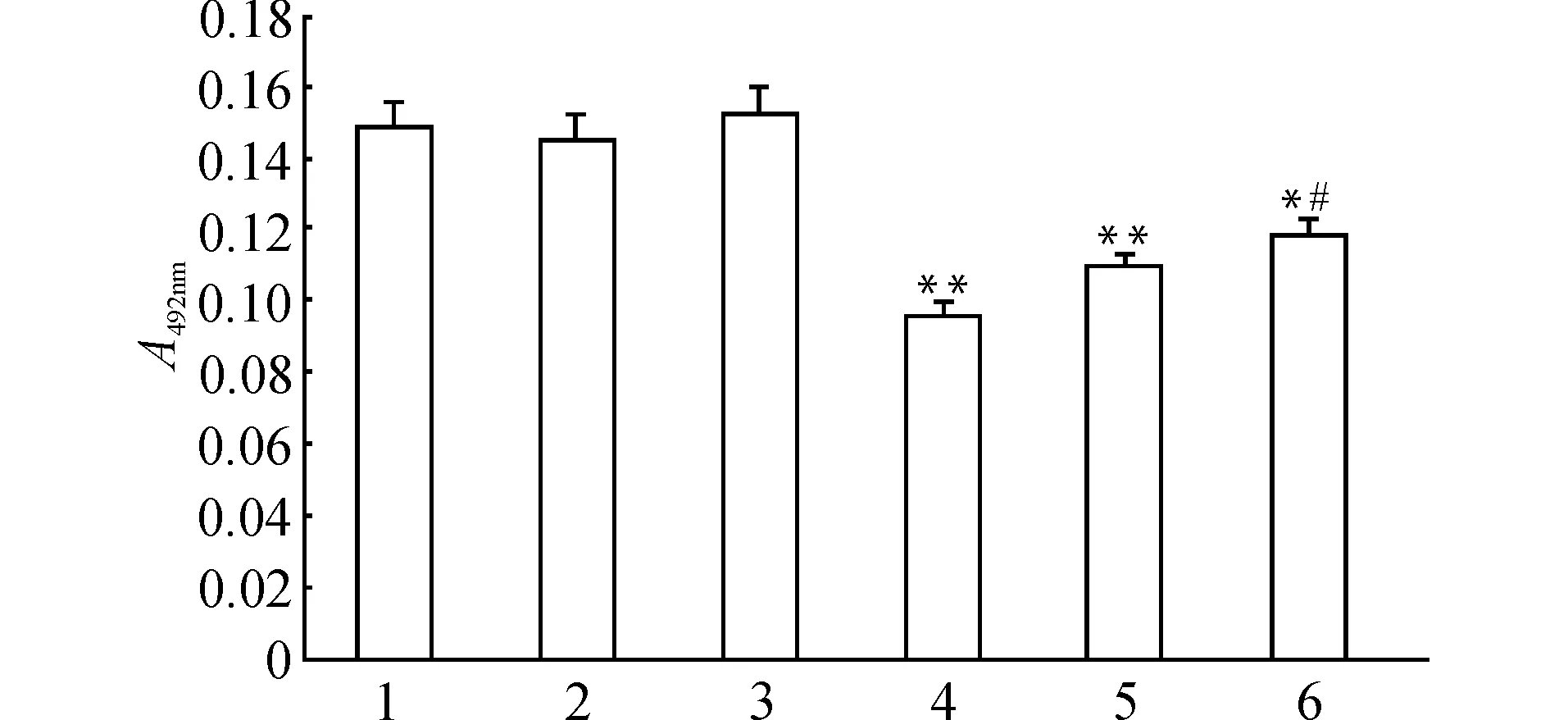
1:con;2:con siRNA;3:pGCsi-PPARγ;4:15d-PGJ2;5:con siRNA+15d-PGJ2;6:pGCsi-PPARγ+15d-PGJ2;与con组比较,*P<0.05 **P<0.01;与15d-PGJ2组比较,#P<0.05 图6 PPARγ非依赖途径参与15d-PGJ2对HepG2细胞的增殖抑制作用Fig.6 Involvement of PPARγ-independent pathway in the 15d-PGJ2-induced inhibition of HepG2 cell growth
2.8 15d-PGJ2对NF-κB DNA结合活性的影响
如图7,凝胶迁移电泳实验表明,15d-PGJ2在高浓度(50 μmol/L)时明显抑制了核因子NF-κB的DNA结合活性,表明NF-κB信号转导途径参与了15d-PGJ2对HepG2细胞的增殖抑制和凋亡诱导作用。
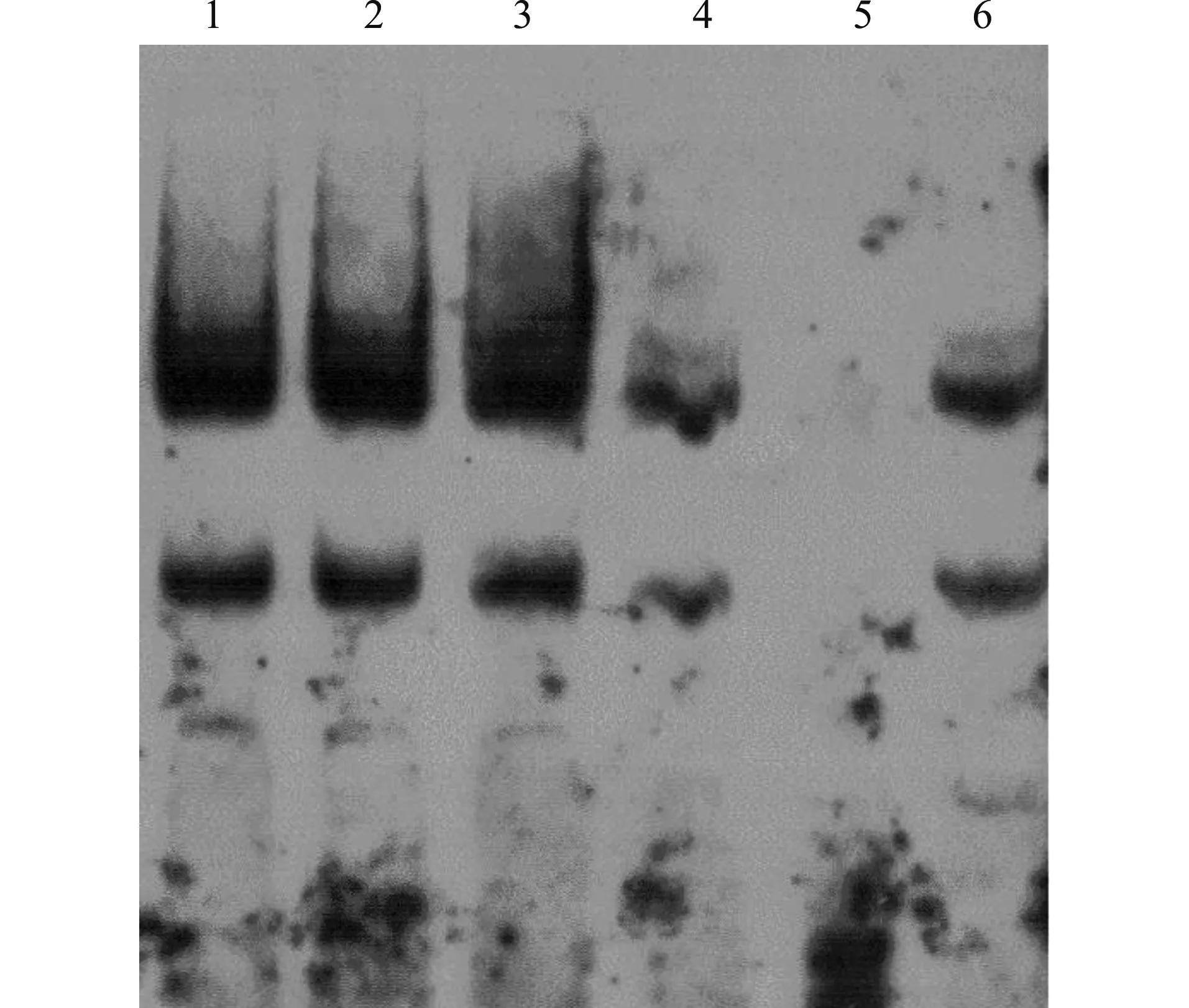
1:对照组(con);2:10 μmol/L 15d-PGJ2处理组;3:20 μmol/L 15d-PGJ2处理组;4:50 μmol/L 15d-PGJ2处理组;5:Cold competitor;6:阳性对照图7 15d-PGJ2对NF-κB DNA结合活性的影响Fig.7 Effect of 15d-PGJ2 on NF-κB DNA binding activity
3 讨论
PPARγ与其配基结合后被激活,并与9-顺式维甲酸类受体(retinoid X receptor,RXR)结合形成异源二聚体,继而二者于靶基因的启动子上的特定序列——过氧化物酶体增殖物反应元件(peroxisome proliferators response element,PPRE)发生特异性结合,启动靶基因的转录[6]。这是核激素受体的传统作用方式。近年来,也有研究表明PPARγ还可以通过非依赖途径发挥其生物学效应[7-8]。同时,有关PPARγ在肝细胞癌中的作用尚存在争议。目前多数的研究表明,PPARγ配基对多种肿瘤细胞均能够表现出增殖抑制、诱导凋亡的作用,提出PPARγ的激活具有抑瘤作用[9]。然而,亦有研究表明PPARγ的激活能够促进肝细胞生长因子的产生,而后者加速了肿瘤的生长[10]。因此,有关PPARγ在肝细胞癌中的作用机制以及是否经由PPARγ途径尚需进一步研究来证实。
本研究表明,作为体内PPARγ的特异性内源性配基,15d-PGJ2能够明显抑制体外培养的HepG2细胞增殖、降低DNA合成速率并诱导细胞的凋亡,表明在人肝癌细胞中PPARγ被激活,跟已证实的PPARγ在其他多种瘤细胞增殖过程中一样,具有抑瘤作用。本研究结果与目前大多数结果一致[3-4]。近来,Koga等[11-12]发现在人肝癌细胞系中曲格列酮可以通过下调Skp2的表达,导致P27 Kip1蛋白在细胞内堆积,从而通过癌细胞周期停滞来发挥抑制癌细胞生长的作用。本研究亦证实,在上述抑瘤作用过程中,15d-PGJ2能够引起G0/G1期细胞大量增加,S期细胞减少,而G2/M期细胞无明显变化,表明此过程是由通过干扰细胞周期来发挥的。
同时,本研究也发现在15d-PGJ2发挥上述作用过程中,HepG2细胞PPARγ mRNA和蛋白表达无明显变化,推测其过程可能涉及PPARγ非依赖途径。为进一步探讨PPARγ通过何种途径来完成上述作用,本研究利用GW9662、pSG5-PPARγ以及pGCsi-PPARγ进行了相关研究。研究结果表明,GW9662可以部分拮抗15d-PGJ2对HepG2细胞的增殖抑制作用,然而在进行了转染pSG5-PPARγ表达质粒的HepG2细胞中,15d-PGJ2又重新恢复了上述效应,因而推测15d-PGJ2上述对HepG2细胞的增殖抑制作用部分是通过PPARγ依赖途径。同时研究结果也显示GW9662并不能完全拮抗15d-PGJ2的作用,提示在此过程中还存在PPARγ非依赖途径的可能性。Clay等[13]的研究亦证实,在乳腺癌细胞中,15d-PGJ2激活了由PPRE介导的多种基因的转录活性,但对凋亡诱导作用来说PPARγ不是必须的,Caspase抑制剂可以阻断15d-PGJ2诱导的细胞凋亡。这一研究也证实了PPARγ非依赖途径的存在。为证实本研究中PPARγ非依赖途径的存在,我们使用pGCsi-PPARγ转染HepG2细胞发现,高浓度的15d-PGJ2对PPARγ沉默的HepG2细胞仍旧表现出增殖抑制作用,证实了前述推测的PPARγ非依赖途径的存在。
此外,在肿瘤形成过程中,PPARγ非依赖途径涉及多种因素,如核因子-κB(nuclear factor-κB,NF-κB)、Caspase-3、激活蛋白-1(activating protein-1,AP-1)、信号转导子以及转录激活子(signal transducer and activator of transcription,STAT)等等[14]。已有证据表明NF-κB在多种慢性肝病(如胆汁淤积、自身免疫性肝病以及乙、丙型病毒性肝炎)中被激活,并且与HCC表现出密切相关性。进一步的研究表明,NF-κB的激活能够诱导参与调节程序性细胞死亡和抑制凋亡的特异性基因的表达[15]。而NF-κB的转录活性高低则取决于DNA结合活性、NF-ΚB二聚体的构成以及其磷酸化状态。在本次研究中我们发现,在HepG2细胞增殖过程中高浓度的15d-PGJ2明显抑制了NF-ΚB的DNA结合活性,推测NF-κB信号转导途径参与了15d-PGJ2对HepG2细胞的增殖抑制和凋亡诱导作用过程,在其抑瘤效应中发挥着重要作用。因其只有在高浓度时发挥上述效应,推测这个过程是通过PPARγ非依赖途径影响NF-κB实现其调节基因转录的作用。
从目前相关研究来看,同种PPARγ配基对不同的癌细胞作用是不一致的,而不同的PPARγ配基对相同的癌细胞作用也不尽相同,其中可能涉及到不同PPARγ配基本身具有的复杂生理、药理学机制。本研究表明,15d-PGJ2能够抑制人肝癌HepG2细胞的增殖并诱导其凋亡,表明了对于人肝癌细胞PPARγ的激活具有抑瘤作用,且这种作用不仅仅涉及PPARγ依赖途径,还涉及PPARγ非依赖途径。因此,PPARγ的激活能否在体内发挥相同的作用尚需进一步的体内研究予以证实。
[1] Bosch F X,Ribes J,Cléries R,et al.Epidemiology of hepatocellular carcinoma[J].Clin Liver Dis,2005,9(2):191-211.
[2] Han X,Chen C,Cheng G,et al.Peroxisome proliferator-activated receptor γ attenuates serotonin-induced pulmonary artery smooth muscle cell proliferation and apoptosis inhibition involving ERK1/2 pathway[J].Microvasc Res,2015,100:17-24.
[3] Shen B,Chu E S,Zhao G,et al.PPARgamma inhibits hepatocellular carcinoma metastasesinvitroand in mice[J].Br J Cancer,2012,106(9):1486-1494.
[4] Shim J,Kim B H,Kim Y I,et al.The peroxisome proliferator-activated receptor gamma ligands,pioglitazone and 15-deoxy-Delta(12,14)-prostaglandin J(2),have antineoplastic effects against hepatitis B virus-associated hepatocellular carcinoma cells[J].Int J Oncol,2010,36(1):223-231.
[5] Forman B M,Tontonoz P,Chen J,et al.15-deoxy-Δ12,14-prostaglandin J2is a ligand for the adipocyte determination factor PPAR gamma[J].Cell,1995,83(5):803-812.
[6] Issemann I,Green S.Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators[J].Nature,1990,347(6294):645-650.
[7] Bolden A,Bernard L,Jones D,et al.The PPAR Gamma agonist troglitazone regulates Erk 1/2 phosphorylation via a PPARγ-independent,MEK-dependent pathway in human prostate cancer cells[J].PPAR Res,2012(5):929052.
[8] Lützen U,Zhao Y,Lucht K,et al.Pioglitazone induces cell growth arrest and activates mitochondrial apoptosis in human uterine leiomyosarcoma cells by a peroxisome proliferator-activated receptor γ-independent mechanism[J].Naunyn Schmiedebergs Arch Pharmacol,2017,390(1):37-48.
[9] Yu J,Shen B,Chu E S,et al.Inhibitory role of peroxisome proliferator-activated receptor gamma in hepatocarcinogenesis in mice andinvitro[J].Hepatology,2010,51(6):2008-2019.
[10] Jiang J G,Johnson C,Zarnegar R.Peroxisome proliferator-activated receptor γ-mediated transcriptional up-regulation of the hepatocyte growth factor gene promoter via a novel composite cis-acting element[J].J Biol Chem,2001,276(27):25049-25056.
[11] Koga H,Harada M,Ohtsubo M,et al.Troglitazone induces p27 Kip1-associated cell-cycle arrest through down-regulating Skp2 in human hepatoma cells[J].Hepatology,2003,37(5):1086-1096.
[12] Koga H,Sakisaka S,Harada M,et al.Involvement of p21(WAF1/Cip1),p27(Kip1),and p18(INK4c)in troglitazone-induced cell-cycle arrest in human hepatoma cell lines[J].Hepatology,2001,33(5):1087-1097.
[13] Clay C E,Monjazeb A,Thorburn J,et al.15-Deoxy-delta12,14-prostaglandin J2-induced apoptosis does not require PPAR-gamma in breast cancer cells[J].J Lipid Res,2002,43(11):1818-1828.
[14] Barkett M,Gilmore T.Control of apoptosis by Rel/NF-κB transcription factors[J].Oncogene,1999,18(49):6910-6924.
[15] Schmid R M,Adler G.NF-κB/Rel/IκB:Implication in gastrointestinal diseases[J].Gastroenterology,2000,118(6):1208-1228.
Effectsof15-Deoxy-Δ12,14-prostaglandinJ2ontheProliferationandApoptosisofHumanHepG2Cells
Wu Zhiqiang,Xiong Yan,Liu Ting et al
DepartmentofClinicalLaboratory,WuhanMedicalTreatmentCenter,Wuhan430023,China
ObjectiveTo investigate the effects of 15-deoxy-Δ12,14-prostaglandin J2(15d-PGJ2)on the proliferation and apoptosis of human HepG2 cells and explore the possible mechanisms.MethodsEffects of 15d-PGJ2on the growth and DNA synthetic rate of human HepG2 cells were measured by MTT assay and3H-TdR uptake,respectively.Cell apoptosis and cell cycle were detected by flow cytometry(FCM).The expression of PPARγ mRNA and protein was measured by reverse transcription-polymerase chain reaction(RT-PCR)and Western blotting,respectively.The role of PPARγ in 15d-PGJ2-induced inhibition of HepG2 cells was examined by use of GW9662,a PPARγ antagonist and/or the eukaryotic expression plasmid pSG5-PPARγ.The effect of 15d-PGJ2on the proliferation of HepG2 was also examined after silence of PPARγ with pGCsi-PPARγ.Additionally,NF-κB DNA binding activity was detected by electrophoretic mobility shift assay.Results15d-PGJ2inhibited cell proliferation,decreased DNA synthetic rate and induced cell apoptosis in a dose-dependent manner.Cell cycle analysis revealed a decreased proportion of cells in S phase,with arrest at G0/G1in this process.But the expression levels of PPARγ mRNA and protein were not significantly changed.GW9662 patially reversed the cell grow inhibition effect of 15d-PGJ2.Transfection with pSG5-PPARγ could suppress the effect of 15d-PGJ2on cell growth in the presence of GW9662.15d-PGJ2at 20 μmol/L was found to inhibit the proliferation of HepG2 cells transfected with pGCsi-PPARγ.Furthermore,15d-PGJ2at 50 μmol/L inhibited the DNA binding activity of NF-κB.Conclusion15d-PGJ2inhibits cell growth,induces cell apoptosis and interferes with cell cycle in HepG2 cells through PPARγ-dependent and-independent pathways.The PPARγ-independent pathway is related to the activity of NF-κB signal.
hepatocellular carcinoma; peroxisome proliferator-activated receptor γ; 15d-PGJ2; cell proliferation; apoptosis; cell cycle; nuclear factor-κB
*武汉市青年晨光计划资助项目(No.20065004116-49)
吴志强,男,1964年生,副主任技师,E-mail:2903624519@qq.com
△通讯作者,Corresponding author,E-mail:mintyrain@126.com
R730.3
10.3870/j.issn.1672-0741.2017.05.005
(2017-05-06 收稿)

