Castleman病继发霍奇金淋巴瘤临床病理分析并文献复习
寿 娟, 龙艳丽, 粟 凤, 张著学
贵州省人民医院病理科,贵阳 550002
Castleman病继发霍奇金淋巴瘤临床病理分析并文献复习
寿 娟, 龙艳丽, 粟 凤, 张著学△
贵州省人民医院病理科,贵阳 550002
Castleman病; 霍奇金淋巴瘤
Castleman病(Castleman disease,CD)又名血管滤泡性淋巴组织增生症或巨大淋巴结增生症,临床表现及预后具有高度异质性。目前认为该病是一种良性的系统性淋巴组织增生紊乱,其发病机制目前还处于探索阶段。本文报道的是1例多中心性浆细胞型CD继发霍奇金淋巴瘤(Hodgkin’s lymphoma,HL)的病例并对相关文献进行复习。
1 病例资料
患者男,41岁,2016年7月因“头晕、乏力、心悸10+d”入院。体检:贫血貌,肝脾触诊不满意,右侧颈部可扪及4 cm×5 cm包块,双侧颈部、腋窝、腹股沟均可扪及黄豆-蚕豆大小淋巴结。辅助检查:血常规:WPC 10.97×109/L(↑),RBC 1.28×1012/L(↓),HGB 45 g/L(↓),血小板396×109/L(↑);血液G6PD正常;抗人球蛋白C3阳性;简易溶血试验阴性;α1球蛋白5.1%(↑),γ球蛋白46.7%(↑),白蛋白26.9%(↓),免疫固定电泳未见异常单克隆条带;IL-6 9.17 pg/mL(↑);肝、肾功能正常;血HIV、HHV-8及EBV-DNA阴性。取右颈部淋巴结活检,病理镜下形态(图1A~1C):淋巴结正常结构大部分被破坏,淋巴结淋巴窦消失,增生的滤泡散布整个淋巴结,滤泡大小不一,滤泡中可见玻璃样血管改变,外周小淋巴细胞同心圆排列层次较少,滤泡间见成熟浆细胞成片状分布。免疫组化标记结果显示:浆细胞CD38、MUM-1、CD138阳性;HHV-8阴性;Ki-67(生发中心约80%+,生发中心外约10%+)。诊断为Castleman病,浆细胞型(plasma cell type,PC型)。骨髓涂片检查:红系比例升高,浆细胞比例正常偏高,见个别双核浆细胞;骨髓流式免疫分析未见异常;骨髓穿刺活检:骨髓增生活跃,骨髓细胞间见少量片状分布的浆细胞,但无明显异型性。临床诊断为Castleman病(多中心性,浆细胞型),给予COP样方案化疗,完成初期化疗后出院。
2个月后患者再次入院化疗,体检双侧颈部、腋窝、腹股沟均可扪及黄豆至蚕豆大小淋巴结,部分融合。辅助检查:血常规:WPC 20.23×109/L(↑),RBC 1.54×1012/L(↓),HGB 56 g/L(↓),血小板554×109/L(↑);C反应蛋白87.72 mg/L(↑);IL-6 19.7 pg/mL(↑);类风湿因子、HHV-8及HIV阴性;B超示肝、脾、双肾大。取右侧颈部淋巴结活检,镜下形态(图1D):在PC型CD形态学背景中可见散在大细胞(正常组织细胞2倍以上大小),单核或者多核,胞质丰富,嗜伊红,核仁大,为R-S(Reed-Sternberg)细胞。免疫组化标记结果(图1E、1F):R-S细胞,CD30、CD15阳性;浆细胞,CD138阳性、Kappa约30%阳性、Lambda阴性;HHV-8阴性;Ki-67约80%阳性。原位杂交:EBER阴性。诊断为淋巴结Castleman病(浆细胞型),继发经典型霍奇金淋巴瘤。患者拒绝骨穿,骨髓累及情况不详。临床给予mine方案化疗,至截稿已化疗5个疗程,患者淋巴结明显缩小,血常规检查好转。
2 讨论
2.1 诊断
2.1.1 CD的诊断 Castleman病常无特征性的临床症状和体征,主要累及淋巴结,偶可波及结外组织,根据组织学特征可分为透明血管型(hyaline-vascular type,HV)、浆细胞型(plasma cell type,PC)及混合型(HV-PC)。HV型光镜下主要表现为淋巴滤泡增生,生发中心萎缩,滤泡树突细胞增多,外套层增宽,围绕生发中心形成特有的“洋葱皮样”结构,淋巴结内透明血管滤泡结构明显。PC型的特点是生发中心明显而血管增生不明显,滤泡间质中大量成熟的浆细胞浸润。混合型是兼具HV型及PC型的形态学改变。CD中的淋巴细胞通常为多克隆起源,这也与淋巴瘤的肿瘤性单克隆起源等恶性疾病不同[1],应用免疫组化及基因重排检查,同时免疫球蛋白检测有助于明确是否有克隆性增生及恶性转化[2]。
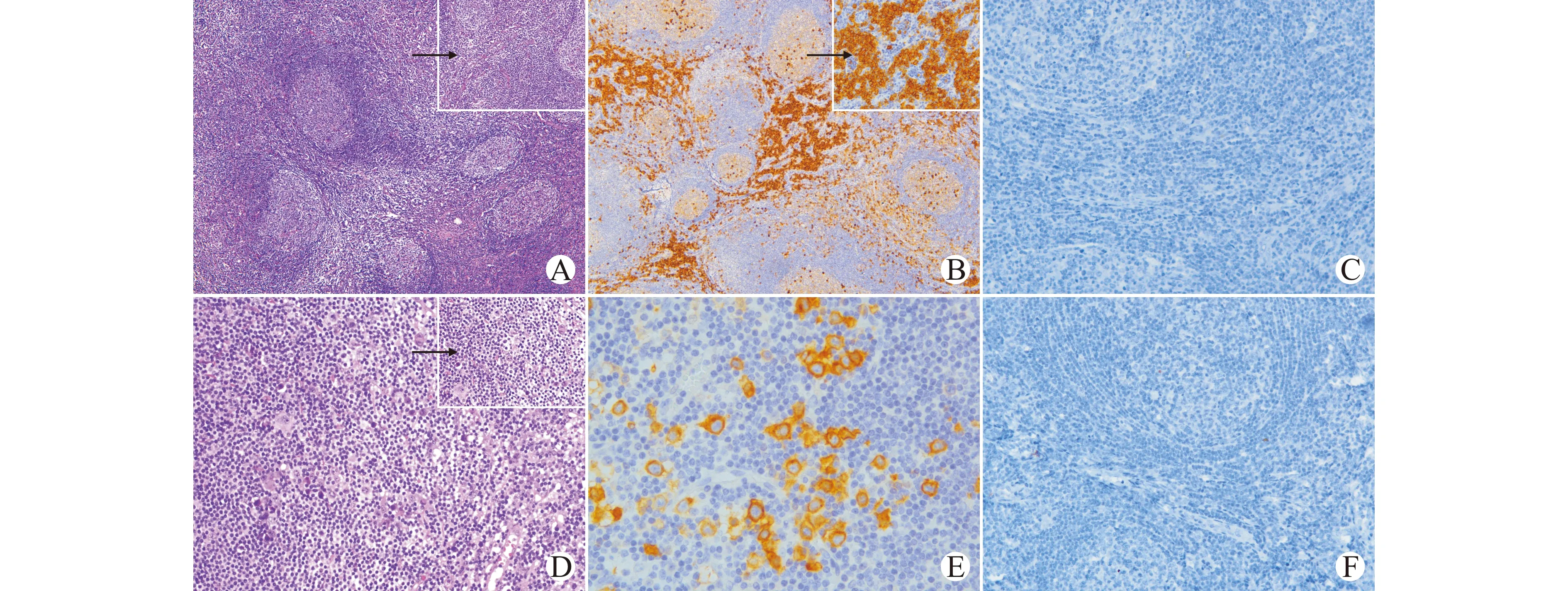
A~C:患者首次入院病检,A:局部淋巴结组织病理形态(HE染色,×40,局部放大×100),B:CD38标记的滤泡间成片状分布的成熟浆细胞(Envision法染色,×40,局部放大×200),C:HHV-8阴性(Envision法染色,×200倍);D~F:患者再次入院病检,D:局部淋巴结组织病理形态(HE染色,×200,局部放大×400),E:R-S细胞CD30阳性(Envision法染色,×400),F:HHV-8阴性(Envision法染色,×200)图1 患者颈部淋巴结病理活检Fig.1 Pathologic biopsy of Cervical lymph nodes in the patient
2.1.2 CD合并HL的诊断 CD继发HL的病例罕见。据本次文献复习并统计分析,在国内外报道的20例该病病例中,男性患者多于女性患者,平均年龄45岁,最大为76岁,最小18岁,发病时约有90%表现为浅表淋巴结肿大,45%合并纵膈肿大,25%合并肝脾肿大。CD的诊断通常先于或者同时与淋巴瘤的诊断[3],本次文献复习中仅1例为先发现淋巴瘤后发现CD。组织学诊断标准:首先需具有确切的HL组织学改变,必须是局部或者弥漫性见到诊断性R-S细胞或者其他变异性R-S细胞,CD30、CD15单项或者双项阳性。其次具有上述CD诊断的形态学依据。Dogget等[4]将这类HL称之为滤泡间区霍奇金淋巴瘤(Interfollicular HD)。Zanetto等[5]认为该类型淋巴瘤是一种独立的少见或者罕见的HL类型,它可能显示了一种早期的局部淋巴结损伤。
2.2 CD的病因及发病机制
目前研究证实CD发病与多种因素相关,包括病毒感染,细胞调节因子异常及血管增生等。①IL-6升高:目前认为高水平的IL-6是CD的主要致病机制之一,并引发患者一系列临床症状,血清中的急性时相蛋白与IL-6的水平具有相关性[6]。将CD患者肿大的淋巴结切除后,血清中IL-6随之降低,临床症状有所缓解[7]。②HHV-8感染:HHV-8又称为人卡波西肉瘤疱疹病毒。HHV-8与HIV感染患者发生多中心性CD(multicentric castleman disease,MCD)具有相关性[8],据报道大部分HIV阳性的MCD患者和40%~50%HIV阴性的MCD患者都合并HHV-8感染[9]。该病毒可编码人IL-6同源类似物[10],从而激活JAK-STAT通路,促进了疾病的发生发展。Dupin等[11]发现HHV-8有致淋巴瘤作用,与浆母细胞性MCD相关。③滤泡树突状细胞(follicular dendritic cell,FDC)增生:FDC作为抗原呈递细胞密切参与B细胞在生发中心的迁移、增生、分化和分泌。FDC的增生、发育障碍及瘤变可能与CD的发生相关,在一些研究中显示HV-CD的FCD细胞核型表达异常[12]。Kurzrock等[9]研究认为IL-6的升高导致了FDC细胞的异常从而促进了CD的发生,Nguyen等[13]研究证实存在于HV型CD中的FDC细胞与PC型CD中的不同,HV型CD中FDC细胞的异常导致了滤泡生发中心减少。因此,虽然CD中的FDC细胞并不具有异型性,但FDC增生异常可能是HV型CD发生的重要原因。④血管增生:在HV-CD中生发中心大量玻璃样变的毛细血管增生,因此有学者认为CD的发生可能与血管增生相关。血管内皮生长因子(VEGF)能促进血管内皮细胞的增殖,诱导新血管形成,从而刺激滤泡间区和生发中心血管增生参与CD的发病。Dogget等[4]报道1例伴有多发毛细血管瘤的MCD患者的血清VEGF含量明显升高,化疗后VEGF恢复到正常。Nishi等[14]发现淋巴结产生的IL-6可以诱导浆细胞旁分泌VEGF以及受累淋巴结淋巴滤泡间的血管增生。虽然研究表明VEGF与CD发生相关,但其是否存在因果关系并不明确。
2.3 CD继发HL的病因及发病机制
CD与HL相关性及发病机制目前研究尚少,据本次文献复习并统计分析,在国内外报道的20例该病病例中,CD类型15例为PC-MCD,2例HV-UCD,PC-HV-MCD及HV-MCD各1例,淋巴瘤类型13例为经典型霍奇金淋巴瘤,3例弥漫大B细胞性淋巴瘤,T细胞性恶性淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤、原发性渗出性淋巴瘤各1例;HIV阳性患者2例,HHV-8阳性患者3例,其中1例HIV合并HHV-8阳性;4例IL-6升高,3例EBV阳性。Maheswaran等[15]认为该类型的霍奇金淋巴瘤,是机体的一种以组织学形态呈PC型CD样改变为特征的非特异免疫应答,之所以出现PC型CD样改变,相关研究认为与患者体内的由B淋巴细胞等分泌的高水平IL-6相关,高水平的IL-6引起过量的浆细胞产生,导致PC型CD样改变[16]。据Momoi等[17]报道,1例被诊断为PC-MCD且IL-6升高的患者,经过IL-6的免疫抑制剂治疗后,再次淋巴结活检,组织学形态仅显示为HL的特征,PC型CD的形态却消失了,回顾性查看首次淋巴结活检,发现PC型CD的背景中散在CD30阳性的R-S细胞。该研究组认为是升高的IL-6导致了PC-CD样改变,当针对性用药使IL-6下降正常后,真正的病变就显现出来。当然这只是一种可能机制。Haque等[18]认为HHV-8阳性CD患者比起阴性CD患者有更高风险继发恶性肿瘤,如Kaposi’s肉瘤、非霍奇金淋巴瘤等,HHV-8能编码IL-6的同源类似物,因而导致CD样改变。另外部分MCD患者淋巴细胞可检测出克隆性重排,虽然这种病理学检查没有明显恶性特征,但随着时间的推移可能演变为B系淋巴瘤,提示MCD可能原本就不是单纯良性淋巴组织增生性疾病,而是交界性具有恶变潜能的疾病[19]。当然关于更多CD与HL相关性及发病机制还有待探索。CD的预后与多种因素相关,随着相关研究的进展,期待能够提高医务工作者对于该病的认识;同时为新的治疗方法提供依据。
[1] Menke D M,De Wald G W.Lack of cytogenetic abnormalities in Castleman’s disease[J].South Med J,2001,94(5):472-474.
[2]刘洁,徐玉乔,杨守京,等.Castleman 病的免疫表型和基因重排分析[J].临床与实验病理学杂志,2011,27(4):361-375.
[3]Larroche C,Cacoub P,Soulier J,et al.Castleman’s disease and lymphoma:report of eight cases in HIV negative patients and literature review[J].Am J Hematol,2002,69(2):119-126.
[4]Dogget R S,Colby T V,Dorfman R F,et al.Interfollicular Hodgkin’s disease[J].Am J Surg Pathol,1983,7(2):145-149.
[5]Zanetto U,Pagani F P,Perez C,et al.Interfollicular Hodgkin’s lymphoma and Castleman’s disease[J].Histopathology,2005,48(3):317-319.
[6]Polizzotto M N,Uldrick T S,Wang V,et al.Human and viral interleukin-6 and other cytokines in Kaposi sarcoma herpesvirus-associated multicentric Castleman disease[J].Blood,2013,122(26):4189-4198.
[7]Yoshizaki K,Matsuda T,Nishimoto N,et al.Pathogenic significance of interleukin-6(IL-6/BF-2) in Castleman’s disease[J].Blood,1989,74(4):1360-1370.
[8]Kikuta H,Itakura O,Taneichi K,et a1.Tropism of human herpesvirus 8 for peripheral blood lymphocytes in patients with Castleman’s disease[J].Br J Haematol,1997,99(4):790-793.
[9]El-Osta H E,Kurzrock R.Castleman’s disease:From basic mechanisms to molecular therapeutics[J].Oncologist,2011,16(4):497-511.
[10] Suthaus J,Stuhlmann-Laeisz C,Tompkins V S,et al.HHV-8-encoded viral IL-6 collaborates with mouse IL-6 in the development of multicentric Castleman disease in mice[J].Blood,2012,119(22):5173-5181.
[11] Dupin N,DissT L,Kellam P,et al.HHV-8 is associated with a plasmablastic variant of Castleman disease that is linked to HHV-8-positive plasmablastic lyphoma[J].Blood,2000,95(4):1406-1412.
[12] Kazakov D V,Fanburg-Smith J C,Suster S,et al.Castleman’s disease of the subcutis and underlying skeletal muscle.Report of 6 cases[J].Am J Surg Pathol,2004,28(5):569-577.
[13] Nguyen D T,Diamond L W,Hansmann M L,et al.Castleman’s disease.Differences in follicular dendritic network in the hyaline vascular and plasma cell variants[J].Histopathology,1994,24(5):437-443.
[14] Nishi J,Maruyama I.Increased expression of vascular endothelial growth factor(VEGF) in Castleman’s disease:proposed pathomechanism of vascular proliferation in the affectde lymph node[J].Leuk Lymphoma,2000,38(3/4):387-394.
[15] Maheswaran P R,Ramsay A D,Norton A J,et al.Hodgkin’s disease presenting with the histological features of Castleman’s disease[J].Histopathology,1991,18(3):249-253.
[16] Abdel-Reheim F A,Koss W,Rappaport E S,et al.Coexistence of Hodgkin’s disease and giant lymph node hyperplasia of the plasma cell type (Castleman’s disease)[J].Arch Pathol Lab Med,1996,120(1):91-96.
[17] Momoi A,Kojima M,Sakai T,et al.IL-6-positive classical Hodgkin’s lymphoma co-occurring with plasma cell type of Castleman’s disease:report of a case[J].Int J Hematol,2013,97(2):275-279.
[18] Haque S,van Kirk R.Three patients with both Hodgkin’s lymphoma and Castleman’s disease:Clinicopathologic correlations and lack of association with HHV-8[J].Indian J Med Paediatr Oncol,2009,30(2):76-80.
[19] Kim T J,Han J K,Kim Y H,et al.Castleman disease of the abdomen:imaging spectrum and clinicopathologic correlations[J].J Comput Assist Tomogr,2001,25(2):207-214.
寿 娟,女,1986年生,住院医师,医学硕士,E-mail:seniorjane@126.com
△通讯作者,Corresponding author,E-mail:zhangzhuxue11@163.com
R551.2
10.3870/j.issn.1672-0741.2017.05.024
(2017-04-24 收稿)

