心脏死亡供肝肝移植术后并发移植肝大范围坏死分析*
王少发, 陈知水, 张万广, 董汉华, 魏 来, 蒋继贫, 王怀宇,腾文浩, 程 琪, 胡朝华, 赵 琳, 张必翔, 陈孝平△
华中科技大学同济医学院附属同济医院 1器官移植研究所2教育部/卫生计生委器官移植重点实验室 3肝脏外科,武汉 430022 4中国人民解放军96763部队医院,南阳 473000 5湖北医药学院药护学院16级临床医学本科专业,十堰 442000
王少发,男,1977年生,医学博士,E-mail:wangshaofa_2000@163.com
心脏死亡供肝肝移植术后并发移植肝大范围坏死分析*
王少发1,2, 陈知水1,2, 张万广3, 董汉华3, 魏 来1, 蒋继贫1, 王怀宇3,腾文浩3, 程 琪3, 胡朝华4, 赵 琳5, 张必翔3, 陈孝平1,2△
华中科技大学同济医学院附属同济医院1器官移植研究所2教育部/卫生计生委器官移植重点实验室3肝脏外科,武汉 4300224中国人民解放军96763部队医院,南阳 4730005湖北医药学院药护学院16级临床医学本科专业,十堰 442000
目的探讨心脏死亡供肝肝移植术后的并发症和应对措施。方法回顾分析同济医院2013年12月至2015年11月期间的24例心脏死亡供肝肝移植病例资料,观察患者术后的恢复情况,并总结对术后并发症的治疗原则。结果术后谷草转氨酶和谷丙转氨酶峰值的均值分别为1 951 U/L和962 U/L。患者住院时间(22±5) d(10~35 d)。住院期间共发生常规术后并发症6例(25.0%),死亡1例(4.2%),无原发性无功能发生,但是术后1周的增强CT检查发现了一种新的并发症——移植肝大范围坏死,共4例(16.7%)。对肝坏死患者采取保证肝脏灌注、减轻炎症反应、避免药物肝毒性和预防肝坏死后感染的治疗原则,术后20~28 d复查CT示移植肝坏死灶已修复或消失。结论心脏死亡供肝损伤较严重时,容易发生移植肝大范围坏死。在正确诊断和积极治疗的基础上,移植肝坏死是可能完全修复的,由此可能部分降低原发性无功能的发生。
肝移植; 心脏死亡供体; 术后并发症; 肝坏死; 增强CT
心脏死亡捐献(donation after cardiac death,DCD)供肝的质量差于脑死亡供肝,并且由于存在不可控因素,其临床疗效具有一定的不可预测性,如原发性无功能的发生[1-3]。因而需要积累经验来提高临床治疗效果。本研究在24例心脏死亡捐献供肝移植中发现了4例移植肝大范围坏死,但通过治疗实现修复,特报道如下。
1 资料与方法
1.1 受体资料
收集2013年12月至2015年11月在同济医院器官移植研究所完成的24例DCD供肝肝移植手术患者资料,其中男17例,女7例。患者年龄22~65岁,平均年龄(44±6)岁。原发病包括肝癌11例、乙肝肝硬化7例、免疫性肝病5例、酒精性肝硬化1例。终末期肝病模型(model for end-stage liver disease,MELD)评分为8~27分,平均(15±3)分。患者均签署知情同意书,符合医学伦理学规定。
1.2 供体资料
24例心脏死亡供者的供肝均由同济医院器官获取组织获取。所有供者家属均签署知情同意书,符合医学伦理学规定。其中男17例,女7例;年龄10~66岁,平均年龄(49±8)岁。根据中国心脏死亡器官捐献分类标准,属于中国二类,即DCD供者14例;中国三类,即脑-心双死亡器官捐献供者10例。死亡原因包括严重脑外伤13例、脑血管意外8例,颅内肿瘤3例,热缺血时间5~24 min,平均(11±3) min,冷缺血时间5.0~13.0 h,平均(8.8±2.1) h。
1.3 手术和术后治疗
所有患者均为首次原位肝移植,术中依次吻合腔静脉、门静脉,开放血流后吻合肝动脉。最后行胆管端端吻合。术中无肝期45~90 min,平均(60±12) min,手术时间5.5~11.0 h,平均(6.7±2.1) h。
术后使用三联免疫抑制剂(激素+FK506+骁悉),2周内停用激素,早期控制FK506浓度在6~10 ng/mL。同时予以头孢哌酮或头孢吡肟预防细菌感染,根据腹腔引流管颜色尽早抗凝治疗(舒洛地特或低分子肝素钠)。必要时使用大扶康或更昔洛韦治疗真菌或病毒感染。
1.4 观察指标
常规定期进行血常规、凝血功能、肝功能、血药浓度、肝脏超声等检查,术后约1周行肝脏CT平扫加增强血管成像,必要时行磁共振胆道成像、肝动脉造影或内镜下逆行性胰胆管造影术。怀疑排斥反应则在必要时行肝穿刺活检。
2 结果
2.1 术后并发症及处理
共发生常规术后并发症6例(25.0%),其中死亡1例(4.2%)。死亡病例的死亡原因为肺部感染导致多器官功能衰竭。肝动脉狭窄并胆道吻合口狭窄1例行肝动脉支架植入和胆道支架置入;心功能衰竭并肺部感染1例行药物治疗;胸腔积液1例行胸腔穿刺;腹腔出血1例行保守治疗和B超引导下血肿引流;1例62岁受者出现FK506神经毒性,减低FK506增加骁悉用量。除1例死亡患者外,其他病例肝功能均恢复正常后办理出院。住院时间10~35 d,平均(22±5) d。移植物和受体1年存活率均为95.8%。
除上述常规并发症外,术后5~7 d行常规增强CT检查发现移植肝大范围坏死4例。其中2例肝坏死出现于上述常规术后并发症病例中,1例为心功能衰竭并肺部感染病例,1例为腹腔出血病例;另外2例肝坏死独立出现。所有肝坏死病例均行保守治疗。
2.2 受体肝功能恢复情况
全体受体术后1周肝功能指标谷草转氨酶(aspartate transaminase,AST)和谷丙转氨酶(alanine transaminase,ALT)的恢复情况见图1,AST均值术后当天达最高,为1 951 U/L,ALT均值则术后第1天达最高,为962 U/L。4例肝坏死病例的肝功能恢复情况详见图2,AST和ALT均值均在术后第1天达到最高,分别为5 569 U/L和3 125 U/L。

图1 受体术后1周内谷草转氨酶和谷丙转氨酶平均值随时间的变化Fig.1 Changes of aspartate transaminase and alanine transaminase with time in recipients during the first week after liver transplantation
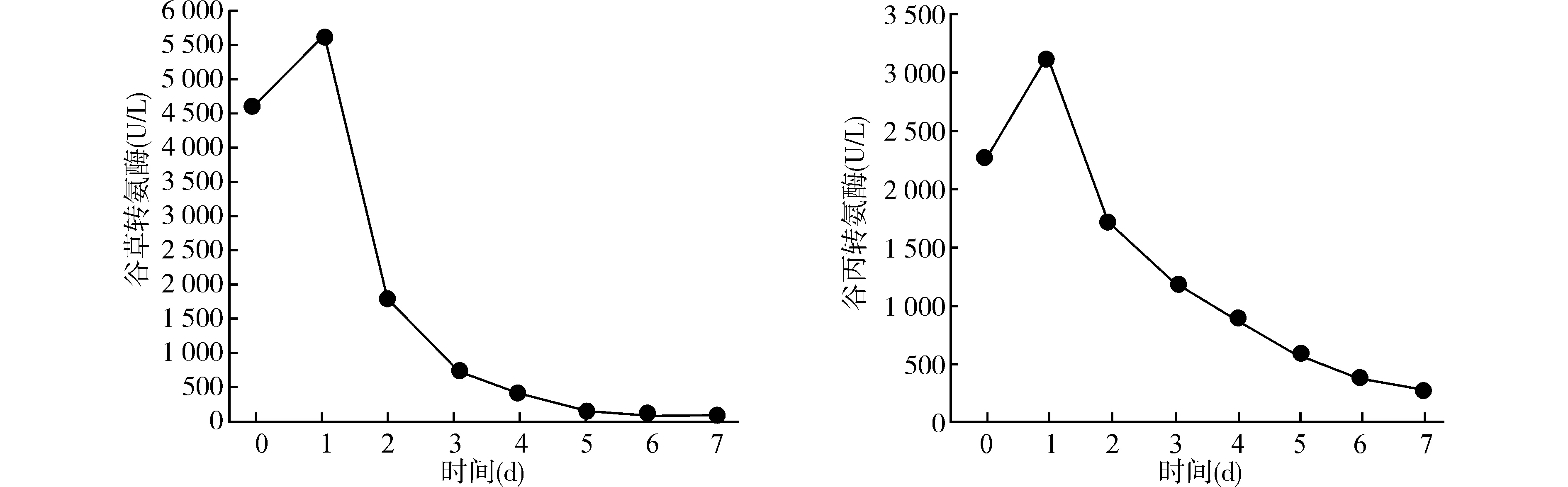
图2 移植肝坏死受体术后1周内谷草转氨酶和谷丙转氨酶平均值随时间的变化Fig.2 Changes of aspartate transaminase and alanine transaminasewith time in recipients with liver graft necrosis within the first week after liver transplantation
2.3 移植肝大范围坏死诊断和治疗
本研究共发现移植肝大范围坏死4例(16.7%),临床资料见表1。依据肝移植术后5~7 d的增强CT检查,本组病例移植肝大范围坏死的诊断标准为:①移植肝内大片状低密度区在动脉期和门静脉期无强化,其中仍可见血管走行;②排除移植肝血管性(肝动脉、门静脉和肝静脉)病变引起的继发性肝坏死。
所有肝坏死病例在常规治疗的基础上按下述原则进行治疗:①保证肝脏良好的灌注,补充足够的容量同时适当利尿;②减轻炎症反应:地塞米松每天10 mg静推,3~5 d后逐渐减量停用,并保证尿量>2 000 mL/d;③避免药物的肝毒性:不用无明确疗效的药物,并在激素和FK506浓度监测的帮助下缓慢增加FK506用量;④预防肝坏死引起的感染:联合应用三代头孢和稳可信,血常规正常后间断口服拜复乐。2例患者肝周积液行B超引导下置管引流。4例肝坏死患者于术后20~28 d复查CT示肝坏死区修复、消失(图3、4),出院前均恢复正常肝功能。

表1 肝移植术后肝坏死病例临床资料Table 1 Clinical data of patients with graft necrosis after liver transplantation
ICU:重症监护室;MELD:终末期肝病模型;AST:谷草转氨酶;ALT:谷丙转氨酶
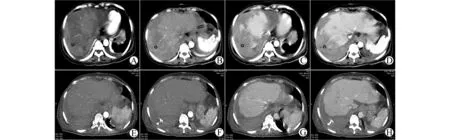
A~B:术后第7天的动脉期CT显示移植肝大片状低密度区无强化,但其内可见肝动脉走行;C~D:术后第7天的门脉期CT显示移植肝大片状低密度区无强化,但其内可见门静脉走行;E~F:术后第20天的动脉期CT显示肝内低密度区已修复消失;G~H:术后第20天的门脉期CT显示肝内低密度区已修复消失图3 CT示病例1移植肝坏死灶动态变化Fig.3 Dynamic CT images of hepatic necrotic lesion in case 1

A:术后第7天的动脉期CT显示移植肝大片状低密度区无强化,但其内可见肝动脉走行;B:术第7天的门脉期CT显示移植肝大片状低密度区无强化,但其内可见门静脉走行;C:术后第28天的CT检查显示肝内低密度区已修复消失图4 CT示病例2移植肝坏死灶动态变化Fig.4 Dynamic CT images of hepatic necrotic lesion in case 2
3 讨论
DCD供体相对脑死亡供体而言,其心脏停跳是必经的一个过程,所以DCD供肝不可避免要经历低血压、低氧、器官灌注减少和停止等热缺血损伤,DCD供肝损伤程度比脑死亡供肝严重[3-4]。与脑死亡供肝肝移植相比,DCD供肝经历较长时间的热缺血,一方面加重肝脏及胆道功能的损伤,增加DCD肝移植原发性无功能、血管性并发症和缺血性胆道并发症的发生率;另一方面,缺血再灌注损伤的炎症反应被瀑布性放大,增加DCD肝移植全身性多个器官功能障碍的发生,如急性肾损伤。
移植后血清转氨酶(AST和ALT)峰值是公认的最能反映供肝弥漫性损伤程度的指标[5-6]。转氨酶峰值水平在DCD肝移植明显高于脑死亡供肝肝移植,并且是DCD肝移植各种术后并发症发生的危险因素。本研究中AST和ALT峰值均值分别为1 951 U/L和962 U/L,高于其它中心DCD肝移植的数据[2,7-8],说明我们早期开展DCD肝移植时供肝的损伤程度较为严重。虽然如此,本组早期开展DCD肝移植总体效果比较理想(死亡率4.2%),常规并发症发生率(25.0%)并没有高于其它中心,但是我们却发现了一种新的并发症,其发生率达到16.7%。
基于以前在肝移植影像学评估中积累的经验[9-14],我们首次在DCD肝移植中发现了一种特殊的并发症——移植肝大范围坏死,在既往文献中未见报道[2-4,7-8]。DCD肝移植术后移植肝大范围坏死是一种非血管性肝坏死,即不是肝血管(肝动脉、门静脉或肝静脉)阻塞引起的继发性肝坏死,而是在肝血管通畅的情况下发生的肝坏死。这一并发症的出现与供肝损伤严重程度密切相关。增强CT清楚显示肝坏死区域内有肝动脉和门静脉走行,并且肝门部血管主干吻合处无阻塞和狭窄,即排除了血管性肝坏死。这些肝坏死病例术后第1天时血清谷草转氨酶平均值高达5569 U/L,说明移植肝大范围坏死是DCD供肝损伤严重的表现,损伤严重程度可能接近于原发性无功能。这一并发症能被发现归因于术后1周内常规行增强CT检查。若没被上述影像学检查发现,结局可能出现两种情况:处理得当并且有效,坏死灶很快完全修复,后期仍无法被发现;治疗无效则需再次肝移植或导致死亡,病情会被诊断为原发性无功能。
移植肝大范围坏死的实质是供肝损伤程度严重所导致,治疗过程中需强化对肝脏缺血性损伤和继发性炎症反应的治疗。我们认为其治疗原则主要应包括:①避免肝脏再次缺血性损伤,即保证肝脏良好的灌注,补充足够的容量同时适当地利尿;②减轻炎症反应:适当应用激素,并保证尿量>2 000 mL/d;③避免药物的肝毒性:不用无明确疗效的药物,避免肝功能不良情况下FK506浓度大幅度升高导致肝毒性;④预防肝坏死后继发感染。按照上述治疗原则,4例肝坏死患者的病灶在术后1月内(20~28 d)均完全修复。
本组DCD供肝在损伤程度比其它中心严重的情况下,并没有发生原发性无功能。这是因为我们发现并有效治疗了移植肝大范围坏死,4例患者均顺利恢复。这些病例如果治疗不当或治疗无效,均会导致移植物功能无法恢复而被诊断为原发性无功能。文献报道DCD肝移植术后原发性无功能的发生率为4%~10%[7-8,15]。本组其它常规并发症的发生率不高,如没有门静脉血栓和其它脏器功能障碍的发生,这可能与本组病例数少和受者MELD评分偏低有关。我们认为移植肝大范围坏死的治疗原则同样适用于普通程度或中等程度供肝损伤的DCD肝移植,可以降低常规并发症的发生。
我们早期开展DCD肝移植的短期效果比较理想,但长期效果有待观察。DCD供肝损伤较严重时,容易发生移植肝坏死;在正确诊断和积极治疗的基础上,移植肝坏死是可能完全修复的,这可能降低部分原发性无功能的发生。
[1] Croome K P,Lee D D,Nguyen J H,et al.Waitlist outcomes for patients relisted following failed donation after cardiac death liver transplant:implications for awarding model for end-stage liver disease exception scores[J].Am J Transplant,2017,17(9):2420-2427.
[2]Foley D P,Fernandez L A,Leverson G,et al.Donation after cardiac death:the University of Wisconsin experience with liver transplantation[J].Ann Surg,2005,242(5):724-731.
[3]霍枫,李鹏.DCD肝移植过去、现状和未来[J].肝胆外科杂志,2014,22(2):84-86.
[4]Morrissey P E,Monaco A P.Donation after circulatory death:current practices,ongoing challenges,and potential improvements[J].Transplantation,2014,97(3):258-264.
[5]Leithead J A,Tariciotti L,Gunson B,et al.Donation after cardiac death liver transplant recipients have an increased frequency of acute kidney injury[J].Am J Transplant,2012,12(4):965-975.
[6]Umbro I,Tinti F,Scalera I,et al.Acute kidney injury and post-reperfusion syndrome in liver transplantation[J].World J Gastroenterol,2016,22(42):9314-9323.
[7]赵强,金倩雯,邓雯,等.中国二类DCD供肝移植后早期肝功能不全42例的危险因素分析[J].中华器官移植杂志,2015,36(5):276-279.
[8]叶啟发,胡前超,钟自彪,等.289例中国公民逝世后器官捐献肝移植的临床疗效[J].中华消化外科杂志,2016,15(5):461-465.
[9]Wang S F,Huang Z Y,Chen P.Biliary complications after living donor liver transplantation[J].Liver Transpl,2011,17(10):1127-1136.
[10] Wang S,He X,Li Z,et al.Characterization of the middle hepatic artery and its relevance to living donor liver transplantation[J].Liver Transpl,2010,16(6):736-741.
[11] Wang S F,Chen X P,Chen Z S,et al.Left lobe auxiliary liver transplantation for end-stage hepatitis B liver cirrhosis[J].Am J Transplant,2017,17(6):1606-1612.
[12] 王少发,何晓顺,黄洁夫.肝静脉属支解剖研究的现状[J].中华外科杂志,2008,46(18):1434-1436.
[13] 王少发,何晓顺,李子平,等.肝中动脉的影像学解剖特点与活体供肝移植的相关性[J].中华器官移植杂志,2009,30(10):608-611.
[14] 王少发,陈孝平,陈知水,等.一种特殊的肝动脉变异类型及临床意义[J].中华普通外科杂志,2016,31(7):582-584.
[15] Lock J F,Schwabauer E,Martus P,et al.Early diagnosis of primary nonfunction and indication for reoperation after liver transplantation[J].Liver Transpl,2010,16(2):172-180.
ExtensiveLiverNecrosisafterDonationafterCardiacDeathLiverTransplantation
Wang Shaofa1,2,Chen Zhishui1,2,Zhang Wanguang3et al
1InstituteofOrganTransplantation,3LiverSurgeryCenter,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China2KeyLaboratoryofOrganTransplantation,MinistryofHealthandMinistryofEducation,Wuhan430030,China
ObjectiveTo explore the postoperative complications after donation after cardiac death liver transplantation and the treatment strategies.MethodsWe retrospectively analyzed early-stage 24 recipients who had liver transplant from the cardiac death donors and observed the occurrence of postoperative complications and patients’responses to treatment protocols.ResultsPostoperative peak values of aspartate transaminase and alanine transaminase were 1951 U/L and 962 U/L respectively.The length of stay in hospital was 22±5 days(10-35 days).During the hospitalization,there were 6 patients(25%)developing common postoperative complications,resulting in one death(4.2%).No primary nonfunction was found.However,within one week after the transplantation,enhanced CT showed a new complication-extensive liver necrosis in 4 patients(16.7%).Treatment protocols for liver necrosis included securing the liver perfusion,reducing secondary inflammatory response,avoiding drug hepatotoxicity and preventing secondary infection after liver necrosis.The necrotic lesion of the liver grafts fully recovered 20 to 28 days after the transplantation.ConclusionLiver grafts with relatively severe injury from cardiac death donors are susceptible to extensive liver necrosis after transplantation.On the basis of correct diagnosis and agressive treatment,necrotic lesion in liver grafts is likely to be completely repaired,which may partially reduce the occurrence of primary nonfunction.
liver transplantation; cardiac death donors; postoperative complications; liver necrosis; contrast-enhanced computed tomography
*国家卫生计生委卫生行业科研专项项目(No.201302009);国家自然科学基金资助项目(No.81373168);国家重点基础研究发展计划子课题(No.2013CB530803)
△通讯作者,Corresponding author,E-mail:chenxpchenxp@163.com
R617
10.3870/j.issn.1672-0741.2017.05.017
(2017-06-03 收稿)

