新环脂肽罗克霉素操纵子中的启动子活性研究
罗楚平,陈永兴,向亚平,陈树桥,张 婧,赵玉萍,李向前
(淮阴工学院 生命科学与食品工程学院,江苏 淮安 223003)
新环脂肽罗克霉素操纵子中的启动子活性研究
罗楚平,陈永兴,向亚平,陈树桥,张 婧,赵玉萍,李向前
(淮阴工学院 生命科学与食品工程学院,江苏 淮安 223003)
利用生物信息学和启动子连接报告基因方法阐明罗克霉素的启动子活性和转录因子作用区域,并对ploc启动子区域序列可能存在的调控蛋白进行生物学分析和预测。生物信息学分析发现ploc启动子可能存在11个调控蛋白(SigE、ResD、SpoIIID、SigB、DegU、SigX、Spo0A、Hpr、AbrB、SigH、GerE)的结合位点。通过比较16个重组和对照菌株Bs916之间木聚糖酶活的差异,当切除启动子 ResD和Hpr 两个调控因子预测结合位点时,木聚糖酶活下降较明显;切除SpoIIID和Spo0A调控因子预测结合位点时,木聚糖酶上升较明显。ResD及 Hpr这两个蛋白调控因子在ploc启动子中起关键性的正调控作用; SpoIIID和 SpoAII这两个蛋白调控因子在ploc启动子中起非常关键的负调控作用。对其分子调控机理及关键调控蛋白调控罗克霉素合成的具体作用方式需要进一步探索。
罗克霉素;枯草芽孢杆菌;关键调控因子;基因融合
0 引言
脂肽类抗生素是微生物通过非核糖体合成酶系合成的由亲水性环状短肽头部和长链疏水性脂肪酸尾部组成的一类结构多样的杂合抗生素。由于脂肽类抗生素具有广谱抗菌、抗病毒、抗肿瘤和免疫调节活性,在医药、农药和工业上具有广泛的应用价值。
罗克霉素是本团队从生防枯草芽孢杆菌中克隆鉴定得到的一组含有9个氨基酸寡肽头部和13~15个脂肪酸碳链尾巴的新型环脂肽类抗生素[1-2]。其生物活性测定表明其具有强抗菌性、抗病毒活性和较低的溶血活性,具有极强的潜在医疗价值,已经获得国内发明专利授权(中国专利授权号:ZL2013 10416487.7.)。通过构建Cosmid基因文库和基因敲除的方法,本团队克隆和鉴定到罗克霉素的合成基因簇(以下简称loc)。loc基因簇与目前已经报道的脂肽类抗生素合成基因簇具有较低的同源性(45%),是一种新型的非核糖体合成基因簇,目前也申请了国内专利(专利申请号:201310586700.9)。
本团队在locillomycin的化学结构、生物活性和生物合成方面做了大量的研究工作,但是关于locillomycin合成的信号分子调控机制了解甚少。由于locillomycin相对于其他脂肽类抗生素分泌量极低,且在生长后期才分泌合成,推测其在枯草芽孢杆菌内的合成受到非常严谨的调控。
对locillomycin启动子区域进行预测和生物信息学分析发现启动子可能存在15个转录因子结合区域,依次为ResD、SpoIIID、SigE、SigB、CreI、SigX、SigH、SpoAII、Hpr、DegU、AbrB、SigH、ResD、SigH 和SigB。Locillomycin具有很强的抗细菌和病毒活性,敲除locillomycin基因簇虽然不影响生物膜的形成,但显著影响B.subtilis 916菌落形态[3-4]。
locillomycin相对于其他脂肽类抗生素合成期晚、合成量低、在基因组的位置独特和具有显著的抗菌活性等特点[5],预测其可能受多个调控因子直接作用,在B. subtilis 916中受到非常严谨和复杂的调控。
为了全面了解locillomycin生物合成机理,本研究拟阐明调控locillomycin合成的关键信号分子、二分调控系统、直接作用的转录因子、去磷酸化系统以及其他调控模式;在阐明locillomycin分子调控机制的基础上,通过基因操作构建高产locillomycin的基因工程菌株,并优化发酵培养条件,为后续开发利用locillomycin奠定基础[6-7]。
1 试验材料与方法
1.1试验材料
1.1.1菌株、质粒和培养基
海栖热袍菌基因组DNA由淮阴工学院生化学院惠赠。大肠杆菌质粒载体pUC19(氨苄抗性标记)、大肠杆菌-芽孢杆菌穿梭质粒载体pRP22(氯霉素抗性标记)、菌株Bs916均为本实验室保存。 LB培养基:胰蛋白胨10 g/L,酵母膏5 g/L,NaCl 10 g/L。
1.1.2主要试剂和设备
所用硫酸铵、Tris等试剂为国产分析纯;木聚糖、p-hydroxybenzoic acid hydrazide(PAH-BAH) 、氯霉素购于SIGMA公司;Pyorbest聚合酶、限制性内切酶BamHI和SacI购于TAKARA公司;DNA Marker、T4DNA连接酶、DNA试剂盒和胶回收试剂盒购于北京全式金生物技术有限公司;蛋白透析袋[BS-QF-018]36mm(MD44)[MW:14000]购自Biosharp生物科技公司;高速冷冻离心机 AvantiTM-J25I购自美国BECKMAN公司; MyCyclerTM梯度PCR仪购自美国BioRad公司;UV-2000分光光度计购自上海龙尼柯仪器有限公司。
1.2试验方法
1.2.1引物设计
按照已知的Bs916罗克霉素启动子序列ploc和Genbank报道的海栖热袍菌木聚糖酶基因xynB设计引物;根据生物信息学分析预测的ploc启动子调控蛋白结合位点,选取15个调控因子相关基因构建引物1 ResDF、2 SpoIIIDF、3 SigEF、4 SigBF、5 CREIF、6 SigXF、7 SigH(-10)F、 8 SpoAIIF、9 HprF、10 DegUF、11 AbrBF、12 SigH(-35) F、13 ResDF、14 SigH(-35)F 和15 SigBF(如表1)。下划线处表示酶切位点,引物由上海生物工程技术公司合成。
1.2.2融合基因和整合载体的构建
1.2.2.1 ploc启动子全长融合基因和整合载体的构建
罗克霉素启动子ploc由引物PlocF和PlocR扩增获得,扩增条件94℃ 1 min,94℃ 30 s,51℃
30 s,72℃ 50 s,30个循环;72℃ 10 min,扩增得到940 bp的ploc片段。木聚糖酶基因xynB由引物XynBF和XynBR扩增获得,扩增条件同上,扩增得到1044 bp的xynB片段。融合基因ploc-xynB以亲本基因PCR产物为模板,由引物plocF和XynBR扩增获得,扩增条件同上,扩增得到1981 bp的融合基因ploc-xynB片段。融合基因ploc-xynB片段经过凝胶回收以及 BamHI和SacI双酶切后,插入到pUC19(2868 bp)质粒载体上,构建为质粒载体pXYNB1(ploc-xynB-pUC19),测序由上海生工生物工程技术服务有限公司完成。将测序完成的pXYNB1经过BamHI和SacI双酶切后,插入到pRP22(5900 bp)质粒载体上,构建为表达质粒载体 pXYNB2(ploc-xynB- pRP22)。

表1 引物名称和序列

图1 pUC19及pRP 22质粒图谱
1.2.2.2 ploc启动子融合基因截短和整合载体的构建
ploc启动子截短基因分别以1-15号引物(表1)为正向引物、以XynB为反向引物、以融合基因ploc-xynB片段为模板扩增获得,扩增条件94℃1 min,94℃ 30 s,51℃3 0 s,72℃(延伸时间),30个循环;72℃ 10 min。此处延伸时间随扩增片段长度的改变而改变,以1min/kb左右为参照设定不同片段延伸时间。扩增得到15个不同长度的融合基因截短片段Δploc-xynB(图2)。15个截短基因对应的调控因子为1 ResD、2 SpoIIID、3 SigE、4 SigB、5 CREI、6 SigX、7 SigH(-10)、 8 SpoAII、9 Hpr、10 DegU、11 AbrB、12 SigH(-35) 、13 ResD、14 SigH(-35) 和15 SigB。15个融合基因Δploc-xynB片段经过凝胶回收以及 BamHⅠ和SacⅠ双酶切后,插入到pRP22质粒载体上,构建为15个截短基因表达质粒载体ΔpXYNB2(Δploc-xynB- pRP22)。

图2 ploc启动子基因区域删切分析图
1.2.3整合载体转化、突变株筛选及鉴定
通过化学转化的方法[8]将pXYNB2及15个截短基因表达质粒载体ΔpXYNB2转化至 Bs916,涂布在含有5 ug/mL的氯霉素的LB 平板上,37℃培养,筛选转化子。提取转化子质粒作为模板,利用表1中引物plocF和XynBR 进行PCR 鉴定,确定转化子质粒中是否含有融合基因ploc-xynB;利用表1中1-15号引物F和XynBR 进行PCR 鉴定,截短Δploc-xynB。用同样的方法将原始质粒pRP22转化至Bs916,得到的空载重组菌(Bs916/ pRP22)作为测定极耐热木聚糖酶活的对照菌株[9]。
1.2.4木聚糖酶粗酶的制备
将重组菌Bs916/ pRP22、Bs916/ pXYNB2和15个Bs916/Δ pXYNB2接种于含有5 μg/ml氯霉素的LB培养基中,28℃过夜培养,再转入含50 mL LB培养基的250 mL三角瓶28℃培养72 h,离心除去菌体,上清液中加入硫酸铵至饱和度为75%,过夜沉淀。10000 r/min、30 min离心收集沉淀,用2 mL 25 mmol/L pH 7.5 Tris-HCl溶解沉淀,75℃保温处理酶液30 min,11000 r/min、2 min离心收集上清。即为粗制备的木聚糖酶,放入4℃冰箱备用。将重组菌Bs916/ pRP22、Bs916/ pXYNB2粗酶液转入透析袋,收集透析后的粗酶液进行浓缩,测定蛋白质表达,蛋白浓度测定采用Bradford方法。
1.2.5木聚糖酶活性的测定
100 μL质量分数0.5%的木聚糖、粗酶液20 μL和100 mmol/L pH 5.4的磷酸缓冲液80 μL反应5 min后,加600 μL终止剂。显色剂PAHBAH[配方为:V(0.5 mol/L NaOH)∶V(溶于
0.5 mol/L HCl的质量分数为5%PAH-BAH)= 4:1]煮沸10 min,冷却后用分光光度计测410 nm处光吸收值。酶单位(U)的定义:在该反应条件下,1 min内催化产生1 μmol木糖所需的酶量。
2 结果
2.1 ploc启动子生物信息学分析
采用美国国家生物信息中心的Conserved Domain Database search及其提供的世界范围的Blast引擎,对ploc启动子区域可能存在的调控蛋白进行生物信息学分析和预测。结果表明,ploc启动子区域序列与Bs168同源性大于98%,根据Bs168已知调控蛋白结合位点相关基因与ploc启动子区域进行比对,发现ploc启动子可能存在11个调控蛋白(SigE、ResD、SpoIIID、SigB、DegU、SigX、Spo0A、Hpr、AbrB、SigH、GerE)的结合位点,因此推测罗克霉素可能受到非常严谨的调控。SigE调控细胞分化早期母细胞中特异基因表达;SigB属于环境压力感应通用调控因子;SigX调控肽聚糖的合成和转化;SigH是营养压力感应调控因子,参与生物膜和芽孢形成;ResD属于二组分调控系统,是有氧呼吸和厌氧呼吸全局性调控因子;DegU调控胞外降解酶的合成、感受态的形成和杆菌霉素 D的合成;Spo0A是芽孢形成的核心调控因子;Hpr是芽孢形成和胞外酶分泌负调控因子;GerE是芽孢表面蛋白特异基因表达的关键调控因子;SpoIIID是芽孢形成调控因子;ComK是感受态形成调控因子;AbrB是对数生长期到静止生长期形态分化的全局性调控因子。在罗克基因簇的内部还存在两个调控蛋白基因RGP1和RGP2,预测这两个蛋白也可能直接参与罗克霉素的合成代谢调控。
2.2融合基因及重组质粒的构建
2.2.1 ploc启动子全长融合基因和整合载体的构建
罗克霉素启动子ploc为非核糖体肽合成酶(NRPS)途径基因簇,尝试用T. maritima的木聚糖酶XynB的连接区和ploc启动子融合,构建了融合基因ploc-xynB,琼脂糖凝胶电泳显示获得了预期大小,XynB片段1044 bp、ploc片段940 bp(经测序验证序列无误),重组质粒双酶切结果见图3。
2.2.2 ploc启动子融合基因截短和整合载体的构建
为了确定ploc启动子调控蛋白结合位点的关键区域,构建了一系列含不同长度启动子区域的极耐热木聚糖酶报告基因,以验证无误的重组质粒pXYNB2为模板,得到15个截短融合基因及截短整合载体。15个调控因子相关基因对应的截短ploc启动子基因大小分别为1 ResD/904 bp、2 SpoIIID/ 877 bp、3 SigE/ 816 bp 、4 SigB / 741 bp、5 CreI/ 664 bp 、6 SigX/ 563 bp、7 SigH(-10)/ 497 bp、 8 SpoAII/ 421 bp、9 Hpr/ 351 bp、10 DegU/ 323 bp、11 AbrB/ 178 bp、12 SigH(-35)/ 126 bp、13 ResD/ 67 bp、14 SigH(-35)/ 55 bp和15 SigB/ 28 bp,对应的截短融合基因的大小即原截短ploc启动子基因长度加上极耐热木聚糖基因XynB(1044 bp)长度。双酶切重组质粒ΔpXYNB2得到截短融合基因1044 bp+Δploc和pRP22质粒条带5900 bp。ΔpXYNB2重组质粒PCR验证及双酶切结果见图 4和5。
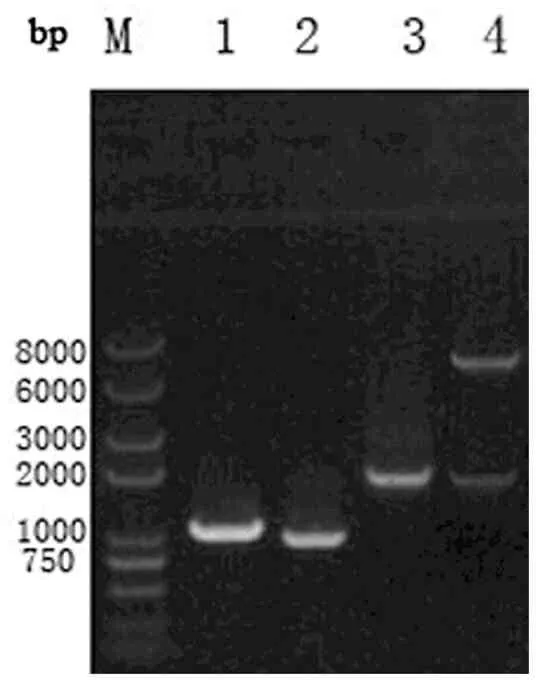
图3木聚糖酶融合基因及重组质粒酶切PCR鉴定

图4 15个截短整合载体相关基因的PCR验证
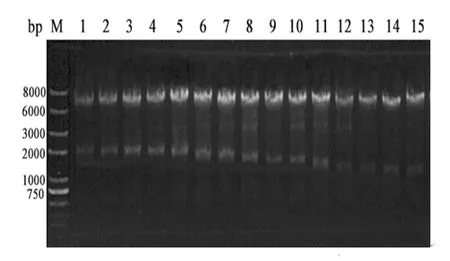
图5 15个截短整合载体相关基因的双酶切验证
2.3重组质粒pXYNB2在Bs916中的表达
重组质粒pXYNB2转化至枯草芽孢杆菌Bs916振荡摇培72 h后(培养条件见1.2.5),制备粗酶液,热处理后取上清液透析,浓缩后进行SDS-PAGE。从电泳图谱上可以看出,与对照菌株(Bs916/ pRP22)相比重组菌(Bs916/pXYNB2)的蛋白在相对分子质量43 kDa处有明显的蛋白表达条带(图6)。
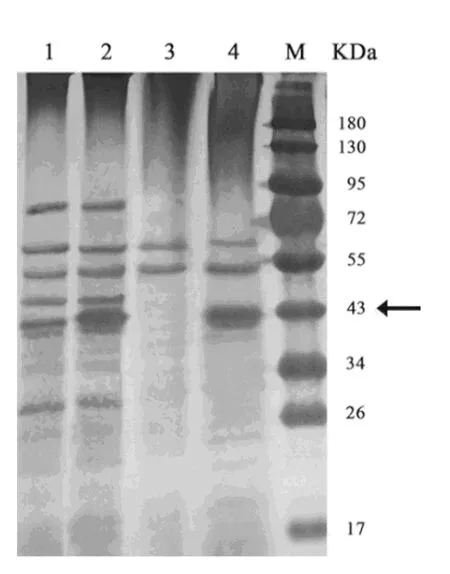
图6 融合蛋白表达的SDS-PAGE图谱
2.4重组菌的木聚糖酶活力
将重组菌(Bs916/pXYNB2)、15个截短基因重组菌(Bs916/ΔpXYNB2)和对照菌株(Bs916/pRP22)均进行三个平行振荡培养(培养条件:生长条件定为250 mL三角瓶装液50 mL,28℃,180 r/min,培养72 h)。取样测定重组菌发酵液木聚糖酶活,并以菌株(Bs916/pRP22)的木聚糖酶活作为阴性对照,进行分析,如图7所示。由图看出,0ploc 0/940为阳性对照,启动子活性平均值为5.1 U(5.2U,5.2U,4.9U);切除1 ResD调控因子后Δ1 ResD 37/940活性平均值降到3.1U(3.3U,3.0U,3.0U),这说明删切的这37 bp包含的1 ResD是 ploc启动子区域的关键调控因子;将Δ1 ResD 37/940进一步删切得到Δ2 SpoIIID 64/940,木聚糖酶活平均值反而升高到4.4 U(4.5U,4.4U,4.3U),这说明删切的这27 bp包含的E可能在 ploc启动子区域有一定的负调控作用;Δ3 SigE 125/940酶活平均值又回到3.1 U(3.1U,3.1U,3.1U),可能说明3 SigE不是 ploc启动子区域的关键调控因子,也可能此处预测的位点不是正确的3 SigE结合位点;Δ4 SigB 200/940酶活平均值为2.7 U(2.9U,2.8U,2.4U),说明4 SigB调控因子对ploc启动子的活性有一定的影响;Δ5 CREI 277/940酶活平均值升高到3.7 U(3.8U,3.7U,3.6U),随后Δ6 SigX 378/940和Δ7 SigH(-10)444/940酶活平均值分别为3.6 U(3.7U,3.6U,3.5U)和3.8 U(4.1U,3.7U,3.6U),酶活趋于稳定;Δ8 SpoAII 520/940酶活平均值大幅度升高到5.2U(5.4U,5.3U,4.9U),甚至超过了阴性对照0ploc 0/940,8 SpoAII调控因子在ploc启动子区域起到关键的负调控作用;Δ9 Hpr 590/940酶活平均值突然降到0.8 U(1.0U,0.8U,0.6U),与阴性对照相差不大,说明9 Hpr在ploc启动子区域起到非常关键的调控作用;其后Δ10 DegU 618/940、Δ11 AbrB 763/940、Δ12 SigH(-35) 815/940、Δ13 ResD 874/940、Δ14 SigH(-35)886/940和Δ15 SigB 913/940的酶活平均值变化不大,依次为0.7 U(0.8U,0.7U,0.6U)、0.7 U(0.7U,0.7U,0.7U)、0.5 U(0.6U,0.5U,0.4U)、0.4 U(0.5U,0.4U,0.3U)、0.5 U(0.6U,0.5U,0.4U)和0.2 U(0.3U,0.3U,0.1U),这6个调控因子对ploc启动子活性的影响有待进一步试验探究。
3 讨论
罗克霉素的启动子 ploc 受到多种蛋白调控因子的作用。本研究中对 ploc启动子区域进行不同长度的截短,探究多个蛋白调控因子对ploc启动子转录水平的影响。
选取的 15个调控蛋白结合位点对 ploc启动子转录水平的影响差异较大,不同调控因子对细胞生长发育的影响差异也较大,调控因子之间相互影响,形成复杂的网络关系。
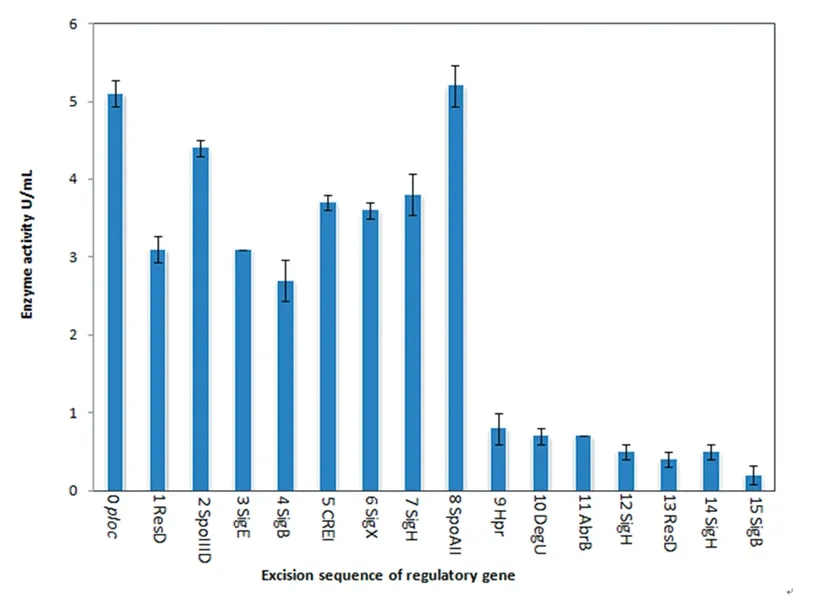
图7 重组菌(Bs916/ΔpXYNB2)木聚糖酶活
试验中,当逐一切除1 Res D、3 Sig E、4 Sig B、7 Sig H(-10)和 9 Hpr 五个调控因子时,木聚糖酶活下降,尤其是重组菌Δ1 Res D及Δ9 Hpr,以此推测得出这两个蛋白调控因子在ploc启动子中起关键的调控作用[10-11]。HPr是磷酸转移蛋白,HPr蛋白磷酸化形成HPr-Ser46-P,其作为辅助因子与分解代谢物控制蛋白A(Catabolire control protein A, Ccp A)相互作用,对枯草芽孢杆菌大约 10%的基因具有激活或阻遏作用。Sig 因子是 RNA聚合酶的亚基,是RNA聚合酶启动基因转录的关键因子,它们的作用是帮助RNA聚合酶结合到基因的启动子区域。枯草芽孢杆菌中含有18种Sig因子(http://dbtbs.hge.jp),不同的Sig因子分别转录不同的基因。例如,在前芽孢发育为成熟的芽孢的整个过程中,有不同的Sig因子在起作用,Sig F、Sig E、Sig G 和 Sig K 等之间都存在着相互制约的关系。
当切除 2 Spo IIID、5 Cre I、8 Spo AII 三个调控因子时,木聚糖酶活上升,其中重组菌Δ2 SpoIIID和Δ8 SpoAII木聚糖酶活明显升高,可以推测这两个蛋白调控因子在ploc启动子中起关键的负调控作用;Spo0A是芽孢杆菌细胞从营养生长期进入到芽孢形成期的关键应答调节蛋白,Spo0A蛋白磷酸化后可以抑制Abr B蛋白的活性。CREB(c AMP response element binding protein)是c AMP应答元件结合蛋白,通过自身磷酸化的实现来调节调控因子,从而调控细胞周期[12-13]。
当切除 6 Sig X、10 Deg U、11 Abr B、12 Sig H(-35)、13 Res D、14 Sig H(-35)和15 Sig B七个调控因子时,重组菌木聚糖酶活变化不大,但不能说这七个调控因子对ploc启动子转录水平影响不大。由于我们是逐一切除这15个调控因子,所以无法排除前面已经切除的调控因子对后面切除的调控因子的影响。Britton等[14]通过试验证明Spo0H基因编码Sig H,Abr B蛋白抑制Spo0H基因的转录。Abr B调控细胞对数期到稳定期阶段的一些基因表达[15]。在枯草芽孢杆菌中,其调控的基因包括抗生素合成、降解酶的合成以及细胞代谢、运动性等。Deg S-Deg U 是二元调控系统,Deg S 是组氨酸激酶,附着于细胞膜上,主要功能是感知环境中的刺激,如信号分子和细菌生长压力等;Deg U 是响应调控蛋白,存在细胞质中,负责细胞做出应答反应[16]。Deg U和Ycz E还可以调控杆菌霉素D转录后的表达[17]。
通过敲除单个调控因子构建单个调控因子缺陷菌株、双敲除及多组合敲除,并通过恢复敲除等技术,分析单个调控因子及多个调控因子共同作用对启动子的影响。Tsuge 等[18]证明提高枯草芽孢杆菌168中多效调控因子Deg Q的表达可以加强抗生素的分泌量。本实验室前期分析了comA基因对表面活性素的影响[19]。采用N+离子注入法对 Bs916进行突变,其中一突变株BsM49表面活性素的分泌量比出发菌株Bs916显著降低,经过基因序列比对发现突变菌株comA基因有三处核苷酸突变。王晓宇等[20]利用载体 pDG1728,将完整comA ORF插入Bs-M49的amy位点,构建comA基因互补菌株,发现其恢复了表面活性素合成能力[21]。
通过研究罗克霉素合成的分子调控机理、关键调控蛋白调控罗克霉素合成的具体作用方式,以及通过基因工程对罗克霉素ploc启动子区域进行改造获得罗克霉素的高产菌株[22],为应用罗克霉素防治植物病害奠定理论基础。
4 结论
本研究中对ploc启动子区域进行不同长度的截短并与报告基因木聚糖酶融合,探究多个蛋白调控因子对ploc启动子转录水平的影响。试验结果发现,1 ResDr及9Hpr这两个蛋白调控因子在ploc启动子中起关键性的正调控作用;2 SpoIIID和8 SpoAII这两个蛋白调控因子在ploc启动子中起非常关键的负调控作用。对其分子调控机理及关键调控蛋白调控罗克霉素合成的具体作用方式还需要进一步探索。
[1] Luo C P, Liu X H, Zhou H F, et al. Nonribosomal Peptide Synthase Gene Clusters for Lipopeptide Biosynthesis in Bacillus subtilis 916 and Their Phenotypic Functions[J].Applied and Environmental Microbiology,2015(1):422-431.
[2] Luo C P, Liu X H, Zhou X, et al. Unusual Biosynthesis and Structure of Locillomycins from Bacillus subtilis 916[J].Applied and Envivimental Microbiology, 2015(19):6601-6609.
[3] Wang X Y, Luo C P, Chen Z Y. Genome Sequence of the Plant Growth-Promoting Rhizobacterium Bacillus sp. Strain 916[J].Journal of Bacteriology, 2012(19):5467- 5468.
[4] 张帆,宋辉,班睿.hprK 基因敲除及对其枯草芽孢杆菌核黄素发酵的影响[J].生物工程学报,2006(4):534-538.
[5] 向亚萍,陈志谊,罗楚平,等.芽孢杆菌的抑菌活性与其产脂肽类抗生素的相关性[J].中国农业科学,2015(20):4064-4076.
[6] Luo C P, Liu X H, Zhou H F, et al. Nonribosomal peptide synthase gene clusters for lipopeptide biosynthesis in Bacillus subtilis 916 and their phenotypic functions[J]. Applied and Environmental Microbiology, 2015(1): 422- 431.
[7] 罗楚平, 王晓宇, 周华飞,等.生防菌Bs916合成脂肽抗生素泛革素的操纵子结构功能及生物活性[J].中国农业科学,2013(24):5142- 5149.
[8] 罗楚平, 陈志谊,刘永锋,等.杀虫晶体蛋白基因Cry1Ac在生防菌 B- 916中的表达[J]. 江苏农业学报, 2007(4):306-311.
[9] Blencke H M, Homuth G, Ludwig H, et al.Transcriptional profiling of gene expression in response to glucose in Bacillus subtilis: regulation of the central metabolic pathways[J]. Metabolic Engineering, 2003(2):133- 149.
[10] 刘燕, 秦玉昌, 潘宝海. 芽孢形成中的sigma因子[J].生命科学,2005(4):355-359.
[11] 高山峨, 范长胜, 苑兴卉, 等。表皮葡萄球菌 sigB基因调控生物膜合成的研究[J].复旦学报 :自然科学版,2006(6):779- 783, 790.
[12] 张澄, 王萍. 转录因子CREB对细胞周期调控机制的研究进展[J].中国细胞生物学学报, 2011(5):577-583.
[13] Loiseau C, Schlusselhuber M, Bigot R, et al. Surfactin from Bacillus subtilis displays an unexpected anti-Legionella activity[J].Appl Microbiol Biotechnol. 2015(12):5083-5093.
[14] Britton R A, Eichenberger P, Gonzalez-Pastor J E, et al. Genome-wide analysis of the stationary-phase sigma factor (sigma-H) regulon of Bacillus subtilis[J].J Bacteriol, 2002(17):4881- 4890.
[15] Mascher T, Helmann J D, Unden G. Stimulus perception in bacterial signal-transducing histidine kinases[J]. Microbio Mol Bio R, 2006(4): 910-938.
[16] Koumoutsi A, Chen X H, Vater J, et al. DegU and YczE positively regulate the synthesis of Bacillomycin D by Bacillus amyloloquefaciens strain FZB42[J]. Applied and Enviromental Microbiology, 2007(21):6953- 6964.
[17] Luo C P, Zhou H F, Zou J C, et al. Bacillomycin L and surfactin contribute synergistically to the phenotypic features of Bacillus subtilis 916 and the biocontrol of rice sheath blight induced by Rhizoctonia solani[J]. Applied Microbiology and Biotechnology,2015(4):1897-1910.
[18] Tsuge K, Inoue S, Ano T, et al. Horizontal transfer of iturin A operon, itu, to Bacillus subtilis 168 and conversion into an iturin A producer[J].Antimicrob Agents Chemother,2005(11):4641-4648.
[19] 罗楚平,王晓宇,陈志谊, 等. 枯草芽胞杆菌Bs916中脂肽抗生素Bacillomycin L的操纵子结构及生物活性[J].中国农业科学,2010(22):4624- 4634.
[20] Wang X Y, Luo C P, Liu Y Z, et al. Three non-aspartate amino acid mutations in the comA response regulator receiver motif severely decrease surfactin production, competence development and spore formation in Bacillus subtilis[J].Journal Microbiology Biotechnology, 2010(2):301-310.
[21] 叶延欣, 闫鹏飞, 胡渝, 等. F/10木聚糖酶二级结构含量对热稳定性的影响[J].河南农业大学学报,2013(4): 446-450.
[22] 李向前.新型饲料添加剂类维E尼亚霉素的研究——生物检测及提取分离[J].淮阴工学院学报, 1995(2):23-31.
TheResearchonthePromoterActivityinOperonofLocillomycin
LUO Chu-ping, CHEN Yong-xing, Xiang Ya-ping, CHEN Shu-qiao,ZHANG Jing, ZHAO Yu-ping, LI Xiang-qian
(Faculty of Life Science and Food Engineering, Huaiyin Institute of Technology, Huai’an Jiangsu 223003 , China)
Elucidate the promoter activity and transcription factor region of locillomycin by using the promoter to connect the reporter gene and bioinformatics. Then analyse and forecast the possible regulatory proteins in the ploc promoter region. It found that there are 11 binding sites(SigE、ResD、SpoIIID、SigB、DegU、SigX、Spo0A、Hpr、AbrB、SigH、GerE)of the ploc regulatory region. It found the differences in xylanase activity of reporter genes between recombinant bacteria (Bs916::pXYNB2), 15 strains of recombinant truncated gene (Bs916::pXYNB2) and the control strain (Bs916::pRP22). When removing ResD and Hpr, xylanase activity decreased significantly. The results showed that the regulation of the two protein transcription factors is the key in the ploc promoter. The removal of SpoIIID and SpoAII transcription factor increased xylanase activity; the results showed that the two protein regulatory factors play a negative regulatory role in the ploc promoter. ResD and Hpr, which are the key regulators of the ploc promoter, play a critical role in the regulation of the protein; the regulation of these two proteins, including SpoIIID and SpoAII, plays a critical role in the regulation of ploc promoter. Further work should be done to find out the molecular regulation mechanism and action.
locillomycin; Bacillus subtilis; key regulator; gene fusion
Q78
A
1009-7961(2017)05-0028-08
2017-05-15
江苏省农业科技资助创新资金 (SCX(17)1161);江苏省教育厅重大项目(17KJA180001);国家自然科学基金面上项目(31570061)
罗楚平(1979-),男,湖南衡南人,副教授,博士,主要从事微生物代谢工程研究。
(责任编辑:郑 菲)

