解钾菌的分离筛选及其解钾能力测定
孙金凤,翟景琳,钱 坤,李佳琦
(淮阴工学院 生命科学与食品工程学院,江苏 淮安 223003)
解钾菌的分离筛选及其解钾能力测定
孙金凤,翟景琳,钱 坤,李佳琦
(淮阴工学院 生命科学与食品工程学院,江苏 淮安 223003)
采集农作物、蔬菜、梨树等根际土样,采用以钾长石为唯一钾源的亚历山鲍罗夫培养基分离筛选解钾菌。根据解钾圈大小,从梨树、蚕豆、豌豆、黄豆根际土壤中初步筛选得到9株解钾菌,将这9株解钾菌接种解钾液体培养基,培养后,采用火焰光度计法测定速效钾含量。发酵液中有效钾含量最高为13.5 mg/L,比对照组增加了11.98 mg/L。通过单因素试验,确定菌株生长的最适碳源是蔗糖,最适氮源是蛋白胨,初始pH值6.5;最适的培养条件为摇床转速为160 r/min,培养温度为25℃,培养7 d,初始OD值为0.02,装液量为80 mL/250 mL。在这些适宜培养条件下,菌株的菌体密度提高了45%。
根际土壤;解钾菌;解钾圈;火焰光度法
0 引言
钾元素可以增强植物的抗倒伏能力、抗逆性、抗病性以及某些酶的活性等。农业生产中氮、磷、钾比例为1:0.4:0.16,这些物质主要是从化肥中吸取,但钾的比例远小于国外肥料(1:0.5:0.4),所以钾供应不足已成为限制农产品产量的重要因素之一[1]。钾肥供钾,虽然见效快,但土壤结构会被破坏、腐殖质含量会逐年下降,因此,大量使用化学肥料不符合农业的可持续发展需要[2]。
土壤中95%的钾是农作物不能利用的矿物钾形态,只有不超过土壤中总钾量2%的速效钾是农作物可以利用的钾形态[3]。解钾菌的研究和应用可以实现矿物钾的生物有效化利用。解钾菌肥的特点是,通常情况下钾元素被矿化固持,不会造成钾元素流失和环境污染,当气候适宜植物和微生物开始生长时,将矿物钾释解为速效钾盐[4]。目前,多菌种菌肥、复配优势菌肥渐渐成为生物菌肥未来的发展方向[5]。
解钾菌种类很多,分布情况因土壤而异[5]。根际解钾微生物的特别之处在于,它不仅能把土壤中难溶的矿物钾转变为可溶态,改善土壤结晶构造;还能分泌促生物质,改善植物根际土壤周围的微生态环境,活化菌群,促进植物生长[6]。罗雯等[7]人从农田土壤中分离筛选解钾菌,发现解钾透明圈不能作为判断细菌解钾能力的唯一指标,还应进一步测定解钾活性。RAJAWAT等[8]提出了鉴定解钾菌的改良平板的方法,发现添加100 mg/ L 溴百里酚蓝(BTB)有利于在较短时间内检测到解钾菌对钾的溶解。研究表明,通过优化发酵条件[9]或诱变育种[10]能够显著提高菌株的解钾能力,为筛选高效解钾菌提供了思路。
研究发现一些解钾菌能产生有机酸直接分解钾,或使有机酸与硅离子组成化合物将钾离子释放到土壤中。这些解钾菌可以起到促进农作物萌发,提高农产品产量的作用[11]。解钾菌的解钾能力依靠多种作用实现,除了有机酸外,细菌分泌的胞外聚合物使其能够结合在矿物表面,为细菌与矿物的反应提供了一个独特的微环境[12]。胞外多糖的构型不同,钾矿的溶解速率也会改变。解钾还与酶的作用有关,如碳酸酐酶[13]。从农作物土壤中筛选能分解利用矿物钾的解钾菌,研究培养条件对解钾菌生长的影响,为解钾菌肥生产提供有效菌种,有助于发展生态农业。
1 材料与方法
1.1材料、试剂和培养基
1.1.1材料和试剂
采集的梨树、油菜、小麦、豌豆、蚕豆、黄豆、大蒜、莴苣、韭菜、青菜根际土壤[14]。
钾长石:购买陶瓷釉料200目钾长石粉,去离子水浸泡过夜后盐酸淋洗,再用超纯水超声波清洗5次,直至溶液pH呈中性,烘干干燥保存[15]。
营养琼脂培养基、酵母膏和蛋白胨为生化试剂,其他所有试剂均为分析纯。
1.1.2培养基
基础培养基:蔗糖10.0 g, CaCO31.0 g, (NH4)2SO41.0 g,MgSO4·7H2O 0.5 g, NaCl 0.1 g,K2HPO42.0 g,酵母膏0.5 g,pH 7.4,去离子水1 L。
解钾培养基:蔗糖5.0 g,Na2HPO42.0 g, MgSO4·7H2O 0.5 g, Na2HPO42.0 g,FeCl35.0 mg,CaCO30.1 g,钾长石粉 1.0 g,琼脂20.0 g,pH 7.0,去离子水1 L。改良解钾培养基中添加100 mg/L BTB显色剂。
营养琼脂培养基和LB培养基[14]。
1.2实验方法
1.2.1解钾菌的分离筛选
制备土壤悬液及涂布培养。称取根际土壤3 g,置入装有27 mL无菌水的250 mL三角瓶中,160 r/min, 30℃,振荡20 min后,将土壤悬液无菌操作,梯度稀释至10-5。吸取0.1 mL土壤悬液涂布至营养琼脂培养基,37℃培养2 d。
点种培养。用灭菌的牙签将营养琼脂培养基上的单菌落点种到改良的解钾培养基上,30℃培养3 d,观察解钾圈。将能够形成解钾圈的菌株甘油管保藏于-70℃冰箱中。
1.2.2解钾菌的解钾能力测定
解钾菌的解钾能力测定采用火焰光度计法,首先测定并绘制KCl标准曲线[15],再测定并计算待测液的钾含量[15-16]。将保藏的解钾菌接种至营养琼脂培养基在37℃培养2d后,接种单菌落到LB液体培养基,180 r/min,28℃,培养2 d,制成种子液。种子液转接50 mL基础培养基,起始OD值为0.02。加入0.5 g钾长石粉,以不接种的一组作为对照组,160 r/min,30℃,培养14 d。培养液水浴蒸发浓缩至只剩粘稠物质,加入大约4 mL质量分数为6%的双氧水继续高温水浴蒸发,直至黏稠物质完全溶解,4℃、4 000 r/min离心10 min,取上清液至50 mL 容量瓶,去离子水定容。 在火焰光度计上测定培养基中速效钾含量,以不接种的解钾培养基为空白对照,每组样平行两次。解钾率计算方法如下:
其中:X1为速效钾含量(mg/L);X0为空白组钾含量(mg/L);M为钾长石重量(g);W为钾长石中钾含量(%)[12]。资料显示天然钾长石中的KO含量约为12%[9]。
1.2.3培养条件优化
采用单因素试验法,研究培养基组分(碳源、氮源)、培养条件(培养时间、温度、pH值)等因素对解钾菌生长和解钾的影响。保藏的菌种经平板培养活化后,制备种子液用于接种,初始条件分别为初始pH为7,250 mL三角瓶中装液量为50 mL,初始OD值为0.02,180 r/min,28℃,培养2 d后取样。以600 nm的吸光度值,衡量菌体浓度。
碳源采用10 g/L 的淀粉、麦芽糖、葡萄糖、甘露醇、果糖或蔗糖。氮源采用0.5 g/L 的牛肉膏、尿素、氯化铵、硫酸铵、酵母粉或蛋白胨。
并且对培养温度、培养时间、培养基初始pH值、接种量(控制起始OD值)、装液量和摇床转速等因素进行优化。为了模拟土壤坏境,设置静置培养作为对照。
每组做2次平行,以不接种的培养基为对照,测定 600 nm吸光度值(OD600),以不同的培养参数作横坐标,吸光度值作纵坐标,绘制曲线。考察各种培养条件对菌株生长的影响。
2 结果与分析
2.1解钾菌的筛选
从采集的梨树、农作物及蔬菜根际土壤样品中筛选得到了9株长势较好、具有明显黄色解钾圈的菌株,编号为JK-1~JK-9。筛选采用改良的亚历山鲍罗夫培养基,由于菌株产生的有机酸在平皿中放射状扩散,与酸性指示剂溴百里酚蓝(BTB)反应,形成黄色解钾圈。测量解钾圈直径(H)与菌落直径(D),结果见表1。解钾圈直径与菌落直径比(H/D)值最大的菌株是从梨树根际土壤中分离的菌株JK-1。
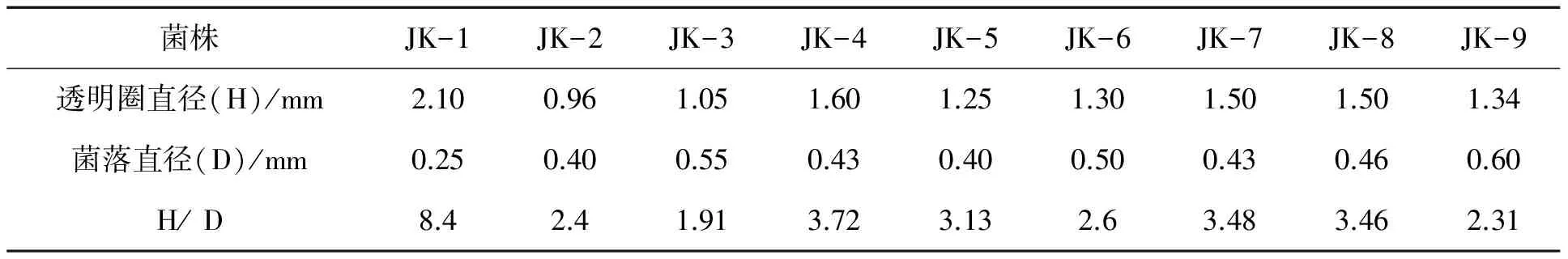
表1 不同菌株的菌落直径及透明圈直径
2.2解钾菌的解钾能力测定
采用火焰光度法对各菌株的解钾能力进行定量测定。将初筛得到的9 株解钾菌,接种至以钾长石为唯一钾源的液体培养基。培养液采用过氧化氢消化法处理,使菌体内的钾释放出来,所以测出来的钾含量是包括溶液中菌体吸附的钾、游离态的钾和部分细胞内的钾,能真正代表解钾菌实际的解钾效果[10]。由表2可知,9株解钾菌的解钾率均高于对照。菌株JK-1培养液中速效钾含量较高,为13.50 mg/L。与菌株解钾圈大小对照,发现H/D大小和液体培养基中钾的释放量呈正相关性。以解钾菌JK-1为研究对象,对其培养条件做进一步研究。

表2 不同菌株产生的速效钾含量
2.3解钾菌的培养条件优化
2.3.1不同碳源对解钾菌JK-1生长的影响
不同碳源对解钾菌生长的影响由大到小依次为:蔗糖>果糖>葡萄糖>淀粉>麦芽糖(图1)。以10 g/L蔗糖为碳源时,接种菌株 JK-1 培养2 d,培养液吸光度值最大,达1.684;其次是果糖;以麦芽糖为碳源时,菌株生长最差,吸光度值仅为0.734。 说明摇床培养时,以蔗糖、果糖为碳源,解钾菌JK-1生长速度快,其中蔗糖是最佳碳源。

图1 不同碳源对解钾菌生长的影响
2.3.2不同氮源对解钾菌JK-1生长的影响
不同氮源对解钾菌生长的影响由大到小依次为:蛋白胨>牛肉膏>酵母膏>尿素>硝酸铵(图2)。以0.5 g/L蛋白胨为氮源,培养2 d,菌株生长达到最大吸光度值,为1.523;以硝酸铵为氮源时,菌株生长较差,吸光度值为1.308。可以明显看出蛋白胨、酵母膏、牛肉膏作为氮源明显好于尿素和硝酸铵。说明解钾菌 JK-1 摇床培养时,相比于无机氮,菌株对有机氮吸收效果较好, 且以蛋白胨为氮源,生长效果最好。

图2 不同氮源对解钾菌生长的影响
2.3.3解钾菌JK-1培养条件的优化
在不同培养温度下,解钾菌JK- 1生长有较大差异(图3)。25℃时,OD值最大(1.408)。低于25℃时,OD值逐渐增大;高于25℃,OD值逐渐减小。故25℃为解钾菌JK-1的最适培养温度。
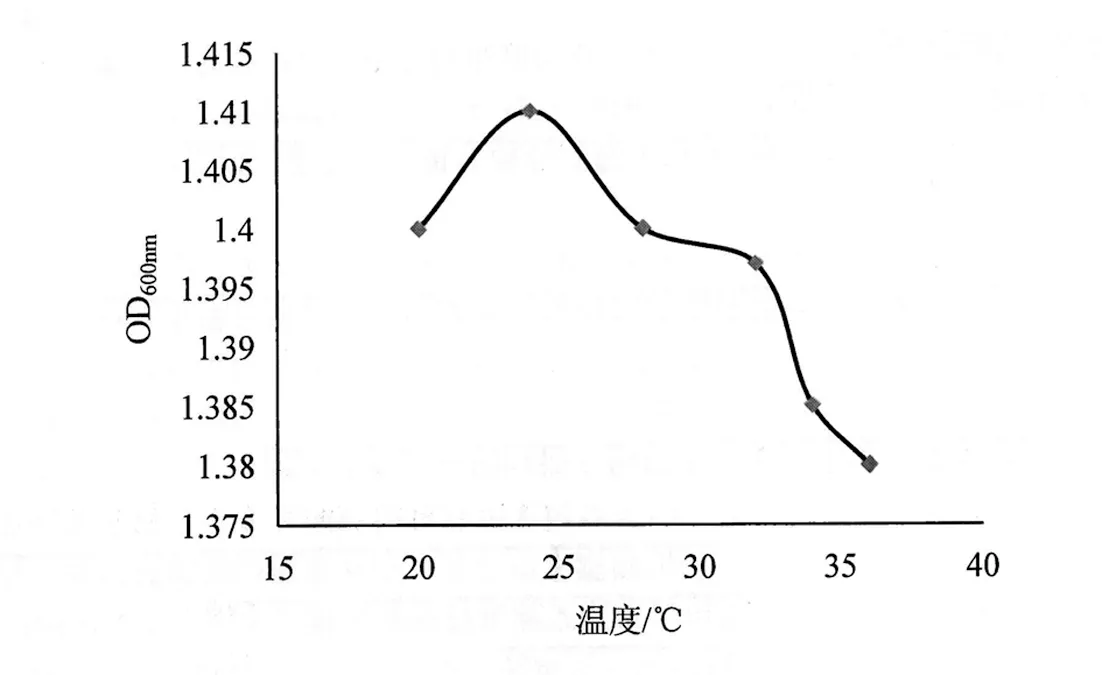
图3 温度对解钾菌生长的影响
解钾菌JK-1在28℃,180 rpm摇床培养和模拟土壤条件的静置状态下培养的生长曲线如图4所示。摇床培养7d时OD值达到最大(3.683),继续培养,OD值变小,故解钾菌JK- 1的摇床最佳培养时间为7 d。静止培养8 d时OD值达到最大值(3.751),继续培养时,可能由于营养物质的逐渐消耗,有害代谢废物的积累等原因,OD值开始下降,故解钾菌JK- 1静置最佳培养时间为8 d。
培养初期,静置培养的生长速率低于摇床培养,但是平稳期的菌体浓度相当。静置培养条件模拟的是溶氧量不多的土壤环境,温度、pH等生长因素也接近。菌株JK-1来自土壤,可以在土壤环境中良好生长,可制成菌肥用于田间施肥。
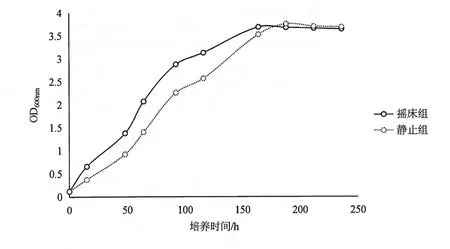
图4 培养时间对解钾菌的影响
培养基初始pH值不同,菌株JK-1生长差异明显(图5),初始pH值 6.5时,OD值最大(2.166),是培养解钾菌JK-1最适的pH值。
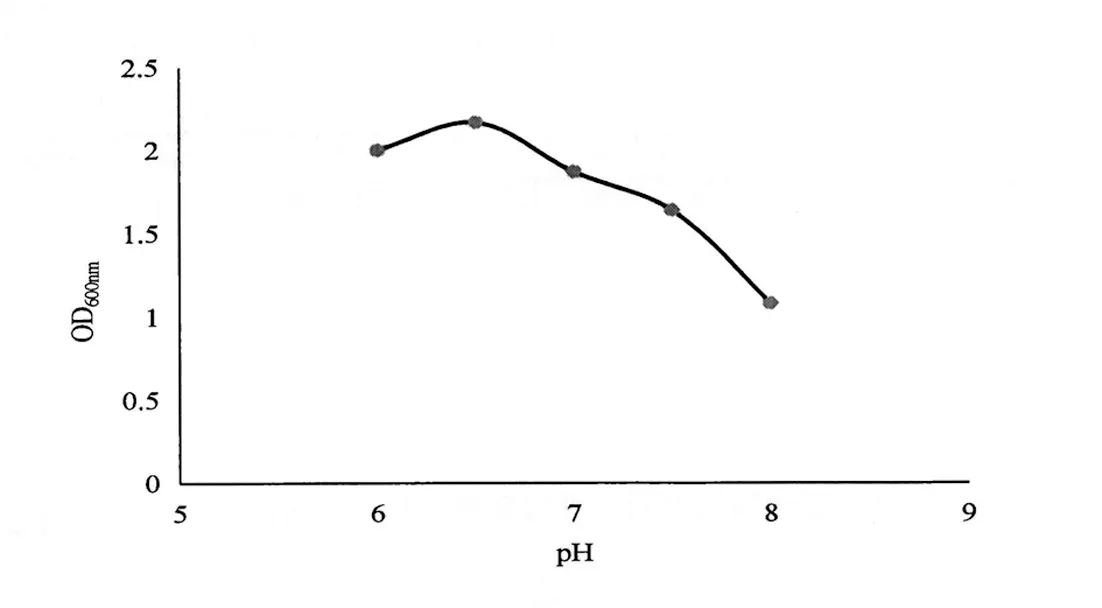
图5 pH对解钾菌生长的影响
接种量不同对菌株JK-1生长的影响如图6所示。起初随着接种量的增加,菌体生长有较明显的增加。初始OD值0.02,菌体生长的OD值最大,为2.166。但是接种量的继续增大,菌株生长的OD值反而缓慢下降,可能随着接种量增大,营养物质的消耗速率也增加,反而不利于菌体生长。故解钾菌JK-1的最适接种量选择初始OD值0.02。

图6 接种量对解钾菌生长的影响
从图7可以看出,随着摇床转速的增加,解钾菌OD值开始呈增加趋势,当摇床转速达到160 rpm,OD值达到最大值2.228。摇床转速继续增加,OD值反而慢慢下降,故培养解钾菌最适宜的摇床转速为160 r/min。
从图8可以看出,随着装液量的增加,解钾菌OD值起初逐渐增加,当250 mL三角瓶中装有80 mL培养液时,OD值达到最大,为1.915。随着装液量的继续增加,OD值开始缓慢下降,故培养解钾菌最适宜的装液量为在250 mL三角瓶中装有80 mL培养基。
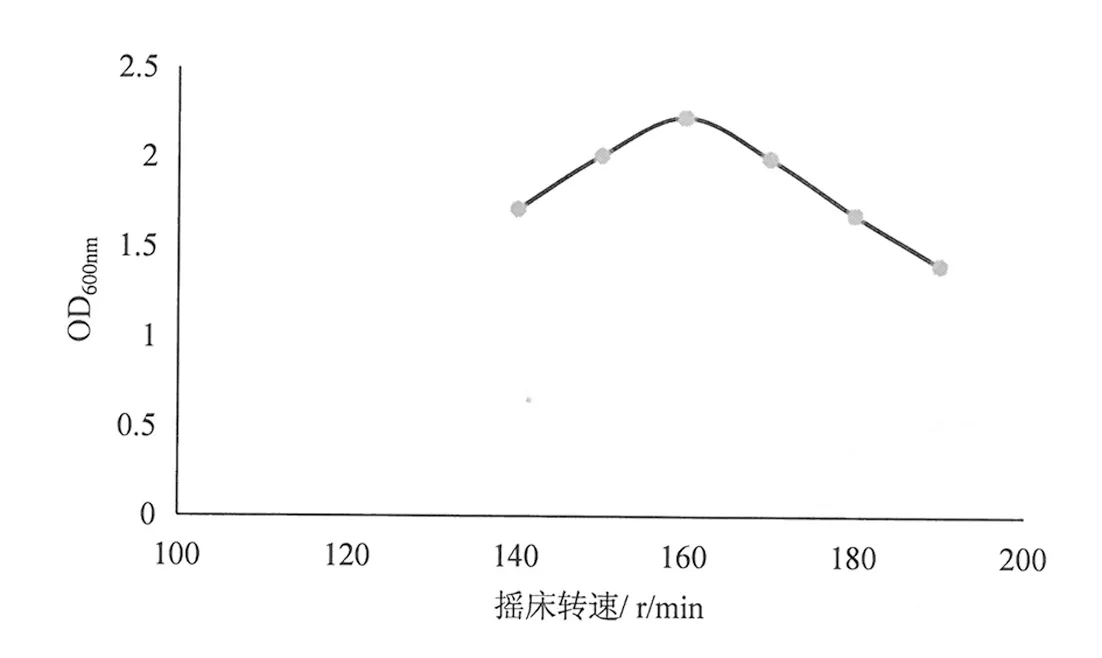
图7 摇床转速对解钾菌生长的影响

图8 装液量对解钾菌生长的影响
当采用10 g/L蔗糖作碳源,0.5 g/L胰蛋白胨作氮源,菌株JK-1在摇床转速为160 r/min,初始pH值为6.5,接种的初始OD值为0.02,装液量为80 mL/250 mL,在25℃培养7 d,最终生长达到OD值5.361,比初始条件下提高了45%。
3 讨论
解钾菌能分解钾长石、云母矿等不溶硅铝酸、磷灰石类无机矿物,广泛分布于不同土壤中,并将土壤中的矿物钾分解转化为速效钾。研究表明,从作物根际土壤中分泌出来的解钾菌,更能活化土壤里的微生物菌群活性[16]。
目前,用解钾菌溶解含钾矿物补充土壤里速效钾时存在着解钾速度慢、解钾的效率低等问题,使解钾菌的工业应用受限[2]。优化发酵条件以及对触发菌株诱变处理,能大大提高解钾量。从农作物、果树、蔬菜等根际土壤筛选的解钾菌,制成菌肥后对环境的适应性良好。
通过对解钾菌JK-1进行进一步生理生化或分子鉴定,有助于对菌株进行进一步优化和育种等研究,提高其解钾能力,最终实现在生物菌肥及实际的大田试验中的应用,为土壤提供充足的钾源,满足作物生长的需要。
[1] 汤鹏,胡佳频,易浪波,等. 钾长石矿区土壤解钾菌的分离与多样性[J].中国微生态学杂志,2015(2):125- 129.
[2] 伍善东,雷平,郭照辉,等. 1株高效解钾菌的分离、鉴定及培养条件优化[J].贵州农业科学,2016(5):77- 80.
[3] 孟繁龙,张春枝,李杨.解钾菌的筛选及培养条件优化[J].China Brewing,2012(4):91-94.
[4] 秦文旺. 钟页岩菌肥的菌种选育及其高密度发酵工艺妍究[D].太原:山西大学,2015.
[5] 党雯,郜春花,张强,等. 解钾菌的研究进展及其在农业生产中的应用[J].山西农业科学,2014(08):921-924.
[6] 罗娜,周德明,徐睿,等. 降香黄檀、 檀香根际解钾菌的筛选与活性研究[J].热带作物学报,2016(5): 964-970.
[7] 罗雯,石路怀. 具有解钾活性假单胞菌的分离与鉴定[J]. 安徽农业科学,2016(24):17-19.
[8] Mahendra Vikram Singh RAJAWAT, Surender SINGH, Satya Prakash TYAGI , et al. A Modified Plate Assay for Rapid Screening of Potassium-Solubilizing Bacteria[J]. Pedosphere , 2016(5):768-773.
[9] 张妙宜,陈宇丰,周登博,等.蓖麻根际土壤解钾菌的筛选鉴定及发酵条件的优化[J].热带作物学报,2016(12): 2268-2275.
[10] 彭钰媛,易浪波,彭清忠,等.亚硝基胍与紫外诱变选育高效解钾菌株[J].吉首大学学报:自然科学版,2016(6):61- 67.
[11] 陈宇丰,柯春亮,周登博,等.香蕉根际土壤解钾放线菌的筛选鉴定及解钾特性研究[J].生物技术通报, 2015(6):129-137.
[12] 谷付旗,季秀玲,魏云林.土壤硅酸盐细菌的研究进展[J].中国微生态学杂志,2013(5):609-611.
[13] 李甘雨,林海,王鑫,等.胶质芽孢杆菌释放矿物元素效果及机理研究进展[J]. 金属矿山,2017(487):113-119.
[14] 诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994.
[15] 王珣珏,黄巧云,蔡鹏,等. 解钾菌解钾效率检测方法的比较[J].华中农业大学学报,2016(1):81-85.
[16] 王明兆,薛莉,周鹤,等.火焰发射光谱法精确测定化肥中钾的含量[J].仪器仪表与分析监测,2004(2):36-39.
IsolationofPotassiumBacteriaandDeterminationofPotassiumDissolvingAbility
SUN Jin-feng, ZHAI Jing-lin, QIAN Kun, LI Jia-qi
(Faculty of Life Science and Food Engineering, Huaiyin Institute of Technology,Huai'an Jiangsu 223003, China)
In order to isolate efficient potassium bacteria, rhizospher soil samples of the crop, pear trees and vegetables were collected. Potassium bacteria were isolated and screened out by Aleksandrov medium which uses potash feldspar as the sole potassium source. According to the yellow halo zones, nine potassium bacteria strains were separated from the soil samples of the pear, broad bean, pea and soybean root, respectively, Then, the bacteria were inoculated into Aleksandrov liquid medium and cultivated. The content of available potassium was determined by flame spectrophotometry. The available potassium content was the highest at 13.50 mg/L which was 11.98mg / L higher than that in the control group. Single factor tests were adopted to determine the optimal medium for growth of the strain of JK-1. The optimal carbon source was sucrose, the optimal nitrogen source was peptone, and the initial pH was 6.5. The optimal culture conditions were as follows: the rotational speed of the shaker was 160 r/min, the optimal temperature was 25 ℃, the initial OD value was 0.02, the volume of liquid was 80mL in 250mL shake flask. Under these optimal conditions, cell density of JK-1 was increased by 45%.
rhizospher soil; potassium bacteria; halo zones; flame spectrophotometry
S18
A
1009-7961(2017)05-0052-05
2017-07-08
孙金凤(1972- ),女,江苏淮安人,副教授,硕士,主要从事微生物育种研究。
(责任编辑:郑 菲)

