局部进展期胃癌术后单纯化疗与同步放化疗 疗效与安全性的对比研究
聂孟良, 李铭, 袁念永, 曾召清
论 著
局部进展期胃癌术后单纯化疗与同步放化疗 疗效与安全性的对比研究
聂孟良, 李铭, 袁念永, 曾召清
目的比较局部进展期胃癌根治术后同步放化疗及与单纯化疗的临床疗效与安全性。方法回顾2008年1月至2011年12月沛县人民医院126例局部进展期胃癌根治术后患者临床资料,其中63例术后采用放疗同步替吉奥序贯4~6周期奥沙利铂联合卡培他滨(XELOX方案)化疗(放化疗组)。另63例术后仅予以6~8周期XELOX方案化疗(化疗组)。比较两组患者的不良反应发生率,并统计患者5年内生存率及复发率。结果两组患者2年生存率差异无统计学意义(P>0.05),3年以上生存率放化疗组高于化疗组(P<0.05)。复发率放化疗组低于化疗组(P<0.05)。患者的不良反应主要表现在胃肠道、血液系统及肝肾功能方面。与化疗组相比,放化疗组患者Ⅰ~Ⅲ级不良反应发生率较高(P<0.05),Ⅳ级不良反应两组差异无统计学意义(P>0.05)。结论局部进展期胃癌根治术后同步放化疗较单纯化疗可以延长患者5年生存率,降低复发率,不良反应可以耐受。
进展期胃癌; 手术后; 同步放化疗; 化疗; 疗效比较
根治性手术切除目前被认为是治疗局部进展期胃癌的最主要方法。单纯的手术效果并不理想,术后仍有40%~70%患者发生局部复发和远处转移[1-2]。为提高患者生存率,降低局部复发率,外科手术辅助放、化疗或靶向药物治疗等综合治疗模式已逐渐应用到临床治疗当中[3]。美国INT0116试验结果显示,术后辅助放化疗可延长患者生存期,局部复发率显著降低[4]。日本ACTS-GC临床试验采用D2根治手术术后S1化疗方案[5]。目前,不同国家的治疗策略存在差异,对于胃癌术后实施何种辅助治疗方案仍然存在较大争议。如何将根治术、同期放疗和化疗更好的结合目前尚未形成共识。为此,本研究比较局部进展期胃癌D2根治术后同期放化疗和单纯化疗的疗效和不良反应,为临床选择胃癌患者术后合适的辅助治疗方案提供参考。
1 资料与方法
1.1 一般资料
2008年1月至2011年12月我院收治的进展期胃癌根治术后患者126例。肿瘤部位:胃体癌27例、胃窦癌52例、胃食管交界癌39例、全胃癌8例。临床分期:Ⅱ期32例、Ⅲa期41例、Ⅲb期39例、Ⅳ期14例。无手术禁忌证,卡氏评分≥70分。126例全部由同一组手术团队完成,均成功施行D2根治术。63例术后给予放化疗联合方案治疗为放化疗组,另63例行单纯化疗为化疗组。其他治疗包括抑酸、胃黏膜保护药物,以及营养支持治疗。
1.2 治疗方法
1.2.1 放化疗组 于手术后2周给予替吉奥60 mg/m2(2次/天),连服2周,休息1周后开始放疗。放疗第1天,继续给予替吉奥60 mg/m2(2次/天),连用2周,休息1周,3周重复,直到放疗结束。放疗采用三维适形放疗技术,靶区勾画参照胃癌术后放射治疗指南执行,其中,勾画靶区包括瘤床、吻合口(残端)及区域淋巴结以及危险器官。计划给予靶区剂量为45 Gy/25次。放疗结束后2周开始接受4~6周期XELOX方案化疗,给药方法:奥沙利铂(江苏恒瑞医药股份有限公司,批号15081515)100~130 mg/m2,静脉滴注3 h,第1天;卡培他滨(上海罗氏制药有限公司,批号SH1734)1 000 mg/m2,口服,2次/天,连用2周,休息1周;每3周重复。
1.2.2 化疗组 手术2周后开始进行XELOX方案化疗6~8周期,给药方法同放化疗组。
1.3 疗效及不良反应评估
术后2年内每3个月随访1次,此后每半年随访1次。定期检查血常规、肿瘤指标、B超及胸腹部CT,统计患者5年内生存率及肿瘤复发情况。随访时间截至2016年12月。化疗不良反应按WHO化疗药物毒性反应分级标准评价,放疗不良反应按照RTOG急性放射损伤分级标准评定。
1.4 统计学方法
采用SPSS 17.0软件进行数据统计,计数资料比较采用χ2检验,计量资料比较采用t检验,标准水准α为0.05。当P<0.05时,表示差异具有统计学意义。
2 结果
2.1 两组一般资料比较
放化疗组63例,男41例,女22例,年龄37~75岁,平均(57.4±7.3)岁;化疗组63例,男38例,女25例,年龄42~74岁,平均(59.1±8.9)岁。两组患者一般资料比较,差异无统计学意义(P>0.05)。
2.2 两组患者生存情况比较
126例患者均获得随访。两组1~5年生存率见表1,显示患者术后2年内的生存率比较,放化疗组虽比化疗组高,但差异无统计学意义(P>0.05);术后3~5年,放化疗组生存率明显高于化疗组,差异均有统计学意义(均P<0.05)。

表1 放化疗组与化疗组患者5年内的生存率比较[例(%)]
注:两组3~5年生存率比较均P<0.05
2.3 两组患者5年内的复发转移情况
统计结果表明,放化疗组发生局部淋巴结转移21例(33.33%),局部复发4例(6.35%),远处转移12例(19.05%);化疗组局部淋巴结转移32例(50.79%),局部复发11例(17.46%),远处转移19例(30.16%),两组比较,差异均有统计学意义(均P<0.05)。
2.4 两组患者不良反应发生情况比较
患者的不良反应主要表现在胃肠道系统、血液系统及肝肾功能方面。与化疗组相比,放化疗组患者Ⅰ~Ⅲ级恶心呕吐及腹泻发生率较高(P<0.05),Ⅳ级发生率两组比较差异无统计学意义(P>0.05)。在血液系统方面,放化疗组白细胞降低率、粒细胞降低率、血小板降低率及贫血率高于化疗组,Ⅰ~Ⅱ级粒细胞和血小板降低率与化疗组相比差异有统计学意义(P<0.05),Ⅲ~Ⅳ级比较差异无统计学意义(P>0.05)。详见表2。
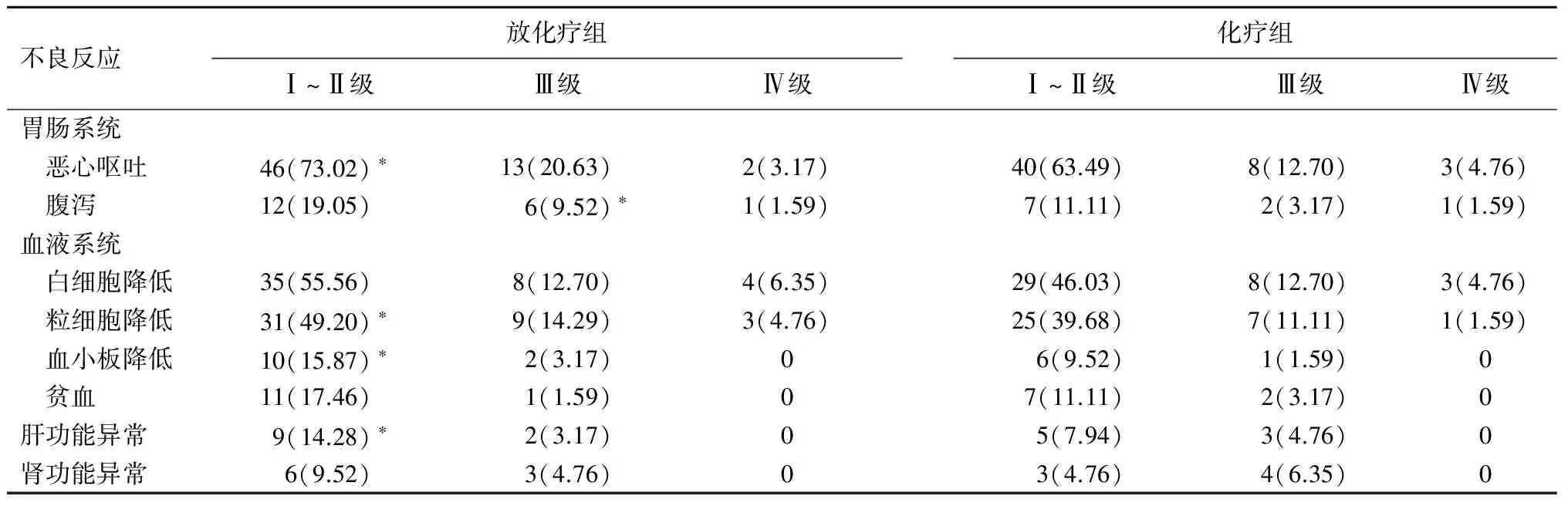
表2 放化疗组与化疗组患者术后用药不良反应情况比较[例(%)]
注:*与化疗组相比,P<0.05
3 讨论
胃癌是恶性程度高且发病率高、死亡率高的肿瘤之一。早期胃癌患者经合理治疗,愈后良好;因检测条件个人意识等原因,大多数胃癌患者发现时已经是进展期,在进展期胃癌治疗中,根治性手术切除占主要地位。手术虽然能够切除肉眼可见的肿瘤组织及区域淋巴结,但仍可能残留少量肿瘤细胞,这就导致胃癌患者术后长期生存率低下,复发和转移率较高[6]。为了降低术后转移和复发率,延长患者长期生存率,术后常需要辅助化疗。除了化疗,放射治疗作为一种重要的局部治疗方式在多种肿瘤治疗中受到越来越多的关注[7]。近年来,已有研究证明,术后辅助放化疗能有效降低胃癌复发率,提高患者生存情况[8]。Kim等[9]对胃癌D2根治术后患者进行放化疗辅助治疗,结果显示,与单纯ARTIST化疗组相比,辅助放化疗能提高患者生存率,淋巴结转移也能得到一定控制。韩国的一项研究也表明,对Ⅲ~Ⅳ期R0切除D2淋巴结清扫术后的患者进行放化疗联合治疗,与单纯化疗相比,能显著提高患者无瘤生存期[10]。国内也有相关研究[11-13]报道,局部进展期胃癌根治术后辅助放化疗治疗效果与单纯化疗相比更有利于提高患者生存率,降低复发率。本研究对D2根治术后胃癌患者采取同期放化疗辅助治疗,发现与化疗组相比,放化疗组术后2年内生存率差异无统计学意义,但患者3年及3年以上生存率高于化疗组,放化疗组5年生存率为61.90%,而化疗组只有50.79%,差异有统计学意义。两组肿瘤复发情况也明显不同,放化疗组复发率明显低于化疗组,差异有统计学意义(P<0.05)。
对进展期胃癌患者,术后辅助放化疗逐渐成为临床常用的治疗手段[14]。但不同的治疗方案影响着疗效,不同地区对胃癌术后的化疗方案不同,目前还没有形成标准的化疗方案。美国国立综合癌症网络(NCCN)指南推荐采用氟尿嘧啶类和铂类为基础的联合化疗方案。SWOG/INT0116试验[4]所用化疗方案为持续注射氟尿嘧啶,能提高患者3年生存率,但血液毒性严重,患者耐受力差。本研究中放疗期间口服替吉奥,替吉奥是一种新型的口服氟尿嘧啶类复方化疗药,其成分为替加氟、吉美嘧啶和奥替拉西钾。替加氟口服后能转化为5-FU,吉美嘧啶能在体内抑制5-FU的分解代谢,奥替拉西钾则能抑制肠道黏膜细胞内乳清酸核糖转移酶活性,从而减轻因5-FU磷酸化引起的消化道毒性[15]。本研究中放化疗组于放疗后采用XELOX化疗方案,其中卡培他滨是新一代的氟尿嘧啶类药物,奥沙利铂是新的铂类抗癌药,此方案与目前临床常用的FOLFOX4方案相比,不良反应低,已成为NCCN指南推荐的胃癌首选化疗方案。本研究结果表明,与化疗组相比,放化疗组患者在胃肠道、血液系统及肝肾功能方面的不良反应偏高,在Ⅰ~Ⅲ级不良反应两组的差异有统计学意义,但Ⅳ级不良反应发生率两组差异无统计学意义,在治疗期间,没有患者因为不良反应严重而终止治疗。
综上所述,进展期胃癌D2根治术后同步放化疗与单纯化疗相比,患者长期生存率提高,复发率和转移率降低,不良反应略高,但仍然可以耐受。
[1] 左朝晖,欧阳永忠,汤明,等.胃癌的综合治疗研究的进展[J].中华普外科手术学杂志(电子版),2012,6(3):319-324.
[2] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics[J].CA Cancer J Clin,2015,65(2):87-108.
[3] Ronellenfitsch U,Schwarzbach M,Hofheinz R,et al.Perioperative chemo (radio) therapy versus primary surgery for resectable adenocarcinoma of the stomach, gastroesophageal junction, and lower esophagus[J].Cochrane Database Syst Rev,2013,31(5):CD008107.
[4] Macdonald JS,Smalley SR,Benedetti J,et al.Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction[J].N Engl J Med,2001,345(10):725-730.
[5] Sakuramoto S,Sasako M,Yamaguchi T,et al.Adjuwant Chemoradiotherapy with gastic cancer with S-1,an oral fluoropyrimidine[J].N Engl Med,2007,357(18):1810-1820.
[6] Moretones C, Leon D, Navarro A, et al. Interobserver variability in target volume delineation in postoperative radiochemotherapy for gastric cancer.A pilot prospective study[J].Clin Transl Oncol,2012,14(2):132-137.
[7] 张楠,尹丽,何侠.放射治疗在胃癌中的应用现状[J].中国肿瘤外科杂志,2016,8(4):223-230.
[8] 陈炳光,蔡悦成,莫如康,等.胃癌根治术后三维适形放疗联合卡培他滨化疗临床研究[J].国际医药卫生导报,2012,18(7):942-945.
[9] Kim S, Lim DH, Lee J, et al. An observational study suggesting clinical benefit for adjuant postoperative cheoradiation in a population of over 500 cases after gastic resection with D2 nodal dissection for adenocarcinoma of thestomach[J]. Int J Radiat Oncol Biol Phys,2005,63(5):1279-1285.
[10] Kim TH, Park SR, Ryu KW, et al. Phase 3 trial postoperative chemotherapy alone versus chmoradiation therapy in stage Ⅲ-Ⅳ gastric cancer treated with R0 gastrectomy and D2 lymph node dissection[J].Intl J Radiat Oncol Biol Phys,2012,84(5):585-592.
[11] 张亮,王小博,张磊,等.局部进展期胃癌术后放化疗与单纯化疗的临床对比研究[J].实用临床医药杂志,2015,19(23):139-145.
[12] 俞倩,陈中安.局部进展期胃癌根治术后采取同期放化疗的临床效果分析[J].实用癌症杂志,2014,29(3):281-283.
[13] 刘广国,肖仕明,赵清梅,等.局部进展期胃癌根治术后三维适形放疗联合同期化疗与单纯化疗的对比研究[J].现代中西医结合杂志,2015,24(30):3321-3323.
[14] Schuhmacher CC,Novotny AA,Meyer HJ,et al.Treatment of gastric cancer beyond current guideline: state of the art[J]. Chirurg,2013, 84(4):310-315.
[15] Guo RP,Zhong C,Shi M,et al.Clincal value of apoptosis and angiogenesis factors in estimating the prognosis of hepatocellular carcinoma[J].J Cancer Res Clin Oncol,2006,132(9):547-555.
Comparisonofclinicalefficacyandsafetybetweentwotreatmentsinlocallyadvancedgastriccancerafterradicaloperation
NIEMengliang1,LIMing1,YUANNianyong1,ZENGShaoqing2.
(1.DepartmentofSurgicalOnconlogy,PeixianPeople’sHospital,Peixian221600,China; 2.DepartmentofRadotherapy,PeixianPeople’sHospital,Peixian221600,China)
NIEMengliang,Email:15852223688@163.com
ObjectiveTo compare the clinical efficacy and safety of concurrent chemoradiotherapy and chemotherapy alone after D2 radical gastrectomy for locally advanced gastric cancer.MethodsA total of 126 cases of locally advanced gastric cancer were divided into two groups: concurrent chemoradiotherapy group (the RCT group) and chemotherapy group (the CT group), and each group contained 63 cases. The RCT group
radiotherapy concurrent with capecitabine chemotherapy, and the followed by 4~6 cycles of XELOX chemotherapy; however, the CT group only received 6~8 cycles of XELOX chemotherapy. The incidence of side effects, survival rates in 5 year and metastasis rate were compared between the two groups.ResultsThe 2-year survival rates of the 2 groups had no significant difference (P>0.05), while the 3-year survival rate of the RCT group was higher than that of the CT group (P<0.05). The 5-year survival rate of the RCT group was 61.90%, which was significantly higher than that of the CT group (50.79%). The metastasis rate of the RCT group was lower than that of the CT group, and the difference was statistically significant (P<0.05). The side effects of the 2 groups were gastrointestinal toxicity, abnormal liver function, renal dysfunction and blood toxicity. The incidence of grade Ⅰ-Ⅲ was significantly higher than that of the CT group, although the incidence of grade Ⅳ was higher than that of the CT group, the difference was not significant (P>0.05).ConclusionsConcurrent chemoradiotherapy after radical gastrectomy for D2 locally advanced gastric cancer was better than chemotherapy alone, it can improve 5-year survival rate, reduce relapse rate, and the side effects can be tolerated.
Locally advanced gastric cancer; Postoperation; Concurrent chemoradiotherapy; Chemotherapy; Comparison on therapeutic effect
221600 江苏 沛县,沛县人民医院 肿瘤外科(聂孟良,李铭,袁念永); 放疗科(曾召清)
聂孟良,Email:15852223688@163.com
10.3969/j.issn.1674-4136.2017.05.008
1674-4136(2017)05-0304-04
2017-05-22][本文编辑:李筱蕾]

