微波消融人乳腺纤维腺瘤移植兔肌肉层观察转归的研究
梁梦迪, 黄耀禹, 黄华兴, 周文斌, 夏添松, 王水
论 著
微波消融人乳腺纤维腺瘤移植兔肌肉层观察转归的研究
梁梦迪, 黄耀禹, 黄华兴, 周文斌, 夏添松, 王水
目的观察微波消融后的乳腺纤维腺瘤在兔活体内的转归。方法取长径1 cm的新鲜离体人乳腺纤维腺瘤标本,经微波消融灭活,移植于兔大腿肌肉层。采用体检、超声检查及病理检查连续观察微波消融后纤维腺瘤在兔体内的转归特点。结果实验兔均未出现操作相关的并发症。标本消融前的体积为(641.1±60.6) mm3,体检示标本完全吸收所需的时间为(11.6±1.5)周。超声检查示消融后标本起初表现为肌肉层内边界清晰的低回声团块,随时间延长,回声自周边增强,体积不断缩小,直至无法探及,时间为(14.0±3.1)周。病理学检查示微波消融后即刻乳腺纤维腺瘤的组织结构仍然完整,形态清晰可辨,随着在兔体内时间的延长,组织逐渐崩解、炎症细胞自周边向中心浸润。结论经微波消融后的乳腺纤维腺瘤可被吸收,不遗留瘢痕。超声检查可用于微波消融后的监测。
乳腺疾病; 纤维腺瘤; 微波; 消融技术; 兔; 动物,实验
乳腺纤维腺瘤是乳腺中常见的良性肿瘤,多见于育龄期女性,尤其是<30岁的年轻女性[1-2]。年轻女性对乳房疾病治疗后的美容效果有着较高的要求,因此乳腺良性肿瘤的微创治疗吸引了越来越多的关注和研究。微波消融是一种新兴的原位消融技术,其原理是将微波刀头插入瘤体内,刀头发射的微波可使肿瘤组织内的水分子高速运动、摩擦产热、温度迅速增高,通常超过90 ℃,从而起到原位灭活肿瘤细胞的作用。微波消融作为一种新兴的微创治疗方法,已经在肝癌、子宫肌瘤的治疗中得到广泛应用[3-6]。本研究的目的是建立兔实验模型,联合影像学和病理学评估微波消融治疗后的乳腺纤维腺瘤在兔体内的转归。由于非活体移植不会导致宿主免疫排斥反应[7],我们用微波消融完全灭活的人乳腺纤维腺瘤建立非活体移植模型来模拟体内环境进行研究。
1 资料与方法
1.1 资料 人乳腺纤维腺瘤标本取自南京医科大学第一附属医院普外科乳腺病区,所有患者均签署知情同意书。患者经粗针穿刺活检或手术中冰冻切片快速活检,明确诊断为乳腺纤维腺瘤。在手术室无菌条件下自手术标本切取长径1 cm的标本,无菌、低温条件保存,并于离体后1 h内行微波消融完全灭活。实验兔为新西兰白兔(合格证号201603939),雌性,3月龄,体重2.5 kg,由南京医科大学动物实验中心提供,动物使用许可证号:SYXK(苏)20136-0016。
1.2 微波消融 实验用冷循环微波刀及落地式肿瘤微波治疗仪(ECO-100C,南京亿高公司),微波频率(2 450 ± 10)MHz,输出功率可连续调节,范围为0~100 W,冷循环微波刀直径2 mm。本实验采用的治疗参数为:频率2 450 MHz,功率40 W。根据本团队前期[8-9]研究,在40 W的功率条件下,长径1 cm的目标组织选择时间1 min。
1.3 TTC染色试验 为验证本实验所选用的MWA治疗参数的可靠性,明确实验标本已经被完全灭活,参照Glodberg等[10]提出的方法随机选择2份微波消融后的实验标本进行TTC 染色试验,另选取1份新鲜纤维腺瘤标本作为阴性对照。实验前配制新鲜2 % TTC溶液,将选取的实验标本及对照标本切成5 mm厚度的薄片,完全浸泡于2 % TTC溶液中,20 ℃静置30 min。完全灭活的组织颜色没有改变,而新鲜组织可被染成红色,肉眼即可辨别。
1.4 建立非活体移植模型 在兔耳缘静脉注射戊巴比妥钠(15 mg/ml, 1.8~2.2 ml/kg),麻醉过程中严密监测实验兔的角膜反射及呼吸运动。麻醉成功后,于实验兔右侧大腿内侧备皮、消毒,切开皮肤,钝性分离肌肉,沿肌纤维方向分离出1.5 cm间隙,将微波消融后完全灭活的纤维腺瘤标本埋于肌肉层间,逐层缝合。待实验兔麻醉苏醒后放回笼具,术后第2天观察恢复情况。
1.5 转归评估 至少每周体检1次,观察实验兔的一般情况、切口愈合情况、肿块的质地及大小等。超声检查每2周1次,当肿块不易触及时,每周进行超声检查,监测肿块被吸收的时间。选取微波消融后即刻的纤维腺瘤标本以及非活体移植模型内2周、4周、6周的标本组织各1份进行组织病理学检查,观察微波消融后的纤维腺瘤组织病理改变。因为6周后组织大体标本及镜下形态都难以辨别为纤维腺瘤,故6周后不再取标本做病理学检查。

2 结果
2.1 一般情况 实验共取纤维腺瘤标本11份,消融前体积为(641.1±60.6)mm3,其中3份行TTC染色检查,8份于消融灭活后分别移植入8只新西兰白兔建立非活体移植模型。所有的实验兔均未出现移植相关的不良反应或并发症。
2.2 TTC染色试验 经TTC溶液染色后,新鲜纤维腺瘤标本被完全染成红色,相比之下,经过微波消融后的纤维腺瘤标本保持原有颜色,没有被染色,已经被完全灭活(图1)。
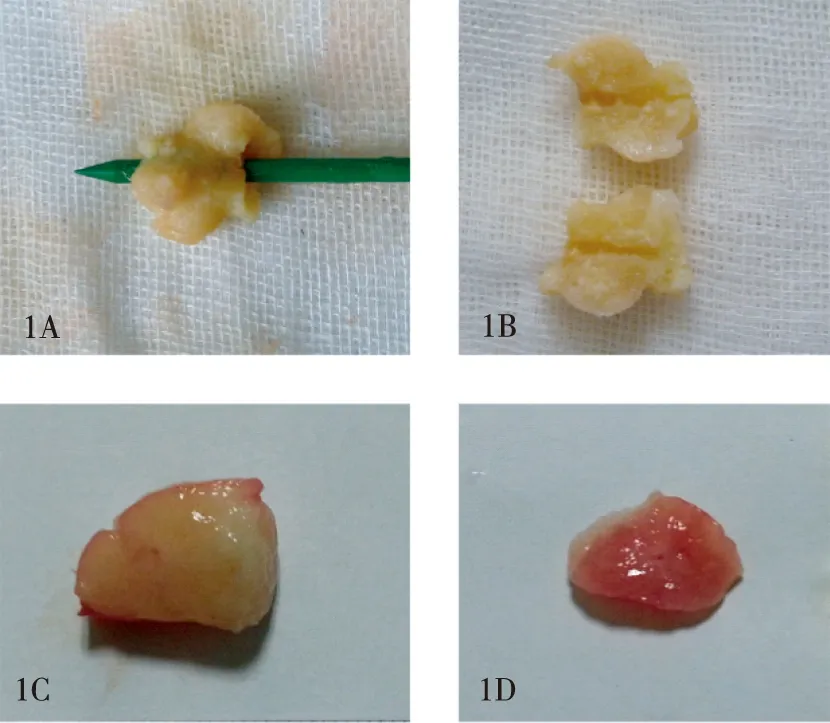
图1 TTC染色试验结果1A、1B:分别为经过微波消融后的乳腺纤维腺瘤染色前和染色后, 1C、1D:分别为阳性对照组新鲜乳腺纤维腺瘤染色前和染色后
2.3 体检 微波消融后,纤维腺瘤标本不同程度地皱缩变形、质地变硬。移植入实验兔体内2周后标
本质地逐渐变软、光滑且体积不断缩小。最终均被吸收,未见残留硬结、组织液化或组织塌陷。体检下纤维腺瘤标本无法触及的时间为(11.6±1.5)周,此时超声检查下仍可见残存标本体积为(129.1±90.8)mm3。
2.4 超声检查 标本移植入实验兔体内,在超声检查下表现为肌肉层内边界清晰的低回声团块。随时间延长,标本体积逐渐减小同时回声信号自边缘至中央逐渐增强,至在体内第6周,标本的回声信号与周围肌肉组织的回声信号相仿。另外除周边正常组织内可见少许血流外,标本区内未见明显血流信号。超声检查测量下微波消融后纤维腺瘤标本体内第1周的体积为(494.5±188.0)mm3,移植3个月后,已有2只实验兔体内的纤维腺瘤标本被完全吸收。超声检查下,消融后的纤维腺瘤标本被完全吸收时间为(14.0±3.1)周(图2、图3)。
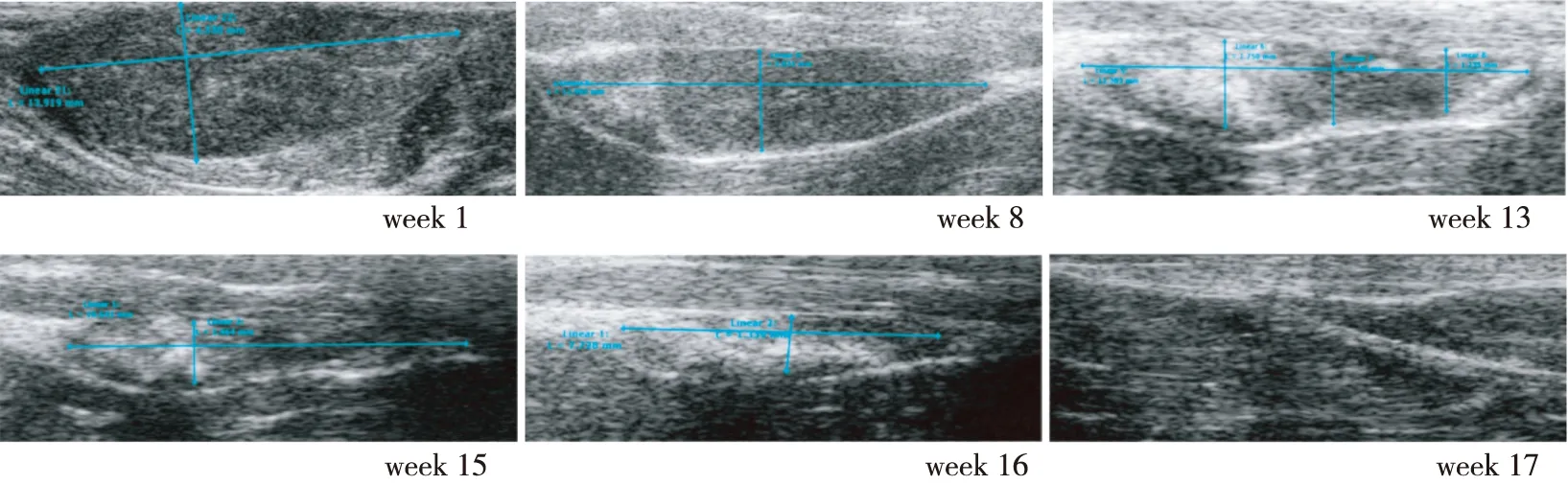
图2 1例微波消融后的乳腺纤维腺瘤在实验兔体内的超声图像

图3 5例消融后的乳腺纤维腺瘤随在体内时间延长平均体积的变化曲线
2.5 组织病理学检查 大体标本上,纤维腺瘤经过微波消融后不同程度地皱缩变形,在体内2周后取出的标本,尽管仍然可以辨别出乳腺纤维腺瘤的结构,但已经可观察到片状的坏死组织。在体内4周后取出标本,表面光滑、淡黄色、呈乳酪样。病理切片HE染色后镜下观察,微波消融后即刻可见细胞发生一系列变化,包括:细胞核的浓缩、细胞拉长、极性改变,但乳腺纤维腺瘤的组织结构仍然完整,形态清晰可辨,未见组织崩解,出现“鬼影”现象(图4),与Zhou等[9]报道相一致。从第2周起,在标本边缘处可见炎症细胞的浸润,并随体内时间延长,浸润范围增大。至第4周和第6周,由于镜下组织结构崩解,视野内大片的坏死物质和无细胞的胶原成分,已经难以辨别组织来源。

图4 植入兔肌肉层的纤维腺瘤组织病理组织细胞呈现出细胞核浓缩、细胞拉长、极性改变,但乳腺纤维腺瘤的组织结构仍然完整,形态清晰可辨
3 讨论
消融技术在原位灭活肿瘤,灭活的组织仍遗留于体内,因此,研究灭活的组织转归结局提供临床依据是必要的。实验中,所选取的乳腺纤维腺瘤标本长径1 cm、微波消融前体积为(641.1±60.6)mm3,经过微波消融完全灭活后2~4个月被逐渐吸收。射频消融治疗2例乳腺纤维腺瘤的报道中,纤维腺瘤的长径分别为23.4 mm和30.2 mm,肿块在治疗后半年内逐渐缩小消退[11]。冷冻消融技术治疗长径在0.8~4.2 cm的乳腺纤维腺瘤,消融后吸收的周期是3个月至3年不等[12-15]。在体外高强度聚焦超声治疗后的6个月内,灭活的乳腺纤维腺瘤的体积从1.9 cm3缩小至1.3 cm3[16]。而在使用间质激光消融的研究中,吸收周期较长,在6~8年的随访时间里,仍有50 %残留[17]。
现有研究显示,消融后的纤维腺瘤被机体吸收的周期与纤维腺瘤本身的大小有关[14],长径2 cm以内的纤维腺瘤吸收的周期显著缩短。乳腺纤维腺瘤具有不同比例的上皮和间质成分,Littrup等[18]认为,间质成分较丰富的乳腺纤维腺瘤消融后吸收较慢,关于纤维腺瘤成分这一因素对消融后局部转归的影响仍需要后续的探讨。
与应用相对成熟的射频消融(RFA)和冷冻消融相比,微波消融操作简单,并能够产生更高的肿瘤中心温度,且不易受炭化的影响,能够在较短的时间内作用较大的范围,因此获得较高的肿瘤完全灭活率。另外不同于能量分布相对分散的体外高强度聚焦超声和微波聚焦热疗[19],微波消融,靶区精确,能量集中。本实验中,我们选择工作频率2 450 MHz和低输出功率40 W的治疗参数,1 min即可完全灭活实验标本。现有报道中,冷冻消融的治疗时间在6~30 min[12-15],间质激光消融需要20~25 min[17, 21],射频消融需要60~90 min[11],而体外高强度聚焦超声需要45~120 min[16]。微波消融治疗之后由于灭活的肿瘤组织并未被完整切除,因此治疗后的长期随访非常重要。本实验中,超声检查可以清晰地观察到移植组织在兔体内逐渐被吸收,方便测量残存肿块的体积,便于比较。我们认为,使用超声检查观察微波消融治疗后的乳腺纤维腺瘤是可靠的。超声检查价格低廉,没有创伤亦没有放射性危害。超声弹性成像技术可能在微波消融治疗后的随访中发挥独特的作用[22]。超声弹性成像是通过获取组织的硬度或顺应性等物理信息来辅助诊断,正如实验观察,经过微波消融的瞬时高温作用,乳腺纤维腺瘤在治疗后会形成质硬的肿块,并随在体时间的延长逐步变软最后被吸收,这一结果与文献[16-18]报道相符。运用超声弹性成像技术随访,可以补充治疗后组织质地硬度改变的信息,指导转归,值得探讨。
本研究存在以下局限性:①即使非活体移植不会导致宿主的移植排斥反应[7],但不能反映真实的人体环境。标本移植在肌肉内而非乳腺(非妊娠哺乳期的兔乳腺组织菲薄,难以模拟成人乳腺的组织环境)。因为微波消融产生的高温使得靶区内小血管瞬间闭塞,灭活组织主要依靠逐步吸收,因此本模型可以在一定程度上模拟真实情况。②本研究仅设观察组,缺少对照组。③标本在离体环境下进行微波消融,治疗参数的精准性待商榷,周围正常组织在治疗后转归发展中的确切作用也需进一步观察。本实验仅选取了长径1 cm的纤维腺瘤标本,样本量较小。
本研究通过建立非活体移植模型探讨微波消融灭活的乳腺纤维腺瘤的体内情况。体检和超声提示乳腺纤维腺瘤经过微波消融完全灭活后,在体内逐渐被吸收,不遗留硬结,不导致液化。运用微波消融治疗乳腺纤维腺瘤或许可用于临床。未来还需更多的研究探讨微波消融治疗乳腺纤维腺瘤的价值。
[1] Hughes LE, Mansel RE, Webster DJ. Aberrations of normal development and involution (ANDI): a new perspective on pathogenesis and nomenclature of benign breast disorders[J]. Lancet, 1987,2(8571):1316-1319.
[2] Ben HJ, Damak T, Ben SA, et al. Breast carcinoma arising within fibroadenomas. Report of four observations[J]. Tunis Med, 2007,85(10):891-895.
[3] Baker EH, Thompson K, McKillop IH, et al. Operative microwave ablation for hepatocellular carcinoma: a single center retrospective review of 219 patients[J]. J Gastrointest Oncol, 2017,8(2):337-346.
[4] Jiao D, Qian L, Zhang Y, et al. Microwave ablation treatment of liver cancer with 2,450-MHz cooled-shaft antenna: an experimental and clinical study[J]. J Cancer Res Clin Oncol, 2010,136(10):1507-1516.
[5] De Cobelli F, Marra P, Ratti F, et al. Microwave ablation of liver malignancies: comparison of effects and early outcomes of percutaneous and intraoperative approaches with different liver conditions: New advances in interventional oncology: state of the art[J]. Med Oncol, 2017,34(4):49.
[6] Khazaei S, Ayubi E, Nematollahi S, et al. Comment on: Effectiveness of ultrasound-guided percutaneous microwave ablation for symptomatic uterine fibroids: a multicenter study in China[J]. Int J Hyperthermia, 2017,33(6):703.
[7] Ivan M. Roitt免疫学基础(第十版)[M]. 北京:高等教育出版社, 2001.
[8] Zhou W, Ding Q, Liu X, et al. Percutaneous microwave coagulation for eradication of VX2 tumors subcutaneously in rabbits[J]. World J Surg Oncol, 2012,10:97.
[9] Zhou W,Zha X,Liu X,et al.US-guided percutaneous microwave coagulation of small breast cancers: a clinical study[J].Radiology, 2012,263(2):364-373.
[10] Goldberg SN, Gazelle GS, Compton CC, et al. Treatment of intrahepatic malignancy with radiofrequency ablation: radiologic-pathologic correlation[J]. Cancer, 2000,88(11):2452-2463.
[11] Teh HS, Tan SM. Radiofrequency ablation - a new approach to percutaneous eradication of benign breast lumps[J]. Breast J, 2010,16(3):334-336.
[12] Kaufman CS, Bachman B, Littrup PJ, et al. Office-based ultrasound-guided cryoablation of breast fibroadenomas[J]. Am J Surg, 2002,184(5):394-400.
[13] Kaufman CS, Bachman B, Littrup PJ, et al. Cryoablation treatment of benign breast lesions with 12-month follow-up[J]. Am J Surg, 2004,188(4):340-348.
[14] Kaufman CS, Littrup PJ, Freeman-Gibb LA, et al. Office-based cryoablation of breast fibroadenomas with long-term follow-up[J]. Breast J, 2005,11(5):344-350.
[15] Edwards MJ, Broadwater R, Tafra L, et al. Progressive adoption of cryoablative therapy for breast fibroadenoma in community practice[J]. Am J Surg, 2004,188(3):221-224.
[16] Hynynen K, Pomeroy O, Smith DN, et al. MR imaging-guided focused ultrasound surgery of fibroadenomas in the breast: a feasibility study[J]. Radiology, 2001,219(1):176-185.
[17] Dowlatshahi K, Wadhwani S, Alvarado R, et al. Interstitial laser therapy of breast fibroadenomas with 6 and 8 year follow-up[J]. Breast J, 2010,16(1):73-76.
[18] Littrup PJ, Freeman-Gibb L, Andea A, et al. Cryotherapy for breast fibroadenomas[J]. Radiology, 2005,234(1):63-72.
[19] Dooley WC, Vargas HI, Fenn AJ, et al. Focused microwave thermotherapy for preoperative treatment of invasive breast cancer: a review of clinical studies[J]. Ann Surg Oncol, 2010,17(4):1076-1093.
[20] Caleffi M, Filho DD, Borghetti K, et al. Cryoablation of benign breast tumors: evolution of technique and technology[J]. Breast, 2004,13(5):397-407.
[21] Marqa MF, Mordon S, Betrouni N. Laser interstitial thermotherapy of small breast fibroadenomas: numerical simulations[J]. Lasers Surg Med, 2012,44(10):832-839.
[22] Balleyguier C, Ciolovan L, Ammari S, et al. Breast elastography: the technical process and its applications[J]. Diagn Interv Imaging, 2013,94(5):503-513.
Evolutionofmicrowaveablatedbreastfibroadenomainanonviabletransplantationmodel
LIANGMengdi1,HUANGYaoyu1,HUANGHuaxing2,ZHOUWenbin1,XIATiansong1,WANGShui1.
(1.DepartmentofGeneralSurgery,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China; 2.DepartmentofGeneralSurgery,NanjingMedicalUniversity,Nanjing211166,China)
WANGShui,Email:ws0801@hotmail.com
ObjectiveWe sought to evaluate the evolution of microwave ablated breast fibroadenomas in a nonviable transplantation model.MethodsBreast fibroadenoma samples (1 cm) were ablated completely by microwave ablation (MWA) and implanted in the right hind limb of rabbits to simulate the in vivo environment.The clinical outcomes of resolved mass were evaluated via physical examination, ultrasound follow-up and histopathological examination.ResultsNo local side effect and death related to the implantation were observed.Both physical examination and ultrasound follow-up provided information about the progressive absorption of ablated fibroadenomas.The mean volume pretreatment of fibroadenoma samples was (641.1±60.6) mm3.Then, fibroadenoma samples became nonpalpable with an average duration of (11.6±1.5) weeks.The ultrasound follow-up showed that the sample initially showed a hypoechoic mass with clear boundary within the muscle layer.As time went on, the echo enhanced from the periphery, and the volume decreased until it could not be detected with a mean time of (14.0±3.1) weeks.Histopathological examination revealed an area of coagulation necrosis created by MWA and progressively eliminated from the body over time, and inflammatory cells infiltrated from the periphery to the center.ConclusionsSince fibroadenomas treated by MWA can be resorbed smoothly over time without either colliquation or residual mass, MWA of breast fibroadenoma may have a promising cosmetic benefit.Ultrasound can be used effectively in monitoring the evolution of microwave ablated fibroadenoma.
Breast diseases; Fibroadenoma; Microwaves; Ablation techniques; Rabbits; Animals, laboratory
210029 江苏 南京,南京医科大学第一附属医院 普外科(梁梦迪,黄耀禹,周文斌,夏添松,王水);211166 江苏 南京,南京医科大学 外科学总论教研室(黄华兴)
王水,Email: ws0801@hotmail.com
10.3969/j.issn.1674-4136.2017.05.007
1674-4136(2017)05-0300-05
2017-09-01] [本文编辑:李庆]

