胆管黏液腺癌的诊断与治疗
何俊闯 闫宏宪 田建国 康红 王剑明
·论 著·(胆道外科专题)
胆管黏液腺癌的诊断与治疗
何俊闯 闫宏宪 田建国 康红 王剑明
目的分析胆管黏液腺癌的诊断与治疗。方法回顾分析郑州大学人民医院2015年5月至2017年7月收治的6例胆管黏液腺癌病人的临床病理资料,总结其临床病理学特征、诊断及治疗方式,结合国内外文献分析阐述。结果本组6例病人,男性2例,女性4例,年龄38~67岁,平均52.3岁。主要症状为腹痛、发热、黄疸。CT及MRI均提示肝内外胆管不同程度扩张,磁共振胰胆管成像(MRCP)显示肿瘤在高信号的胆汁衬托下呈结节状、乳头状、斑片状等相对低信号表现。6例病人均行手术治疗,术后顺利出院。随访时间1~27个月,中位随访时间18个月,均存活。结论胆管黏液腺癌术前诊断较为困难,MRCP具有明显的优势,根治性手术切除是最有效的治疗手段。
胆管黏液腺癌; 诊断; 治疗
胆管黏液腺癌(mucinous cholangiocarcinoma,MCC)是胆道系统恶性肿瘤中一种少见的病理类型,以肿瘤本身及分泌黏液引起胆道梗阻为主要特征。目前,国内外对该病的报道较少,且多为个案报道,对该病的诊断及手术处理的认识仍有不足。故本研究将郑州大学人民医院肝胆胰腺外科中心2015年5月至2017年7月收治的经病理确诊的6例胆管黏液腺癌病人的临床诊疗过程做一回顾性分析,并复习国内外文献,旨在加强对该病诊疗的认识。现报告如下。
临 床 资 料
一、一般资料及诊断
1.一般资料 本中心近2年来收治病理证实为胆管黏液腺癌6例,占同期经手术治疗胆管癌病人的3.5%(6/167)。本组6例病人中男性2例,女性4例,年龄38~67岁,平均52.3岁。主要症状为腹痛、发热、黄疸,病程为1周至10年。
2.既往病史 例1病人10年前因胆囊结石行腹腔镜胆囊切除术,6年前因胆管结石行胆管切开取石+T管引流术;例2有胆囊结石病史10余年;例5病人8年前Ⅲb型肝门部胆管癌行根治性切除术;例6于7年前先后因胆囊结石行胆囊切除术、胆管结石行胆管切开取石+T管引流术,2年前发现肝占位性病变合并肝左叶胆管-胃瘘,行肝左外叶切除+胃部分切除+胆管探查+T管引流术,术后病理证实为胆管黏液腺癌。(表1)
3.实验室检查 6例病人均合并不同程度的肝功能异常,丙氨酸转氨酶(ALT)58~186 U/L,天冬氨酸转氨酶(AST)55~231 U/L,血清总胆红素(TBIL)27~486 μmol/L,直接胆红素(DBIL)17~400 μmol/L,γ-谷氨酰转移酶(GGT)376~713 U/L,碱性磷酸酶(AKP)237~486 U/L。肿瘤特异性抗原:肿瘤相关抗原19-9(CA19-9)为23~182 kU/L,1例癌胚抗原(CEA)水平升高,甲胎蛋白(AFP)均处于正常范围内。4例白细胞计数升高。余实验室检查结果无特异性改变(表1)。
4.影像学检查 6例病人术前行平扫+动态增强CT均提示不同程度肝内外胆管扩张,胆总管直径1.5~12 cm,CT发现腹腔肿大淋巴结3例。例5病人CT显示胆肠吻合口上段肝总管囊状扩张,动脉期病变强化不明显,内可见稍高密度影(图1A)。例6病人CT显示肝左外叶及胆囊缺如,相应处结构紊乱,见肝左叶片状低密度影,增强扫描未见强化。肝内胆管及胆总管扩张并积气,胆总管内见引流管通向腹外(图2A)。磁共振胰胆管成像(MRCP)均提示不同程度肝内外胆管扩张并异常信号,例5病人胆管内可见结石影(图1B),例6病人见肝总管及左内叶更低信号影(图2B)。经窦道胆道镜探查可见胆管腔内大量胶冻样黏液,胆管上皮肠上皮化生,左肝管起始处腺瘤样组织赘生物突入管腔,左肝管进镜困难。
二、治疗与随访
6例病人均行手术治疗(表2)。
例1病人术中见胆总管直径4 cm,胆管内大量胶冻样黏液,胆管下段可触及3 cm质硬肿物,术中未发现肿大淋巴结。行胰十二指肠切除术,病理证实为胆管黏液腺癌,术后随访27个月,存活。
例2病人术中见肝外胆管直径1.5 cm,胆总管中上段4 cm×3 cm质硬肿块,侵犯胆囊颈部,腹腔可见肿大淋巴结。行胆囊切除+胆管癌切除+肝肠吻合术。术后病理为胆管黏液腺癌,胆囊管旁(12c)淋巴结阳性。随访24个月,存活。
例3病人术中见肝总管左肝管起始处2 cm质硬肿物,侵犯右肝管起始处,左外叶多发转移灶,8、9、12、13a淋巴结肿大,考虑Ⅲb型肝门胆管癌,行左半肝+左尾状叶切除+右前/后胆管成型+肝-肠 (Roux-en-Y)吻合术。术后病理为胆管黏液腺癌,8组淋巴结阳性。随访12个月,复查CT未见复发或转移。
例4病人术中见肝外胆管囊状扩张,12 cm×8 cm,梭形改变,胆管下段腔内可触及质硬多发肿物,位置固定,较大者1.5 cm。行胰十二指肠切除术,术后病理为胆管黏液腺癌,13a组淋巴结阳性。
例5病人术中见原肝-肠吻合口上方胆管囊状扩张,内有含脓液胶冻样黏液及结石数枚,切除原吻合口及囊性病变,右前/后/尾状叶胆管成型后重新行肝胆管-空肠吻合。病理为胆管黏液腺癌(图1C、D);免疫组化:尾型同源转录因子(CDX-2)(-),细胞角蛋白抗原19(CK19)(+),CK20(-),CK7(+),细胞增殖抗原标志物Ki67(+5%),黏蛋白1(Mucin-1)(+),Mucin-2(-),绒毛蛋白(Villin)(+),CEA(+)。术后1个月复查CT未见复发或转移。
例6病人术中见腹腔粘连严重,胆总管直径4 cm,肝左内叶表面凹凸不平,质硬。行左内叶连同肝外胆管切除,肝右前/后叶胆管成型后行肝胆管-空肠吻合。病理为胆管黏液腺癌(图2C、D);免疫组化:CDX-2(+),CK19(+),CK20(部分+),Ki67(+5%),Mucin-1(+),Mucin-2(+),Villin(+),CEA(+)。术后1个月复查未见复发或转移。

表1 6例胆管黏液腺癌病人术前资料
注:TBIL.总胆红素;DBIL.直接胆红素;CA19-9.肿瘤相关抗原19-9
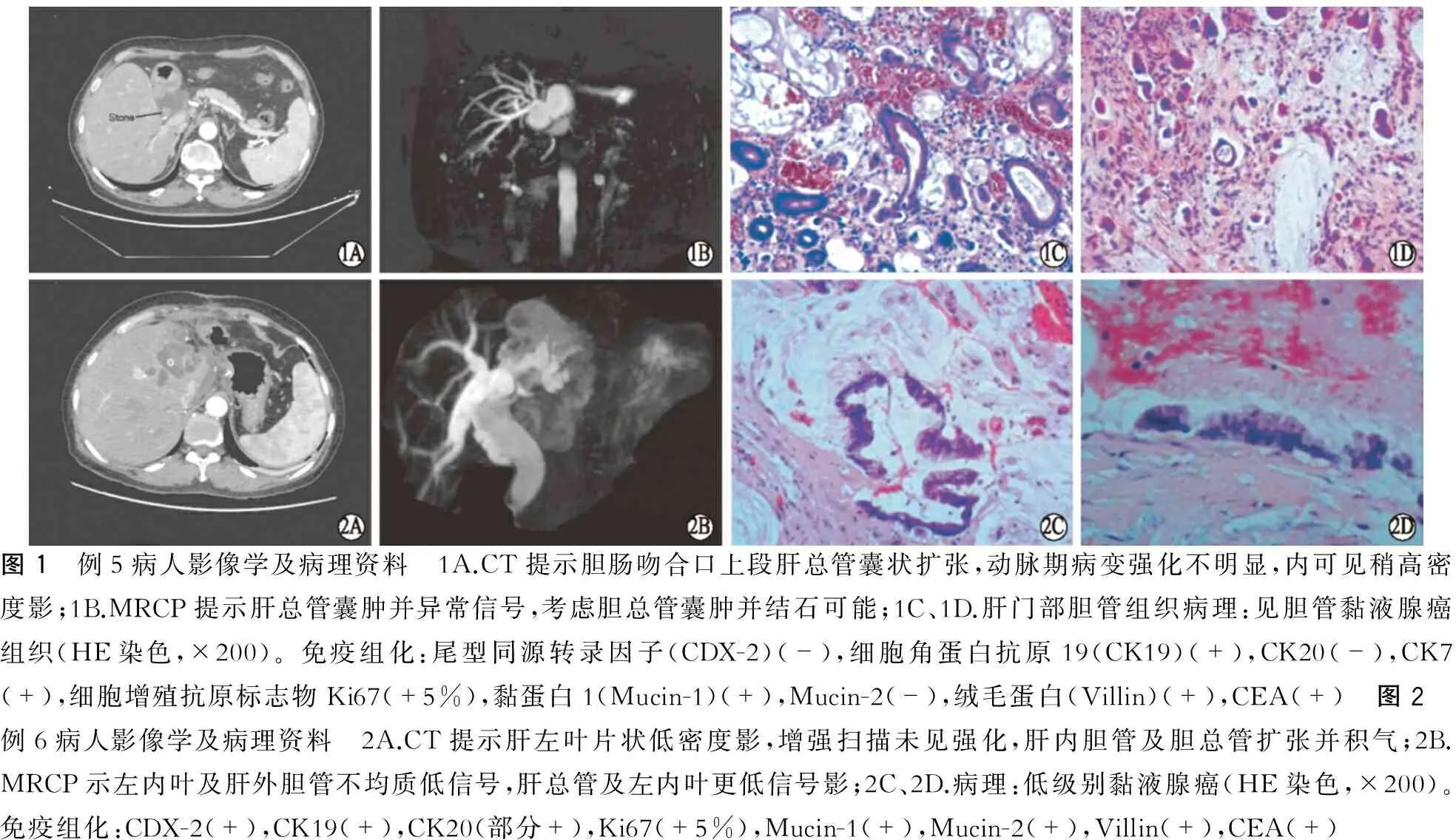
图1 例5病人影像学及病理资料 1A.CT提示胆肠吻合口上段肝总管囊状扩张,动脉期病变强化不明显,内可见稍高密度影;1B.MRCP提示肝总管囊肿并异常信号,考虑胆总管囊肿并结石可能;1C、1D.肝门部胆管组织病理:见胆管黏液腺癌组织(HE染色,×200)。免疫组化:尾型同源转录因子(CDX-2)(-),细胞角蛋白抗原19(CK19)(+),CK20(-),CK7(+),细胞增殖抗原标志物Ki67(+5%),黏蛋白1(Mucin-1)(+),Mucin-2(-),绒毛蛋白(Villin)(+),CEA(+) 图2 例6病人影像学及病理资料 2A.CT提示肝左叶片状低密度影,增强扫描未见强化,肝内胆管及胆总管扩张并积气;2B.MRCP示左内叶及肝外胆管不均质低信号,肝总管及左内叶更低信号影;2C、2D.病理:低级别黏液腺癌(HE染色,×200)。免疫组化:CDX-2(+),CK19(+),CK20(部分+),Ki67(+5%),Mucin-1(+),Mucin-2(+),Villin(+),CEA(+)

表2 6例胆管黏液腺癌病人手术资料
讨 论
胆管黏液腺癌是胆管细胞癌的一种较为罕见的特殊病理类型[1],与其他组织部位的黏液腺癌一样,是以肿瘤组织分泌大量的胞外黏液为特征。胆管黏液腺癌有两种组织学类型,一种表现为腺体扩张、分泌黏液,覆以杯状细胞及轻到中度的核异型性;另一种以大量黏液围绕的小团簇肿瘤细胞为特征,有时两者兼有[2]。有报道称胆管黏液腺癌由胆管内乳头状肿瘤(intraductal papillary neoplasm of the bile duct,IPNB)演变而来[3]。IPNB以突出于胆管腔内的易碎乳头状增生及大量黏液分泌为其病理学特征,与胰腺的导管内乳头状黏液瘤相似。一旦IPNB成侵袭性生长,可转变为管状腺癌或黏液性腺癌。IPNB以肠道表型(Mucin-2+ /Cytokeratin20+)为特征,其演变的胆管管状腺癌或黏液性腺癌可表达Mucin-1[1,3]。本组6例病人Mucin-1均呈阳性表达,Mucin-2/Cytokeratin20阳性者5例,与先前报道一致。
查阅国内外文献发现,胆管黏液腺癌的报道多为中国、日本和韩国等亚洲国家,推测亚洲人种更易罹患此病,可能与该区域胆石症发病率较高有关[1,4]。Zen等[4]报道在因肝内胆管结石行手术治疗的110例病人中发现9例胆管黏液腺癌。本组6例病人中4例合并胆道结石,另外2例病人胆道亦呈慢性炎症改变。有报道称胆道结石与慢性炎症是IPNB[5]及胆管癌[6]发生的高危因素,这个危险因素应该同样适用于胆管黏液腺癌。胆道结石、慢性炎症、蛔虫等因素的慢性刺激,可导致胆管上皮增生、不典型增生,最终导致局部癌变。
与普通胆管腺癌一样,CA19-9与CEA也用于胆管黏液腺癌的诊断。有报道CA19-9水平>100 kU/L时诊断胆管癌的敏感性为53%,而CEA尽管常用于胆管癌的检测,其敏感性与特异性大不如CA19-9[7-8]。本组病人中CA19-9水平>100 kU/L者3例,其对胆管黏液腺癌诊断的敏感性为50%。有报道CEA对胆管黏液腺癌诊断的敏感性为54.5%[1],但本组只有1例(16.7%)病人血CEA水平升高,并伴有病理组织中CEA免疫组化阳性表达,其对胆管黏液腺癌的诊断价值还有待于进一步评估。
影像学检查方面,由于胆管黏液腺癌常合并结石、炎症及胆管纤维化,容易掩盖胆管癌的超声征象;另外,由于病变的范围、程度不同,肿块可能会呈现高回声或低回声及其他异常回声的表现[1,9]。所以,彩超对胆管黏液腺癌诊断的敏感性较差,可作为筛选及术后复查。而胆管黏液腺癌在CT及MRI的表现相对比较一致。在CT上主要表现为病灶周围多个囊性肿块,囊壁厚薄不均,动态增强肿瘤外周可强化或不强化[1,10]。T2W MRI影像上,由于大量黏液的影响,病灶可表现为极强的高信号团块[11]。MRCP显示肿瘤在高信号的胆汁衬托下呈结节状、乳头状、斑片状等相对低信号,部分黏液与胆汁呈现分层征象是胆管黏液腺癌MRCP的特征表现[10]。经内镜逆行胰胆管造影术(ERCP)及经皮经肝胆道引流术(PTCD),因大量黏液对造影剂产生干扰,很难提供对诊断有价值的信息。经皮经肝胆道镜检查(PTCS)可较好地明确梗阻原因并准确定位肿瘤,但可能引起肿瘤沿针道转移这一严重的并发症发生。
胆管黏液腺癌的首选治疗方式仍然是手术治疗。手术方式应该根据病变部位制定“个体化”的手术方案,力争完全切除病灶,建立通畅的胆道引流。对于难以根治性切除或病人身体情况难以耐受手术时,可选择PTCD或经内镜鼻胆管引流术(ENBD)引流胆汁,解除黄疸。本组6例病人术后随访恢复可,未见复发或转移。Sasaki等[12]认为,胆管黏液腺癌与IPNB相比,肿瘤生长更加迅速,更易发生转移,且预后更差。而Zen等[4]在110例因肝内胆管结石手术治疗的病人中发现19例IPNB,其中,病理证实为胆管黏液腺癌9例,均未发现淋巴结转移或远处转移,因此认为,胆管黏液腺癌与其他类型的胆管癌相比,恶性程度较低。施洋等[10]对淋巴结转移组(6例)和无淋巴结转移组(7例)胆管黏液腺癌病人进行生存分析,采用Log-rank法比较两组生存率的差异,结果显示差异有统计学意义(P=0.005),提示无淋巴结转移组的预后显著优于淋巴结转移组。本组6例病人3例出现区域淋巴结转移,1例病人肝左外叶切除后病理证实为胆管黏液腺癌,术后2年复发,再次行手术治疗,目前仍在密切随访中。由于病例数较少的限制,目前对于胆管黏液腺癌的预后分析存在局限性,需进一步研究。
总之,胆管黏液腺癌是胆管癌的一种临床上较为少见的特殊病理类型,缺乏特异性较强的临床症状及实验室检查结果。CT和MRCP是术前诊断的重要影像学依据,最终诊断仍需术中术后病理。根治性手术切除仍是胆管黏液腺癌唯一的有效治疗方式,预后欠佳,术后需密切随访。
1 Sumiyoshi T,Shima Y,Okabayashi T,et al.Mucinous cholangiocarcinoma: Clinicopathological features of the rarest type of cholangiocarcinoma.Ann Gastroenterol Surg,2017.1-8.DOI:10.1002/ags3.12016.
2 Fred TB,Fatima C,Raiph HH,et al.WHO classification of tumors of the digestive system.4th ed.Lyon: International Agency for Research on Cancer,2010.204-213.
3 Zen Y,Fujii T,Itatsu K,et al.Biliary cystic tumors with bile duct communication: a cystic variant of intraductal papillary neoplasm of the bile duct.Mod Pathol,2006,19: 1243-1254.DOI: 10.1038/modpathol.3800643.
4 Zen Y,Sasaki M,Fujii T,et al.Different expression patterns of mucin core proteins and cytokeratins during intrahepatic cholangiocarcinogenesis from biliary intraepithelial neoplasia and intraductal papillary neoplasm of the bile duct--an immunohistochemical study of 110 cases of hepatolithiasis.J Hepatol,2006,44:350-358.DOI: 10.1016/j.jhep.2005.09.025.
5 Chen TC,Nakanuma Y,Zen Y,et al.Intraductal papillary neoplasia of the liver associated with hepatolithiasis.Hepatology,2001,34:651-658.DOI: 10.1053/jhep.2001.28199.
6 Khan SA,Thomas HC,Davidson BR,et al.Cholangiocarcinoma.Lancet,2005,366:1303-1314.DOI: 10.1016/S0140-6736(05) 67530-7.
7 Patel AH,Harnois DM,Klee GG,et al.The utility of CA 19-9 in the diagnoses of cholangiocarcinoma in patients without primary sclerosing cholangitis.Am J Gastroenterol,2000,95:204-207.DOI: 10.1111/j.1572-0241.2000.01685.x.
8 Nehls O,Gregor M,Klump B.Serum and bile markers for cholangiocarcinoma.Semin Liver Dis,2004,24: 139-154.DOI: 10.1055/s-2004-828891.
9 危安,陈红天.超声对胆管黏液腺癌的诊断价值.中国现代医学杂志,2013,23:93-96.DOI: 10.3969/j.issn.1005-8982.2013.24.022.
10施洋,庞书杰,叶庆旺.胆管黏液腺癌13例临床特征和预后分析.上海医学,2016,39:675-679.
11Hayashi M,Matsui O,Ueda K,et al.Imaging findings of mucinous type of cholangiocellular carcinoma.J Comput Assist Tomogr,1996,20:386-389.
12Sasaki M,Nakanuma Y,Shimizu K,et al.Pathological and immunohistochemical findings in a case of mucinous cholangiocarcinoma.Pathol Int,1995,45:781-786.
Diagnosisandtreatmentofmucinouscholangiocarcinoma
HeJunchuang*,YanHongxian,TianJianguo,KangHong,WangJianming.
*DepartmentofHepatobiliaryandPancreaticSurgery,ZhengzhouUniversityPeople’sHospital,Zhengzhou450003,China
WangJianming,Email:wjm18jgm@aliyun.com
ObjectiveTo analyze the diagnosis and treatment of mucinous cholangiocarcinoma (MCC).MethodsA retrospective study was made on the clinicopathological features of 6 MCC patients in Zhengzhou University People's Hospital from May 2015 to July 2017.The clinical and pathological features,diagnosis and treatment of these 6 cases of MCC were summarized,and the relative literatures were reviewed.ResultsThere were 2 males and 4 females with age ranging from 38 to 67 years old (average of 52.3 years old).The common symptoms were abdominal pain,fever and jaundice.Intra- and extra-hepatic bile duct dilation to varying degrees was seen in CT and MRI scans.Nodal,mammillary,plaque relative low signal mass was displayed in MRCP scan.Six patients were discharged after surgery.At a median follow up for 18 months (range 1 to 27 months),all patients survived.ConclusionsThe diagnosis of MCC is very difficult preoperatively.MRCP has obvious advantages compared with other methods.Radical surgical resection is the most effective method for MCC patients.
Mucinous cholangiocarcinoma; Diagnosis; Treatment
450003 郑州,郑州大学人民医院肝胆胰腺外科(何俊闯、闫宏宪、田建国),病理科(康红);华中科技大学同济医学院附属同济医院胆胰外科(王剑明)
王剑明,Email:wjm18jgm@aliyun.com
R735.8
A
10.3969/j.issn.1003-5591.2017.05.005
2017-08-01)

