乌苯美司胶囊对COPD急性加重期患者气道炎症、免疫失衡和肺功能的影响
李秋莉
(徐州市沛县人民医院,徐州 221600)
乌苯美司胶囊对COPD急性加重期患者气道炎症、免疫失衡和肺功能的影响
李秋莉
(徐州市沛县人民医院,徐州 221600)
目的:探讨乌苯美司胶囊对慢性阻塞性肺疾病急性加重期(AECOPD)患者气道炎症、免疫失衡及肺功能的影响。方法:120例AECOPD患者随机分为治疗组与对照组,各60例,对照组采取常规治疗,治疗组在对照组基础上加以乌苯美司胶囊口服,连续用药8周。测定两组治疗前后肺功能、炎症因子、氧化应激反应及免疫功能指标,并观察两组临床疗效及不良反应情况。结果:治疗组治疗总有效率95.00%,比对照组的83.33%差异有统计学意义;与治疗前比较,两组治疗后第1s用力呼气容积(FEV1)、FEV1占预计值百分比(FEV1%)、FEV1/用力肺活量(FVC)、超氧化物歧化酶(SOD)、CD3+、CD4+、CD4+/CD8+均显著上升,血清白介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)、C反应蛋白(CRP)、丙二醛(MDA)、CD8+均显著下降,差异有统计学意义,观察组治疗后上述指标均显著优于对照组;两组不良反应比较无显著差异。结论:乌苯美司胶囊能显著改善AECOPD患者免疫功能,减轻气道炎症反应,促其肺功能明显恢复,安全可行。
慢性阻塞性肺疾病急性加重期;乌苯美司胶囊;炎症;免疫功能;氧化应激
慢性阻塞性肺疾病急性加重期(AECOPD)发病机制尚不明确,可能与炎症反应、氧化应激损伤、免疫功能异常等有关[1-3]。AECOPD典型特征为气道炎症,血清白介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)等炎性因子参与气道炎症反应[4],而机体氧化/抗氧化系统失衡会加重气道炎症反应[5],影响病情,同时免疫功能下降易造成患者肺功能不断恶化。乌苯美司胶囊主要功效为增强机体免疫功能,临床常用于肿瘤辅助用药。目前关于乌苯美司胶囊对AECOPD的治疗效果或作用机制尚无报道。基于此,本研究主要探讨乌苯美司胶囊对AECOPD患者肺功能、气道炎症、氧化应激及免疫功能的影响,旨在为AECOPD日后治疗提供新方向。
1 资料与方法
1.1 一般资料 病例源于我院2015年6月~2017年1月收治的AECOPD患者,入选标准:(1)经临床、X线胸片等检查确诊,符合相关诊断标准[6];(2)肺功能检查显示第1s用力呼气容积(FEV1)/用力肺活量(FVC)70%以下,FEV1占预计值百分比(FEV1%)50%以下;(3)相关资料完整。排除免疫系统疾病、全身严重感染、肝肾功能严重障碍、合并其他肺部疾病、相关药物过敏等患者。最终纳入120例,按照入院先后顺序将其分为治疗组与对照组,各60例。治疗组中男37例,女23例;年龄 50~80(67.85±6.03)岁 ;病程 8~27(15.13±4.25)年;体重48~78(59.26±8.64)kg。对照组中男40例,女20例;年龄47~81(68.02±6.24)岁;病程7~26(14.87±4.13)年;体重49~80(60.01±8.35)kg。两组上述一般资料比较均无显著差异(P>0.05),有可比性。本次研究经院伦理委员会批准,患者均签署知情同意书。
1.2 治疗方法 对照组采取吸氧、按时或按需支气管扩张药物、氨茶碱、祛痰等常规治疗。治疗组在对照组基础上加以乌苯美司胶囊(成都苑东生物制药股份有限公司生产,国药准字H20094031)治疗,10mg/次口服,3次/d,连续用药8周。
1.3 观察指标
1.3.1 肺功能 治疗前、治疗8周后次日通过肺功能仪测定两组患者肺功能相关指标,包括FEV1、FVC、FEV1%等,计算FEV1/FVC。
1.3.2 炎症因子 治疗前、治疗8周后次日清晨空腹抽取两组患者肘静脉血9mL,均分成3份,其中1份用于炎症因子检测。以3000r/min速率离心15min,血清分离后保存于零下80℃冰箱,60min内完成检测。通过酶联免疫吸附法(ELISA)测定血清IL-8、TNF-α及C反应蛋白(CRP)水平,严格按照试剂盒说明书操作。
1.3.3 氧化应激 治疗前、治疗8周后采集的血液标本中第2份用于血清氧化应激指标检测,通过硫代巴比妥比色法测定血清丙二醛(MDA),经由黄嘌呤氧化法测定超氧化物歧化酶(SOD)。
1.3.4 免疫功能 治疗前、治疗8周后采集的血液标本中第3份用于免疫功能测定,通过流式细胞仪测定血清CD3+、CD4+、CD8+水平,计算CD4+/CD8+。此外,观察记录两组用药不良反应情况。
1.4 疗效判定标准 显效:喘息等临床症状体征基本消失;好转:喘息等临床症状体征有所好转;无效:喘息等临床症状体征不变或加重。总有效率=100%-无效率。
1.5 统计学方法 SPSS21.0统计软件处理数据,计数资料以%表示,行χ2检验;计量资料以(±s)表示,行t检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 治疗组治疗总有效率95.00%,对照组治疗总有效率83.33%,两组比较差异有统计学意义(P<0.05),见表1。
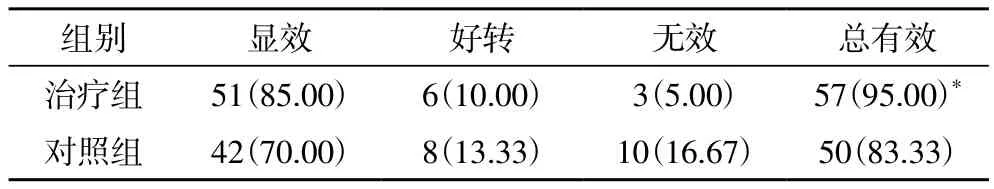
表1 两组临床疗效比较[n(%)]
2.2 肺功能变化 治疗前,两组FEV1、FEV1%、FEV1/FVC比较差异无统计学意义(P>0.05);治疗后,两组FEV1、FEV1%、FEV1/FVC较治疗前均明显上升(P<0.05);治疗组治疗后上述指标均明显大于对照组(P<0.05),见表2。
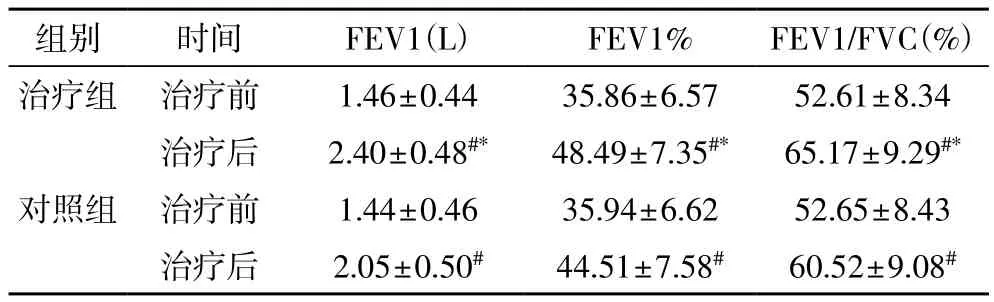
表2 两组治疗前后肺功能指标比较
2.3 炎症因子变化 治疗前,两组血清IL-8、TNF-α、CRP水平比较差异无统计学意义(P>0.05);治疗后,两组血清IL-8、TNF-α、CRP水平比治疗前均明显下降(P<0.05);治疗组治疗后上述指标均明显低于对照组(P<0.05),见表3。
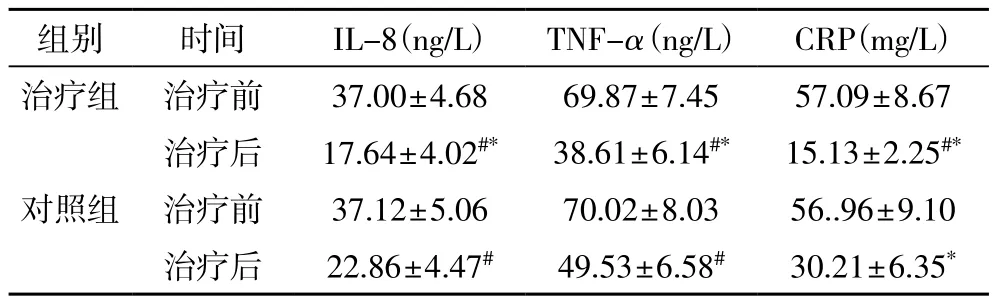
表3 两组治疗前后血清炎症指标比较
2.4 氧化应激变化 治疗前,两组血清MDA、SOD水平比较差异无统计学意义(P>0.05);治疗后,两组MDA比治疗前均明显下降,SOD比治疗前均明显上升,差异有统计学意义(P<0.05);治疗组治疗后MDA水平明显低于、SOD水平明显高于对照组(P<0.05),见表4。

表4 两组治疗前后氧化应激指标比较
2.5 免疫功能变化 治疗前,两组CD3+、CD4+、CD8+、CD4+/CD8+比较差异无统计学意义(P>0.50);治疗后,两组CD3+、CD4+、CD4+/CD8+比治疗前均明显上升,CD8+明显下降,差异有统计学意义(P<0.05);治疗组治疗后上述指标均明显优于对照组(P<0.05),见表5。

表5 两组治疗前后免疫功能指标比较
2.6 不良反应情况 治疗组出现恶心呕吐等消化道反应3例,头痛1例;对照组出现恶心呕吐、面部潮红各2例,均无需特殊处理,停药后均自行好转。两组不良反应发生率比较差异无统计学意义(P>0.05)。
3 讨论
COPD典型特征为气流持续受限,患者肺功能有所下降,易反复发作,除了对患者生活质量造成不同程度的影响外,严重时甚至导致患者死亡。AECOPD主要由反复感染引起,气道黏膜分泌物进一步增多,致使部分气道持续高反应,加重肺功能损伤。目前临床公认肺功能为评价气流持续受限“金标准”,支气管扩张剂吸入后FEV1/FVC仍在70%以下提示气流持续受限,FEV1%则能有效反映气流受限严重程度。
COPD发病机制尚不清楚,多认为与炎症反应密切相关[7]。IL-8、TNF-α等炎性因子大量释放对血小板激活因子、白三烯等刺激,促使其合成,进而导致气道炎症,致使气道处于高反应状态,对机体肺功能造成不同程度的影响[8]。IL-8作为细胞趋化因子中一员,可趋化聚集中性粒细胞,且能增强T细胞活性,影响机体免疫功能,加重呼吸道炎症反应。TNF-α在多种炎症反应、免疫反应中发挥重要作用,对IL-8诱导以共同加快炎性细胞浸润,引发炎症反应,同时可激活超敏C反应蛋白,促AECOPD发病。有文献[9-10]表明IL-8、TNF-α参与COPD气道炎症全过程,为此笔者选择IL-8、TNF-α、CRP作为气道炎症反映指标。临床发现肺组织慢性损伤除了与气道炎症有关外,氧化/抗氧化失衡也对其影响。SOD主要用于机体酶类抗氧化能力反映,MDA水平对机体氧化应激水平直接反映。AECOPD发病后血清MDA水平显著上升,SOD水平显著下降,即机体氧化/抗氧化失衡发生,进一步上调促炎因子表达,加重患者气道炎症反应。此外,AECOPD患者多发生免疫功能下降,表现为CD4+、CD4+/CD8+表达下降,CD8+表达上升,且机体免疫功能与炎性反应、氧化应激损伤等密切相关[11]。
乌苯美司胶囊属于免疫调节剂,主要由链霉菌属培养液分离而出,通过对氨肽酶B、亮氨酸肽酶竞争性抑制可增强T细胞功能,提高NK细胞杀伤能力。乌苯美司胶囊是目前临床唯一一个CD13拮抗剂,能全面阻断多种肿瘤细胞发生、进展,对降低肿瘤转移及复发率有重要作用[12]。同时该药物不良反应少,口服方便,近年来在骨髓瘤、肿瘤等治疗中应用报道较多[13-14]。动物实验发现乌苯美司能显著增强巨噬细胞吞噬能力及免疫细胞功能[15]。本研究结果显示相比常规治疗,加以乌苯美司胶囊治疗后AECOPD患者肺功能及免疫功能改善更明显,气道炎症能更好的被抑制,氧化应激损伤减轻更显著,分析其原因可能与乌苯美司能显著增强机体细胞免疫功能,促T淋巴细胞平衡恢复等有关。由于目前关于乌苯美司治疗AECOPD相关报道无,为此关于其是否可作为SECOPD治疗新方向有待进一步研究证实。
综上所述,乌苯美司胶囊治疗AECOPD疗效明确,能明显抑制气道炎症反应,减轻氧化应激损伤,这可能与乌苯美司胶囊显著改善机体细胞免疫功能有关。
[1] 林振怀, 孙砚诚, 王永仓, 等. 沙美特罗替卡松对慢性阻塞性肺疾病急性发作血清炎性因子的影响及疗效观察[J]. 解放军医药杂志,2015, 27(2): 66-68.
[2] 李瑜, 杨浩军. 依达拉奉对 COPD 急性加重患者血清性介质、氧化应激及肺功能的影响[J]. 湖南师范大学学报 (医学版), 2016, 13(2):42-45.
[3] 段玉香, 范晔, 杨海峰, 等. 慢性阻塞性肺疾病急性加重期患者肺部真菌感染对血清炎症因子的影响[J]. 中华医院感染学杂志,2017, 27(4): 754-757.
[4] 程艳慧, 张勇, 何东初, 等. COPD患者血清IL-4、IL-8、TNF-α、CC16水平变化与气道炎症损伤的探讨[J]. 临床肺科杂志, 2010,15(5): 661-663.
[5] Yao H, Rahman I. Current concepts on oxidative/carbonyl stress,inflammati-on and epigenetics in pathogenesis of chronic obstructive pulmonary disease[J]. Toxicol Appl Pharmacol, 2011, 254(2): 72-85.
[6] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南 (2013年修订版) [J]. 中华结核和呼吸杂志, 2013,36(4): 255-264.
[7] Ruxandra U, Antoniu SA, Mihaltan F, et al. Efficacy of indacaterol as a single therapy versus salmeterol/ fl uticasone the rapy in patients with milder c-hronic obstructive pulmonary disease[J]. Expert Opin Pharmacother, 2015, 16(10): 1539-1541.
[8] 胡娟. 可必特雾化吸入治疗慢性阻塞性肺疾病急性加重期患者的疗效[J]. 医学临床研究, 2013, 30(12): 2422-2423, 2424.
[9] 开赛尔·艾则孜, 肖开提·买买提依明, 杨晓红, 等. 氨溴索对 AECOPD 患者肺功能、氧化应激和炎症因子的影响[J]. 海南医学院学报, 2016, 22(8): 754-757.
[10] 路东明, 宗晓福, 张文娟, 等. 血清炎症因子与慢阻肺急性加重期肺功能的相关性[J]. 临床肺科杂志, 2015, 20(11): 2067-2069.
[11] 熊金梦, 毛科稀, 叶旭军, 等. 辅助性T细胞与慢性阻塞性肺疾病的研究进展[J]. 临床内科杂志, 2016, 33(8): 574-576.
[12] Van Hensbergen Y, Broxterman HJ, Rana S, et al. Reduced growth,increased v-ascular area, and reduced response to cisplatin in CD13-overexpressing human ovarian cancer xenografts[J]. Clin Cancer Res,2004, 10(3): 1180-1191.
[13] 薛华华. 乌苯美司联合沙利度胺治疗难治复发性多发性骨髓瘤的可行性分析[J]. 中国基层医药, 2013, 20(8): 1197-1198.
[14] 麦泽锋. 乌苯美司联合紫杉醇与顺铂方案治疗晚期非小细胞肺癌的临床疗效及对免疫功能的影响[J]. 中国老年学杂志, 2016,36(15): 3731-3733.
[15] 董小剑, 刘春亮, 戈梅, 等. 乌苯美司对小鼠免疫细胞功能的影响[J]. 中国临床药理学杂志, 2014, 30(7): 607-610, 614.
Effect of Ubenimex Capsules on airway inflammation, immune imbalance and pulmonary function in patients with AECOPD
Li Qiu-li
(Peixian People’s Hospital of Xuzhou, Xuzhou 221600, China)
ObjectiveTo investigate the effect of Ubenimex Capsules on airway inflammation, immune imbalance and pulmonary function in patients with acute exacerbation of chronic obstructive pulmonary disease (AECOPD).MethodsA total of 120 patients with AECOPD were randomly divided into the treatment group and the control group, 60 cases in each group. The control group
routine treatment, while the treatment group was treated with oral Ubenimex Capsules on the basis of treatment in the control group. All patients were treated continuously for 8 weeks. The pulmonary function, inflammatory factors, oxidative stress reactions and immune function indexes in the two groups were determined before and after treatment, and the clinical efficacy and adverse reactions were observed.ResultsThe total effective rate of treatment in the treatment group was higher than that in the control group (95.00% vs. 83.33%). After the treatment, the forced expiratory volume in 1s (FEV1),the percentage of FEV1 in predicted value (FEV1%), FEV1/ forced vital capacity (FVC), superoxide dismutase (SOD), CD3+,CD4+ and CD4+/CD8+ increased significantly, while serum interleukin -8(IL-8), tumor necrosis factor α (TNF- α), C reactive protein (CRP), malondialdehyde (MDA) and CD8+ decreased significantly in the two groups, and the above indexes were significantly better in the observation group than in the control group. There was no significant difference in adverse reactions between the two groups.ConclusionUbenimex Capsules can significantly improve the immune function, reduce airway inflammation and promote the recovery of lung function in patients with AECOPD, safe and feasible.
acute exacerbation of chronic obstructive pulmonary disease; ubenimex capsules; inflammation; immune function; oxidative stress
R255
A
1673-016X(2017)06-0186-04
2017-09-02
李秋莉,E-mail:ziyike1001@163.com

