MiR-148a-3p靶基因的预测与验证
唐雪梅,彭小宁
(湖南师范大学医学院,长沙 410013)
MiR-148a-3p靶基因的预测与验证
唐雪梅,彭小宁
(湖南师范大学医学院,长沙 410013)
目的:预测和验证miR-148a-3p的靶基因。方法:利用生物信息学方法预测miR-148a-3p的靶基因;在神经胶质瘤细胞U87/U251中建立miR-148a过表达及抑制表达稳定细胞系。利用qPCR实验验证miR-148a-3p与靶基因的靶向关系;利用Western Blot实验检测靶蛋白表达水平。结果:生物信息学方法预测结果显示dynein light chain LC8-type 2(DYNLL2)为miR-148a-3p靶基因之一;qPCR实验结果显示DYNLL2在神经胶质细胞HA1800与神经胶质瘤细胞U87/U251中的表达有差异,在神经胶质瘤细胞miR-148a过表达及抑制表达的细胞中表达有差异;Western Blot实验结果显示DYNLL2的蛋白表达水平在神经胶质细胞HA1800与胶质瘤细胞U87/U251中有差异。结论:miR-148a-3p与DYNLL2有确切的靶向关系,DYNLL2在神经胶质细胞与胶质瘤细胞中均有表达,与正常胶质细胞相比,DYNLL2在神经胶质瘤细胞中表达下调,包括基因水平和蛋白水平,miR-148a-3p能够负向调控DYNLL2的表达。
微小RNA;miR-148a-3p;DYNLL2
微小RNA(microRNA,miRNA)是一类长度为18~24个核苷酸的内源性非编码小分子单链RNA。通过完全或不完全互补结合靶mRNA3’UTR,在转录后水平上对靶基因表达水平进行调控。有研究表明多种miRNAs参与调控神经胶质瘤的发生发展,其中包括高表达的mir-148a[1]。本课题组前期研究发现,在神经胶质母瘤组织及细胞中miR-148a-3p的表达水平明显高于正常神经胶质组织及细胞,mir-148a在神经胶质母细胞瘤中作为负性风险因子存在,高表达的mir-148a促进胶质母细胞瘤的恶性化进程的演变,且与胶质母细胞瘤患者生存率呈负向相关性。寻找mir-148a-3p的靶基因能够深入揭示mir-148a-3p在神经胶质母细胞瘤发病中的调控机制。
1 材料与方法
1.1 材料 人正常的神经胶质细胞HA1800,人脑胶质细胞瘤细胞系U87、U251来源于广州吉妮欧生物科技公司,DMEM培养基、胎牛血清、0.25%胰酶、DMSO来自美国HyCone公司,氯仿、异丙醇、无水乙醇、二甲苯、TRIzol试剂来自南京化学试剂有限公司,逆转录试剂盒来自美国Thermo Fisher公司,实时PCR荧光检测试剂盒来自南京诺唯赞生物公司,DYNLL2引物、GAPDH引物来自上海生工生物工程有限公司,鼠抗人DYNLL2单克隆抗体来自Abnov公司,鼠抗人GAPDH1单克隆抗体、HRP标记羊抗鼠二抗均为南京诺唯赞生物公司产品。
1.2 方法
1.2.1 miR-148a-3p靶基因的预测 利用miRanda、TargetScan、miRBase三个专业数据库对miR-148a-3p的靶基因进行预测。
1.2.2 细胞培养 HA1800细胞培养条件:含10%胎牛血清的低糖DMEM培养基,环境温度控制在37℃,二氧化碳浓度控制在5%,U87、U251细胞培养条件:含10%胎牛血清的高糖DMEM培养基,环境温度控制在37℃,二氧化碳浓度控制在5%。
1.2.3 实时荧光定量PCR实验
1.2.3.1 细胞总RNA的提取 将生长状态良好的细胞培养至铺满培养瓶底部时,用PBS洗涤2次,按每25cm²瓶底面积加入1mlTRIzol试剂,室温保存10min后反复吹打培养瓶底部,让细胞充分裂解。将细胞溶解液转移至RNA-free1.5ml离心管中,按0.2ml/1mlTRIzol的比例加入氯仿,剧烈震荡15s,充分混匀液体,室温放置3~5min,在4℃、12000rpm环境下离心20min,去上层透明水相移至新RNA-free1.5ml离心管中,加入500μl异丙醇沉淀RNA,室温静置10min,在4℃、12000rpm环境下离心5min,弃去上层液体,室温干燥3~5min,用适量RNA-free水溶解RNA。取1μlRNA在1%琼脂糖凝胶中进行电泳,紫外灯下分析RNA有无发生降解。用分光光度计测定A260和A280的值,计算RNA浓度、A260/A280比值。
1.2.3.2 miRNA逆转录生成cDNA 取A260/A280比值≥1.8的RNA5μg,进行逆转录,反应体系如下:得到cDNA,进行PCR实验。

组分 体积总RNA 5μg Bulge-loop miRNA RT 引物 1μl ddH2O to 12μl 12μl 65℃ 5min
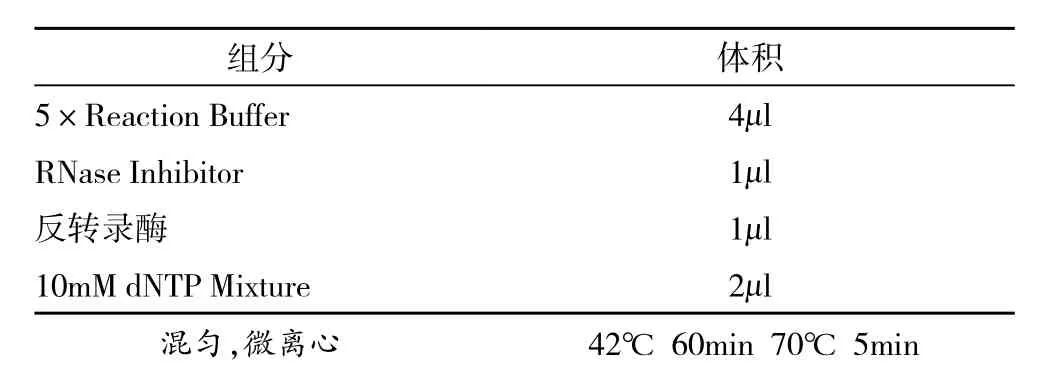
组分 体积5×Reaction Buffer 4μl RNase Inhibitor 1μl反转录酶 1μl 10mM dNTP Mixture 2μl混匀,微离心 42℃ 60min 70℃ 5min
1.2.3.3 荧光定量PCR 将逆转录的cDNA进行荧光定量PCR反应体系如下:
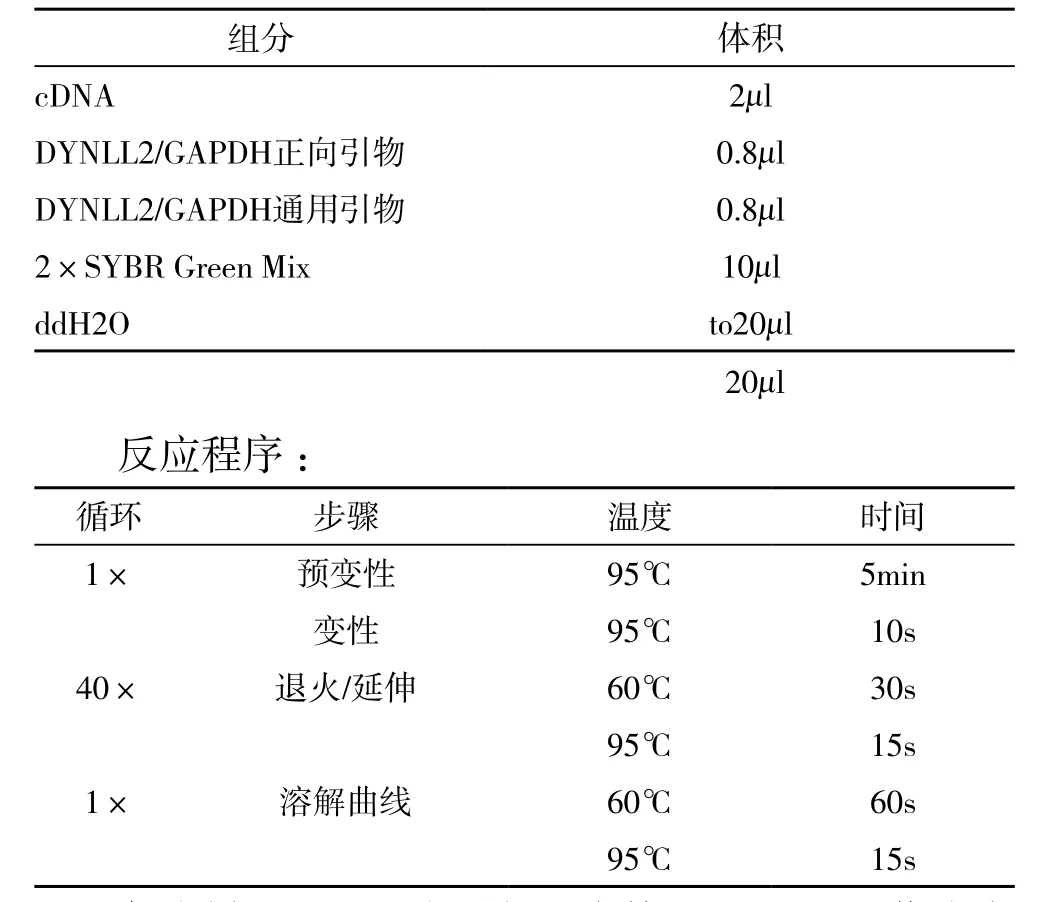
组分 体积c D N A 2 μ l D Y N L L 2/G A P D H正向引物 0.8 μ l D Y N L L 2/G A P D H通用引物 0.8 μ l 2×S Y B R G r e e n M i x 1 0 μ l d d H 2 O t o 2 0 μ l 2 0 μ l反应程序:循环 步骤 温度 时间1× 预变性 9 5℃ 5 m i n变性 9 5℃ 1 0 s 4 0× 退火/延伸 6 0℃ 3 0 s 9 5℃ 1 5 s 1× 溶解曲线 6 0℃ 6 0 s 9 5℃ 1 5 s
每个样品设置3个平行反应管,以GAPDH作为内参,重复试验3次。
在Bio-Rad CFX96Real-time PCR仪上完成PCR反应,根据计算DYNLL2与内参GAPDH的Cq值,计算DYNLL的△Cq值,再通过与对照组的DYNLL2的△Cq值相比较,计算出△△Cq值,求得DYNLL2在模板中的相对表达量。计算公式如下:
△△Cq=(Cqdynll2-CqGAPDH)神经胶质瘤-(Cqdynll2-CqGAPDH)神经胶质细胞
1.2.4 Western Blot检测DYNLL2的蛋白表达水平
1.2.4.1 蛋白样品的制备 将实验所需的人神经胶质细胞系,神经胶质瘤细胞系用PBS洗涤2次,弃去PBS后用0.25%的胰酶消化5min,使细胞从培养瓶底部脱落,将悬液转移至1.5ml的EP管中,4℃、12000rpm离心5min,除去上清液体,再次用PBS洗涤2次,4℃、12000rpm离心5min,弃上清,加入适量的细胞裂解液(裂解液:PMSF=100:1),在-80℃与室温环境中交替反复冻融3次,置于4℃、12000rpm离心15min,取上清并移至新的EP管中。
1.2.4.2 蛋白定量(BCA法蛋白定量) 用碧云天公司BCA蛋白定量试剂盒,根据说明书准备样品,取4.4ml蛋白标准配制液加入到120mgBSA中,配成浓度为25ug/μl的蛋白标准品。0.98ml稀释液加 0.02ml25ug/μl蛋白标准品配成0.5ug/μl的蛋白标准品。按照A液:B液=50:1的比例配制BCA工作液,在96孔板中加入200μl/孔的BCA工作液,然后在前8个孔中分别加入浓度为 0.5mg/ml的标准品 20μl、16μl、12μl、8μl、4μl、2μl、1μl、0μl,不足 20μl的孔用不含 PMSF 的细胞裂解液补足,每个样品设置三个重复对照。根据不同量的标准品的OD值来绘制标准曲线。剩余的96孔板中依次加入待测样品5μl,不足20μl的孔用不含PMSF的细胞裂解液补足。将待测版放入37℃的恒温箱孵育30min。用酶标仪测定A562的吸光度。根据OD值绘制标准曲线,得出标准方程,计算样品蛋白浓度。
1.2.4.3 SDS-PAGE电泳 取1.5mm厚制胶玻璃板,安装好玻璃板,配制浓缩胶与分离胶,浸泡于电泳液中,电泳液充满齿孔。20μg取相应体积的蛋白样品,加入1/4体积的5×SDS Loading Buffer,97℃变性8min,微离心30s。在1.5mm、10%SDS聚丙烯酰胺凝胶齿孔中加入蛋白样品和26616蛋白Marker,在200V,30mA条件下进行电泳。
1.2.4.4 转膜 将PVDF膜浸泡在浓度为100%的甲醇溶液中进行活化,放入预冷的转膜液中浸泡待用。在预冷的转膜液中准备转膜夹,由负极到正极依次放置毛毡、滤纸、PAGE凝胶、PADF膜、滤纸、毛毡。转膜夹放于半干电转仪槽中在600V、200Ma,冰浴条件下转膜。
1.2.4.5 封闭孵育抗体 转膜成功后,用TBS-T漂洗PVDF膜2次,用5%脱脂奶粉封闭,室温摇床孵育1-2h。封闭后用TBS-T漂洗PVDF膜2次,DYNLL2(1:1000稀释)、GAPDH(1:10000稀释)一抗,4℃孵育过夜。隔日将膜在室温条件下孵育30min,TBS-T洗膜3次,用标有辣根过氧化物酶的G-M二抗(1:10000稀释)室温孵育1-1.5h。TBS-T洗膜3次。
1.2.4.6 显影 ECL发光检测,拍摄图片,使用ImageJ软件分析灰度值。
1.2.5 统计学方法 利用SPSS16.0软件进行统计学分析,以均数±标准差表示实验数据。两样本均数的比较采用t检验,多组样本的比较采用Kruskal-Wallis Test分析;P<0.05表示有统计学差异。
2 结果
2.1 miR-148a-3p靶基因预测 利用三种靶基因预测网站对miR-148a-3p的靶基因进行预测并筛选,筛选至少两个网站同时预测出来,分值较高的靶基因最后圈定DYNLL2.通过TargetScan预测mir-148a与靶基因DYNLL2之间可能的结合位点见图1
2.2 qPCR验证结果 DYNLL2在正常神经胶质细胞中的表达明显高于在神经胶质瘤细胞中的表达,见图2差异有统计学意义(P<0.05)。DYNLL2在神经胶质瘤细胞系miR-148a过表达组中的表达量明显低于对照组中的表达,见图3差异有统计学意义(P<0.05)。DYNLL2在神经胶质瘤细胞系miR-148a抑制表达组中的表达量明显高于对照组中的表达,见图4差异有统计学意义(P<0.05)。
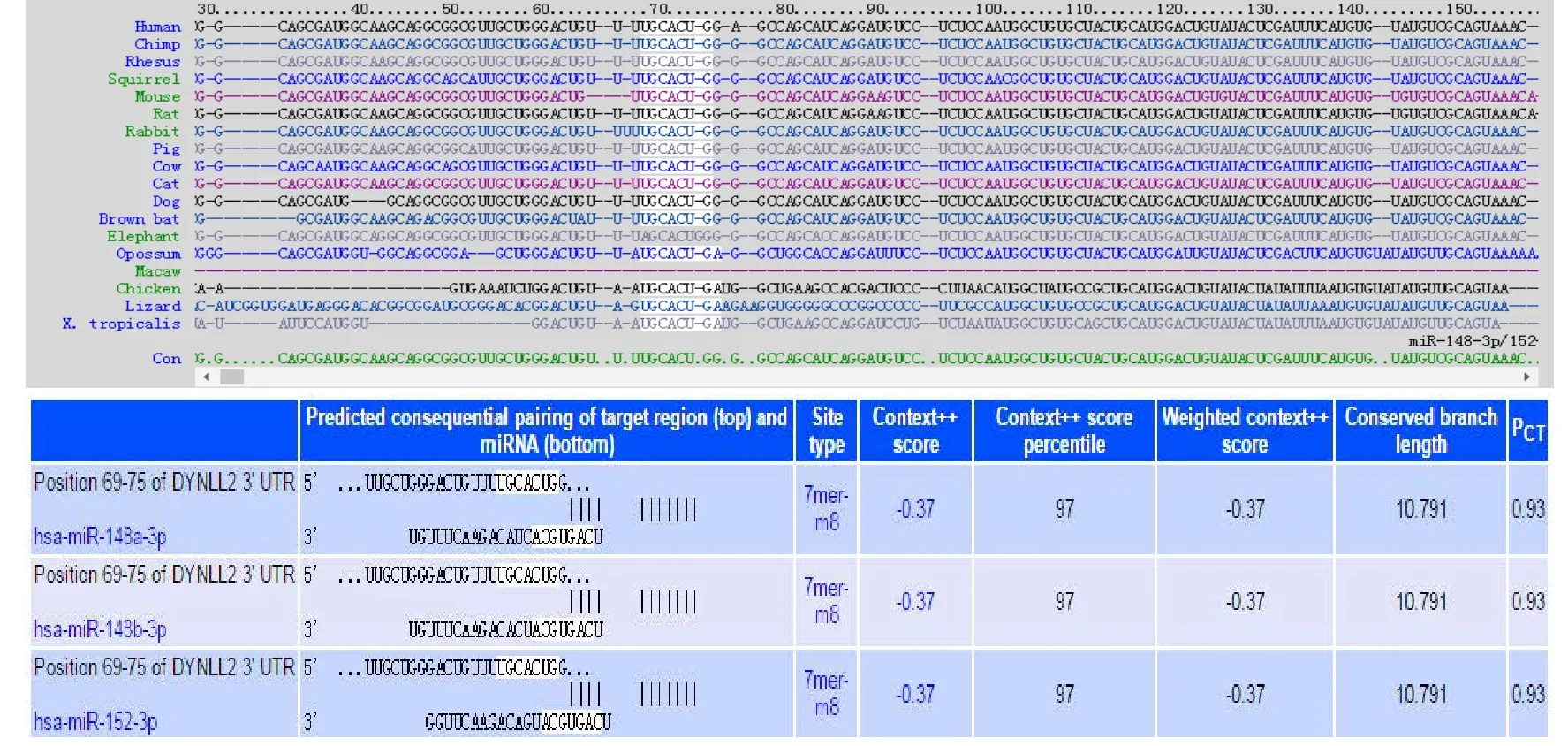
图1 TargetScan预测mir-148a与靶基因DYNLL2之间可能的结合位点
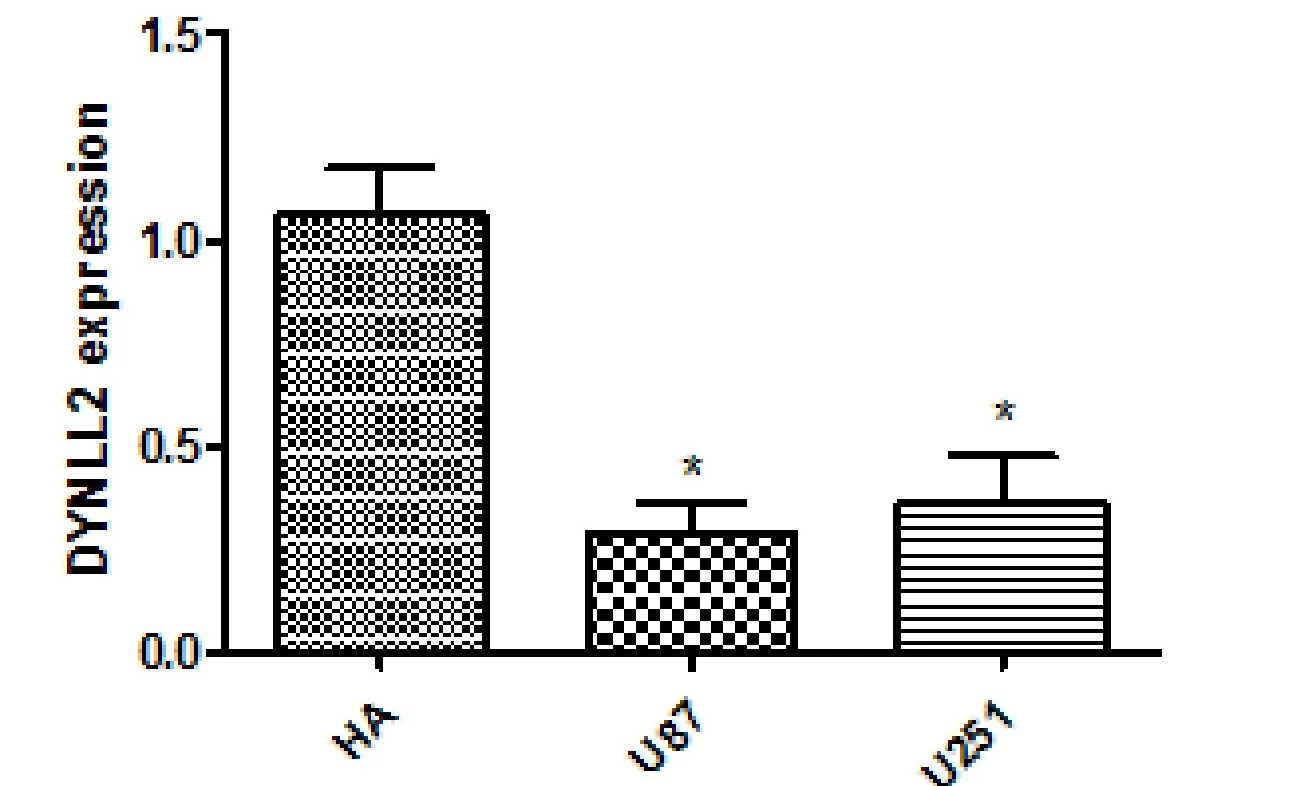
图2 DYNLL2在神经胶质细胞HA1800与神经胶质瘤细胞系U87,U251中的表达
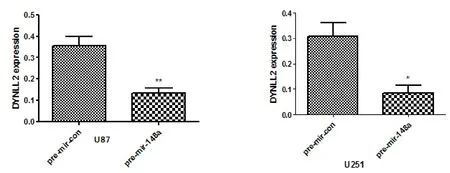
图3 DYNLL2在神经胶质瘤细胞系miR-148a过表达组与对照组中的表达(P<0.05)
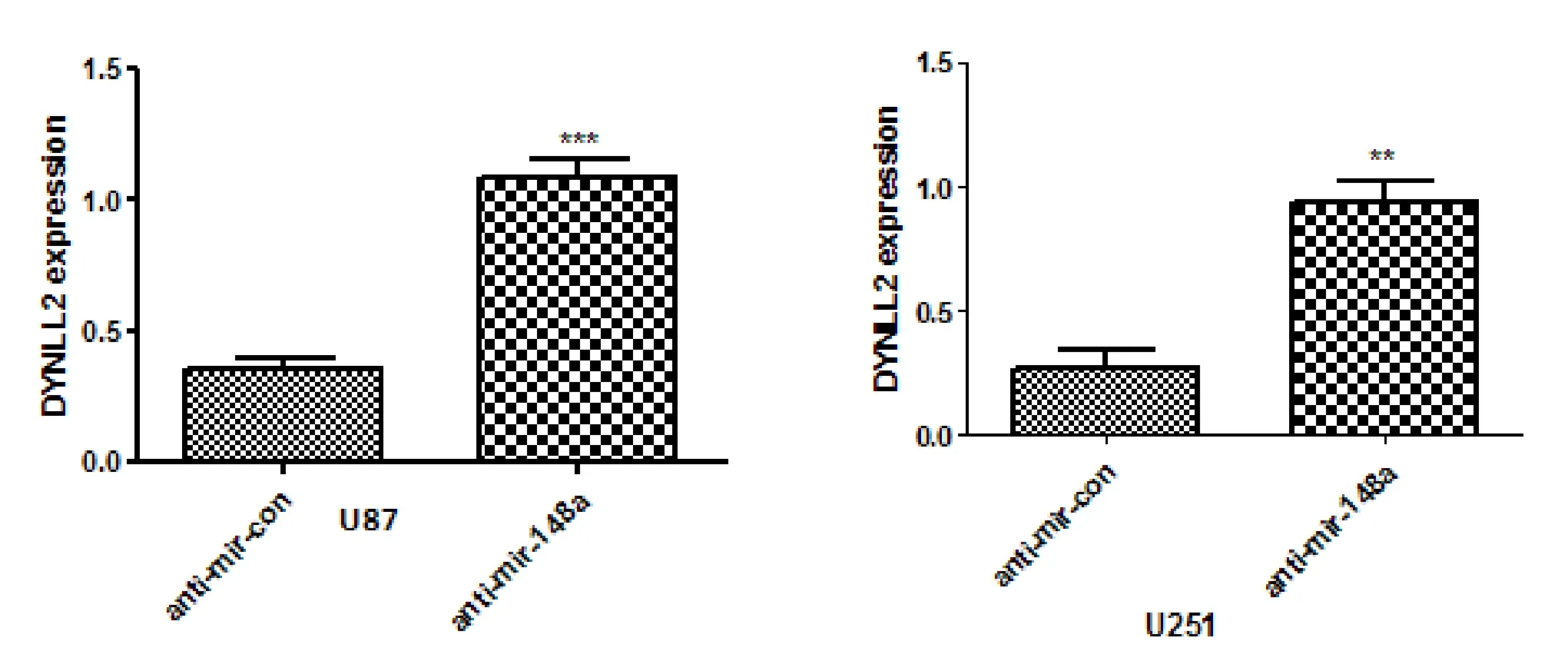
图4 DYNLL2在神经胶质瘤细胞系miR-148a抑制表达组与对照组中的表达(P<0.05)
2.3 Western Blot检测DYNLL2的蛋白表达水平结果
DYNLL2的蛋白水平在正常角质细胞中的表达量高于胶质瘤细胞系中的表达。各胶质瘤细胞组与HA1800正常对照组之间的表达差异具有统计学意义(P<0.05),见图5.

图5 DYNLL2的蛋白在神经胶质细胞与胶质瘤细胞系中的表达(P<0.05)
3 讨论
MiRNA通过碱基互补配对的方式识别靶基因的3’UTR区,并根据互补程度的不同指导沉默复合体降解靶mRNA或者阻遏靶mRNA的翻译,miRNA与其靶基因之间形成的复杂网络参与调控miRNA生物学功能,近年来研究miRNA与其靶基因之间的相互关系已经成为一个热点,也是疾病发生机制研究的关键因素。miRNA可以调控多个靶基因,一个靶基因也可以受多个miRNA的调控[2]。研究一个基因是否是某个miRNA的靶基因通常会选用生物信息学方法,对该靶基因进行预测分析,利用生物信息学找寻miRNA靶基因是现阶段最基本,最快速的手段之一,目前我们常用的生物信息学预测软件包括miRanda、miRBase、TargetScan等。
Mir-148a是mir-148/mir-152家族成员之一,其茎环结构序列位于7号染色体负链上,共计68个核苷酸序列,通过调控不同的基因表达在多种肿瘤的发生发展中发挥重要作用。Mir-148a通过调控下游靶基因从而影响肿瘤生物学特征,有文献报道,mir-148a通过抑制P27的表达促进胃癌细胞AGS、SGC-7901、BGC-823的增殖[3]。我们应用 miRBase、TargetScan 和 miRanda3种网站预测软件对 miR-148a-3p的靶基因进行了预测,综合分析,最终选择DYNLL2作为 miR-148a-3p的候选靶基因进行研究,并对该预测结果进行验证,从而确定miR-148a与该基因的关系。DYNLL2(dynein light chain LC8-type 2)基因位于染色体17q22区域。cDNA为 1522bp(NM_080677.2)。DYNLL2 基因又称做 Dlc2、DNCL1B、RSPH22,属于SAPAP家族。DYNLL2富含于肌肉组织中,其定位于细胞膜。有研究表明DYNLL2位于细胞骨架,可能与其他蛋白形成蛋白复合体参与人体的免疫调节等[4]。Manneville等研究发现骨架蛋白 DYNLL2 能够与 DLG4[5]、DLGAP1[6]、C12orf40[7]、MY05A[8]、BMF[9]共同调控靠近细胞皮层的微管动力学、微管形成,同时DYNLL2与DYNLL1都作为蛋白质动力蛋白相互作用,参与调节微管泡和细胞器的功能,改变和维持细胞骨架的结构和空间分布,改变基底细胞皮质层微管动力学和结构,进而促使中心体的定位和细胞极性的改变[10,11]。
我们应用实时荧光定量PCR与蛋白印迹实验对预测结果进行基因表达水平与蛋白表达水平的验证,得到了一致的结果,并且通过构建mir-148a过表达稳定细胞系(pre-mir-148a)以及mir-148a抑制表达稳定细胞系(anti-mir--148a),应用实时荧光定量PCR分别验证两组稳定细胞系与对照组的基因表达量,我们发现DYNLL2的基因表达量在mir-148a过表达的细胞系中表达明显受到抑制,而在mir-148a抑制表达组中DYNLL2的表达明显高于对照组,说明mir-148a对于DYNLL2基因的表达起到了抑制作用。蛋白印迹实验同样发现,与正常神经胶质细胞中的DYNLL2蛋白表达量相比,DYNLL2在神经胶质瘤细胞中的蛋白表达明显下调.q-PCR及蛋白印迹实验均表明mir-148a对于DYNLL2的表达起到了调控作用,结合生物学预测软件及相应的生物分子学实验我们可以相信,DYNLL2是受mir-148a调控的的一个靶基因,并且DYNLL2的表达量与mir-148a的表达量呈负相关关系。
[1] Dykxhoorn, D. M. MicroRNAs and metastasis: little RNAs go a long way[J]. Cancer Res, 2010,70(16): 6401-6.
[2] Zhang, J. Dysregulation of microRNA biosynthesis enzyme Dicer plays an important role in gastric cancer progression[J]. Int J Clin Exp Pathol,2014,7(4): p.1702-7.
[3] Lee, R. C. , R. L. Feinbaum, V. Ambros. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell, 1993,75(5): 843-54.
[4] Pfister, K. K. , et al. , Cytoplasmic dynein nomenclature[J]. J Cell Biol,2005,171(3): 411-3.
[5] Moutin, E. The stoichiometry of scaffold complexes in living neurons- DLC2 functions as a dimerization engine for GKAP[J]. J Cell Sci,2014,127(Pt 16): 3451-62.
[6] Naisbitt, S. Interaction of the postsynaptic density-95/guanylate kinase domain-associated protein complex with a light chain of myosin-V and dynein[J]. J Neurosci, 2000,20(12): 4524-34.
[7] Rolland, T. A proteome-scale map of the human interactome network.Cell, 2014,159(5): 1212-26.
[8] Puthalakath, H. Bmf: a proapoptotic BH3-only protein regulated by interaction with the myosin V actin motor complex, activated by anoikis[J].Science, 2001,293(5536): 1829-32.
[9] Day, C. L. Localization of dynein light chains 1 and 2 and their pro-a poptotic ligands[J]. Biochem J, 2004,377(Pt 3): 597-605.
[10] Moutin, E. GKAP-DLC2 interaction organizes the postsynaptic scaffold complex to enhance synaptic NMDA receptor activity[J]. J Cell Sci,2012,125(Pt 8): 030-40.
[11] Bodor, A. DYNLL2 dynein light chain binds to an extended linear motif of myosin 5a tail that has structural plasticity[J]. Biochemistry,2014,53(45): 7107-22.
Prediction and Verification of MiR-148a-3p Target Gene
Tang Xue-mei, Peng Xiao-ning
(Medical College,Hunan Normal University, Changsha 410013, China)
ObjectiveTo predict and verify the target gene of miR-148a-3p.MethodsThe putative target genes of miR-148a-3p were predicted by bioinformatics approach. Establishment of miR-148a overexpression and suppression of stable expression in glioma cell line U87/U251. QPCR experiments were used to verify the targeting relationship between miR-148a-3p and target genes. The target protein expression level was detected by Western Blot.ResultBioinformatics methods predict that dynein light chain LC8-type 2(DYNLL2) is one of the miR-148a-3p target genes, QPCR experiments showed that there were differences in the DYNLL2 expression of glioma cell line U87/U251 between glial cell line HA1800, There were differences in the over expression and inhibitory expression of miR-148a in glioma cells, The results of Western Blot showed that the protein expression of DYNLL2 was different in glial cell line HA1800 and glioma cell line U87/U251.ConclusionDYNLL2 was a target gene of miR-148a-3p, DYNLL2 is expressed both in glial cells and glioma cells. Compared with normal glial cells, the expression of DYNLL2 was down regulated in glioma cells including gene levels and protein levels, and miR-148a-3p could reversely regulate DYNLL2 expression.
MicroRNA; MiR-148a; DYNLL2
R737.14
A
1673-016X(2017)06-0003-06
2017-08-10
国家自然科学基金项目(NO.81472860)
彭小宁,E-mail:Pxiaoning@hunnu.edu.cn

