香叶醇对人肝癌细胞株Huh7增殖及TGF-b1/Smad 2信号通路影响研究
徐 慧,邓意志
(长沙卫生职业学院,长沙 410100)
香叶醇对人肝癌细胞株Huh7增殖及TGF-b1/Smad 2信号通路影响研究
徐 慧,邓意志
(长沙卫生职业学院,长沙 410100)
目的:探讨香叶醇对肝癌细胞株Huh7增殖及TGF-b1/Smad 2信号通路的影响。方法:不同浓度香叶醇干预体外培养肝癌细胞株Huh7不同时间。MTT检测香叶醇对Huh7细胞生长情况的影响,流式细胞术检测细胞周期的变化情况,RT-PCR和Western blot分别检测细胞内TGF-b1和Smad 2 mRNA和蛋白表达水平的变化情况。结果:MTT结果显示香叶醇显著抑制了肝癌细胞的生长。流式细胞结果表明香叶醇明显降低了肝癌细胞S期含量而增加了G0/G1期含量。而TGF-b1和其下游因子Smad2的mRNA和蛋白水平的表达也明显受到香叶醇的抑制,且这种抑制作用呈浓度一时间依赖性。结论:香叶醇可能够通过阻断TGF-b1/Smad 2信号通路抑制肝癌细胞生长。
香叶醇;转化生长因子b1;肝癌
原发性肝癌是最常见的恶性肿瘤之一,据《2012中国肿瘤登记年报》统计,肝癌位居我国恶性肿瘤发病率第三位(28.71/10万),死亡率第二位(26.04/10万),我国肝癌患者数量占全球54%,每年死于肝癌的人数达37万[1]。肝癌好发于男性,高发年龄为30~50岁。由于肝癌的早期症状隐匿,肝癌难以早期诊断且易发生转移,使得肝癌患者预后差,致死率高居不下;若不对肝癌患者采取治疗措施,5年存活率低于5%。尽管肝癌治疗已取得一定程度进展,但是目前肝癌患者5年期存活率仍不到5%[2]。Gotzmann J等研究发现TGF-b1在肝细胞恶变为肝癌细胞过程中发挥重要作用。因此,靶向TGF-b1是肝癌治疗的潜在有效靶点[3]。(无环)单萜香叶醇是在柠檬、天竺葵及其他从医用植物中提取的精油中含量极低的天然化合物。香叶醇具有抗氧化、抗微生物和抗炎活性[4]。此外,香叶醇还能通过靶向细胞周期和凋亡过程抑制多种人类肿瘤细胞生长[5-,7]。本研究主要探讨香叶醇对肝癌细胞株生长的影响及其与TGF-b1信号通路的关系。
1 资料与方法
1.1 材料来源
1.1.1 细胞培养 肝癌细胞株Huh-7购自中南大学细胞生物实验中心,细胞在37℃,含5%CO2的养箱内,用含10%小牛血清的DMEM高糖培基(美国Hyclone公司)培养,培养基中分别加入终浓度为100mg/L的链霉素与青霉素,细胞贴壁生长24h。细胞用0.05%胰蛋白酶一EDTA消化传代,选取对数生长期细胞进行后续实验。
1.1.2 试剂来源 香叶醇(Sigma-48799)购自Sigma公司;Trizol、RT-PCR试剂盒大连宝生物公司。PVDF膜购自美国Millipore公司、抗体TGF-b1和Smad2购自美国Santacruz公司。
1.2 主要方法
1.2.1 MTT法检测香叶醇对肝癌细胞株Huh7生长的
影响 Huh7细胞培养至对数生长期后,消化计数,以105个/mL接种于96孔板,培养过夜后,分别用1、2、4、6、8、16 mmol的香叶醇干预Huh7细胞24、48 和72 h,对照组细胞仅加入相应培基。药物干预完成后,弃去培养,加入200 ml 5mg/ml MTT继续培养4小时,最后用50ml DMSO处理,酶标仪测定OD450nm时细胞吸光值(OD),然后计算抑制率。抑制率=(1-药物干预组OD/对照组OD)×100%。并在倒置显微镜下观察未经香叶醇处理及经香叶醇处理的Huh7细胞形态。
1.2.2 流式细胞仪检测香叶醇对肝癌细胞株Huh7细胞周期的影响 1、2、4、6、8、16 mmol的香叶醇干预Huh7细胞48h(根据MTT结果筛选出的最佳作用时间点)后,弃去培基,PBS漂洗细胞两次,4%多聚甲醛固定过夜,PI染色后流式细胞仪检测其细胞周期。
1.2.3 RT-PCR检测香叶醇对肝癌细胞株Huh7细胞TGF-b1和Smad2 mRNA表达的影响 采用Oligo7.0软件设计TGF-b1、Smad2 及b-actin引物,并交由Invitrogen公司合成。 引物序列如下:TGF-b1,5'-CCT TGC TGG ACC GCA ACA AC-3'(正向),5'-CAG CAG CCG GTT ACC GAC-3'(反向);Smd 2,5'-CAG GTT CCA GCT ATG GAG C-3'(正向),5'-TTC ATG GCC GAA TCC CAT-3'(反向);b-actin,5'-CAG GTC ATA CTC CTG CGG CTG -3'(正向),5'-CGG GAC CTC ACT GAC TACC TC-3'(反向)。Trizol提取细胞tRNA,采用易步发RTPCR试剂盒扩增。扩增结束后,PCR产物行1.8%琼脂糖凝胶电泳,凝胶成像系统下观察电泳结果,并进行灰度值分析。
1.2.4 Western blot检测香叶醇对肝癌细胞株Huh7细胞TGF-b1和Smad2 蛋白表达的影响 香叶醇作用Huh7细胞48h后,收集细胞,加入150mL细胞裂解液,超声粉碎,离心,取上清。分别取100mg样品蛋白/孔上样,SDS聚丙烯酰胺凝胶电泳分离蛋白,湿转1小时(4℃,100v),5%脱脂奶粉封闭2h,然后分别用b-actin(1∶1000),TGF-b1(1∶500)、Smad2(1∶500)一抗 4℃平摇过夜,HRP标记二抗(1∶1000)避光孵育2h,ECL Plus显色液显色,显影、定影,扫描条带并行分析,以目的条带与b-actin条带吸光度的比值作为目的蛋白的相对表达量。
2 结果
2.1 香叶醇对肝癌细胞株Huh7生长及形态的影响1、2、4 mmol香叶醇干预Huh7细胞时OD450值与对照组相比无明显差异,而8和16香叶醇干预Huh7细胞时OD450值明显下降,与对照组相比有统计学差异(P<0.05)。相同浓度香叶醇干预Huh7不同时间后,OD450值均有统计学意义(P<0.05)(图1)。MTT结果表明,香叶醇以时效性和剂效性抑制Huh7生长。

图1
在不同浓度香叶醇干预的细胞分别于培养24,48和72小时后,于倒置相差显微镜下观察,人肝癌Huh7细胞经香叶醇处理后出现明显的形态学改变。倒置显微镜下观察细胞形态,比较香叶醇药物作用组和对照组,未受到香叶醇干预的细胞均呈单层细胞贴壁生长,细胞间结构紧密,细胞增殖生长(图2-A)。随药物干预的剂量和时间延长,细胞形态逐渐变圆,细胞间间隙增大,细胞密度逐渐变小,细胞内中毒颗粒增多,折光度下降,部分细胞丧失贴壁能力,悬浮在培养基中生长,随机视野可见细胞密度明显减少。在相同的时间内,细胞对不同浓度药物的反应存在差异。随香叶醇药物浓度的增大,肝癌Huh7细胞脱落的比例增多,细胞碎裂的比例明显增多。上述结果提示香叶醇可以抑制Huh7细胞的增殖(图2-B,C,D)。
2.2 香叶醇对肝癌细胞株Huh7细胞周期的影响 与对照组比较,当香叶醇浓度为1、2、4 mmol/l时,处于G0/G1的Huh7细胞的比例差异无统计学意义;而随着香叶醇浓度的增加,G0/G1期Huh7细胞的比例较对照显著增加(P<0.05),而S期和G2,M的比例则显著下降(P<0.05)(表1)。
2.3 香叶醇对肝癌细胞株Huh7 TGF-b1和Smad2 mRNA和蛋白表达的影响 RT-PCR和Western Blot实验结果表明,香叶醇以时间剂量效应抑制Huh7 TGF-b1和Smad2 mRNA和蛋白表达(图2,3,4)。
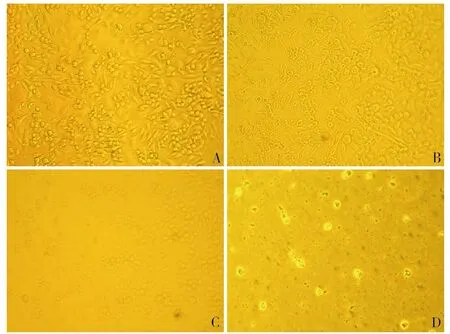
图2. Huh7细胞形态学观察。

表1 不同浓度香叶醇对Huh7细胞周期的影响
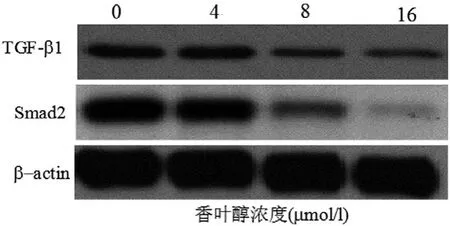
图3 香叶醇对Huh7 TGF-b1和Smad2 蛋白表达的影响
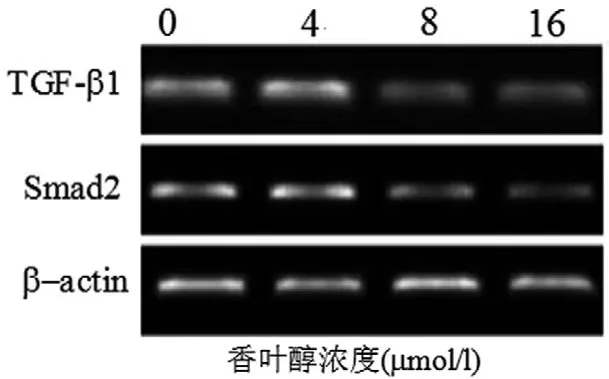
图3 香叶醇对Huh7 TGF-b1和Smad2 mRNA表达的影响
3 讨论
转化生长因子b1(transforming growth factor-b1,TGF-b1)在胚胎形成、细胞生长调控、胞外基质分泌、血管生成及免疫调节等多种生理过程中发挥重要作用。动脉粥样硬化和脏器纤维化与TGF-b1表达异常密切相关,特别是TGF-b1与癌症的相关性近年来成为学者们关注的焦点[8]。Samds是一类十分重要的转录因子调节信号分子家族,其中Smad2识别和结合上游信号分子,并将其转运至细胞核内,并激活TGF-b1/Smads信号通路,因此Smad2是TGF-b1/Smads信号通路至关重要的调控分子。Smad2表达沉默会导致TGF-b1/Smads信号通路发生紊乱[9]。
TGF-b1/Smads信号通路在肿瘤不同阶段发挥不同的作用。肿瘤形成时,TGF-b1/Smads信号通路抑制肿瘤细胞生长。在这一阶段,一旦参与TGF-b1/Smads信号通路的信号分子表达异常,肿瘤细胞既能捕捉到这一信息,从而“逃避”TGF-b1/Smads信号通路的抑制作用。而当肿瘤处于进展期时,TGF-b1/Smads信号通路发挥促进肿瘤细胞生长的作用,并增强肿瘤的侵袭性和恶性程度[10]。
程朋等研究发现TGF-b1和Smad2在肝癌组织中的表达高于正常肝组织,TGF-b1和Smad2基因过表达可能在HCC的发生、发展中发挥作用[11]。王春雷等研究表明:HepG2细胞系比Huh-7和Hep3B细胞系更易发生TGF-b1诱导的凋亡,Smad4也许是TGF-b1信号转导途径的主要调控因子之一[12]。孔丽等则研究证实TGF-b1/Smads信号转导通路被抑制,使TGF-b1介导的抗增殖信号不能正常下传,可能是肝癌发生的机制之一[13]。这些研究提示TGF-b1/Smd 2信号通路是肝癌发生发展的重要参与者,是肝癌治疗的潜在有效靶点。
香叶醇已被证实能够抑制多种人类肿瘤的生长,其主要通过抑制多种肿瘤生长因子、肿瘤代谢酶、转录调控因子及抗凋亡蛋白表达发挥肿瘤抑制作用[14]。本研究首先采用MTT实验检测香叶醇对肝癌细胞Huh7生长的影响,结果证实香叶醇以时间和剂量依赖效应抑制肝癌细胞生长,这一结果与以往研究结果一致[15]。此外,本实验结果还发现香叶醇能够抑制S期肿瘤细胞比例,使多肿瘤细胞发生G0/G1期阻滞。而Western Blot和R-PCR实验表明,香叶醇能够降低肝癌细胞中TGF-b1和Smad2 蛋白和mRNA表达。这一结果提示香叶醇能够抑制肝癌细胞TGF-b1/Smad2信号通路活性,且这种抑制作用有浓度-时间依赖性。
总之,香叶醇能够抑制肝癌细胞生长,是其发生G0/G1期阻滞。其可能机制是香叶醇通过抑制TGF-b1和Smad2表达而阻断TGF-b1/Smad2信号通路,本文研究结果为肝癌临床治疗提供了新思路。但是,香叶醇抑制TGF-b1/Smad2信号通路具体作用机制仍需进行深入探讨,并需进行体内实验验证,以便为将香叶醇作为预防或治疗肝癌的有效药物提供最为充分依据。
[1] 赫捷, 赵平, 陈万青.2012中国肿瘤登记年报[M]. 北京: 军事医学科学出版社, 2012: 85-87.
[2] 褚志强, 吴向未, 杨宏强, 等. 原发性肝癌手术治疗的生存率分析及影响因素研究[J]. 实用医学杂志, 2013, 29(5): 787-789.
[3] Gotzmann J, Huber H, Thallinger C, et al. Hepatocytes convert to a fibroblastoid phenotype through the cooperation of TGF-beta 1 and Ha-Ras: steps towards invasiveness[J]. Journal of Cell Science, 2002,115(6): 1189-1202.
[4] Lapczynski A, Bhatia S P, Foxenberg R J, et al. Fragrance material review on geraniol[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association, 2008, 46(11): S160–S170.
[5] Madankumar A, Jayakumar S, Gokuladhas K, et al. Geraniol modulates tongue and hepatic phase I and phase II conjugation activities and may contribute directly to the chemopreventive activity against experimental oral carcinogenesis[J]. European Journal of Pharmacology, 2013,705(20): 148–155.
[6] Jin X, Sun J, Miao X, et al. Inhibitory effect of geraniol in combination with gemcitabine on proliferation of BXPC-3 human pancreatic cancer cells[J]. Journal of International Medical Research, 2013, 41(4):993-1001.
[7] Galle M, Crespo R, Kladniew B R, et al. Suppression by geraniol of the growth of A549 human lung adenocarcinoma cells and inhibition of the mevalonate pathway in culture and in vivo: potential use in cancer chemotherapy[J]. Nutrition & Cancer, 2014, 66(5): 888-895.
[8] 王芙蓉, 李云霞. 转化生长因子β1与肿瘤关系的研究进展[J]. 医学综述, 2008, 14(9): 1318-1320.
[9] Ota K, Quint P, Ruan M, et al. TGF-β induces Wnt10b in osteoclasts from female mice to enhance coupling to osteoblasts[J]. Endocrinology,2013, 154(10): 3745-3752.
[10] 刘锟荣, 韦宜宾, 陈国忠. Wnt/β-catenin、TGF-β/Smads及RAS/MARK信号通路与大肠癌关系的研究进展[J]. 广东医学, 2014,8(17): 2785-2788.
[11] 程朋, 曾维政, 张汝, 等. TGF-β1与Smad2基因在肝细胞肝癌中的表达及意义[J]. 临床肿瘤学杂志, 2009, 14(11): 980-983.
[12] 王春雷, 万远廉, 刘玉村, 等. 转化生长因子β1(TGF-β1) 诱导人肝癌细胞系的凋亡与声p53及Smad4活化相关[J]. 北京大学学报 (医学版), 2006, 21(2): 176-178.
[13] 孔丽, 姚树坤, 张瑞星, 等. 原发性肝癌患者血清TGFβ1、IL-12、IFNγ等细胞因子水平及临床演变的关系[J]. 临床肝胆病杂志,2006, 22(4): 247-249.
[14] Rekha K R, Selvakumar G P. Gene expression regulation of Bcl2, Bax and cytochrome-C by geraniol on chronic MPTP/probenecid induced C57BL/6 mice model of Parkinson's disease[J]. Chem Biol Interact,2014, 217(9): 57-66.
[15] Polo M P, Crespo R, Bravo M G. Geraniol and simvastatin show a synergistic effect on a human hepatocarcinoma cell line[J]. Cell Biochemistry & Function, 2011, 29(6): 452–458.
Effect of Geraniol on proliferation and TGF-b1 signaling pathway of human hepatcellular Carcinoma cell line Huh7
Xu Hui, Deng Yi-zhi
(Changsha Health Vocational College, Changsha 410100, China)
ObjectiveTo observe the effect of Geraniol on proliferation and TGF-b1 signaling pathway of human hepatcellular Carcinoma cell line Huh7.MethodsHuman hepatcellular Carcinoma cell line Huh7 was cultured and treated with Geraniol at different concentration and at different time points. The effect of Geraniol on Huh7 cell proliferation was studied by means of MTT, the cell cycle was detected with flow eytometry; RT-PCR and western blot were used to detect the expressions of TGF-b1 and Smad 2 at mRNA and protein levels.ResultsThe viability of Huh-7 cells treated with Geraniol was obviously decreased. Analysis of the cell cycle revealed that Geraniol induced a significant decrease in cells in the S phase and increase in cells in the G1 phase. Furthermore, the expressions of TGF-b1 and its downstream factor-Smad 2 at mRNA and protein levels wele inhibited by Geraniol in a concentration and time dependent manner.Conclusions Geraniol perhaps plays its inhibitory effects Huh-7 cells through inhibiting the the activity of TGF-b1 signaling pathway.
geraniol; TGF-b1 signaling pathway; hepatcellular carcinoma
R273
A
1673-016X(2017)06-0012-04
2017-07-25
湖南省医药卫生科研计划项目(No:B2014-150)
邓意志,E-mail: 934503827@qq.com

