年龄相关听力损失小鼠耳蜗和蜗核组织中MeCP2_BDNF的变化
蒋腊梅,伍伟景,陈 勇,张 勇
(1.湖南师范大学医学院,长沙 410013;2.中南大学湘雅二医院,长沙 410005;3.湖南省计划生育研究所,长沙 410008)
年龄相关听力损失小鼠耳蜗和蜗核组织中MeCP2_BDNF的变化
蒋腊梅1,伍伟景2,陈 勇3,张 勇1
(1.湖南师范大学医学院,长沙 410013;2.中南大学湘雅二医院,长沙 410005;3.湖南省计划生育研究所,长沙 410008)
目的:探讨年龄相关性听力损失小鼠听觉系统中甲基化CpG结合蛋白2(MeCP2)和脑源性神经营养因子(BDNF)的表达随月龄增长的变化。方法:应用蛋白免疫印迹、荧光定量逆转录多聚酶链反应方法,分别检测3、6、12、18月龄鼠耳蜗和蜗核组织中MeCP2、BDNF的表达。结果:MeCP2、BDNF在4个不同月龄组小鼠耳蜗和蜗核组织中均有表达,随着月龄增加,MeCP2蛋白表达及BDNF mRNA表达水平呈一致性下降趋势,6、12、18月龄组均明显低于3月龄组,各组间比较差异有显著性。结论:年龄相关性听力损失与听觉系统中MeCP2及其相关基因BDNF的表达下调密切相关。
年龄相关性听力损失;MeCP2;BDNF;听觉系统;小鼠
由于年龄增长使听觉器官衰老、退变而出现的双耳对称、缓慢进行性的感音神经性听力减退,称为老年性耳聋或年龄相关性听力损失,属于生理性的自然老化过程,病理改变从外周的耳蜗毛细胞、螺旋韧带、血管纹、螺旋神经节细胞到中枢的蜗核、上橄榄核、外侧丘系核、下丘核、内侧膝状体核直至听觉皮层均有累及。
年龄依赖性MeCP2减少与年龄相关的神经退行性疾病和许多老化疾病有关[1-2],笔者之前的研究暗示,MeCP2年龄依赖性的减少可能与听觉系统老化及老年性耳聋相关[3-5]。但是,MeCP2是如何启动听觉系统老化、导致老年性耳聋的?目前仍不清楚,发现MeCP2下游靶基因是理解MeCP2相关性疾病发病的关键性的一步,近来已发现BDNF是MeCP2的下游靶基因[6-7],而BDNF与老年性耳聋的发病有直接关系[8-9],可是其功能的关联还未确定。本研究就年龄相关性听力损失小鼠听觉通路耳蜗和蜗核组织中MeCP2、BDNF的表达随月龄增长的变化作初步探讨。现将实验方法及结果报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 BALB/c小鼠由西安交通大学实验室动物中心SPF实验部提供,在SPF环境下饲养并纯种传代。分组:经听觉脑干电反应(ABR)检测,选择有听力下降的6月龄鼠(听力阈值平均为(51.5±6.7)dB SPL)、12月龄鼠(听力阈值平均为(92.5±7.5)dB SPL)、18月龄鼠(120 dB SPL刺激声无诱发反应)各20只,体重30~45 g;健康 3 月龄鼠20只,体重20~25 g,听力阈值平均为(24.8±5.1)dB SPL。四组动物均无噪声暴露及药物使用史,活杀时无中耳炎。
1.1.2 主要器材 ERA1260 脑干诱发电位仪(丹麦Madsen公司);XSS-40双目手术显微镜(杭州医用光学仪器厂);超净工作台(苏州安泰空气技术有限公司);ELX800酶标仪(BIO-TEK INSTRUMENT. INC);高速冷冻离心机、DUR530核酸蛋白分析仪(Beckman公司);凝胶成像分析系统、微型垂直平板电泳槽及其配套电转移系统(Bio-Rad公司);PCR仪、测序仪(美国ABI公司)。
1.1.3 主要试剂 兔抗鼠MeCP2单克隆抗体、丙烯酰胺(Sigma公司);HRP标记的羊抗兔IgG抗体(Gibco公司);Tris碱(Serva公司);十二烷基磺酸钠(SDS)(天津天泰精细化学品公司);低分子量蛋白质标准(上海华舜生物有限公司);RT-PCR两步法试剂盒(Promega公司);引物(上海生工生物工程公司);RNA提取试剂Trizol(Invitrogen公司)。
1.2 方法
1.2.1 脑干电反应测听(ABR) 小鼠用1%戊巴比妥钠按50mg/kg行腹腔注射麻醉,待麻醉满意后,在具有良好接地的隔音室内〔环境温度(25±3)℃〕应用Madsen ERA1260脑干诱发电位仪测试。采用直径0.38 mm、长1.5寸的针灸针作电极。记录电极放置在颅顶,参考电极及接地电极分别置于给声耳及对侧耳耳后皮下。刺激声为8 kHz短纯音,带通滤波100~3000 Hz,重复率11次/s,叠加1024次,扫描时程10 ms。声刺激强度从115 dB SPL开始,10 dB递减,接近阈值时改为5 dB递减,观察Ⅲ波以确定阈值,取每只小鼠右耳结果进行分析。
1.2.2 蜗核定位 按George Paxinos and Charles Watson制定的定位方法:耳蜗核位于延髓嘴侧端的背外侧面,包括背侧核和腹侧核。背侧核呈半月形,斜跨小脑尾侧脚的背侧面,形成隆起的听结节,完全被小脑覆盖,其内侧端达到第四脑室的侧缘,其外侧端绕延髓外面向腹侧和嘴侧伸展,与腹侧核相连续。腹侧核形状较圆,位于延髓嘴侧端三叉神经脊束的表面,与背侧核相连并部分被背侧核迭盖。
1.2.3 标本的预处理 按蜗核定位方法于手术显微镜下取出双侧蜗核,随后取出双侧听泡,分离出耳蜗。立即用4℃ 0.1 mol/L PBS缓冲液(pH 7.4)洗净血迹,迅速放入液氮中保存待测。
1.2.4 蛋白免疫印迹(Western blot) ①各月龄组耳蜗及蜗核组织标本总蛋白的制备 各实验组液氮下碾碎50mg左右组织标本,加入预冷的三去污裂解液200~500μL,充分混匀,冰浴30min,4℃下13 000rpm离心20min,上清液即为细胞蛋白提取液,以牛血清白蛋白作为标准品,Bradford方法进行蛋白质定量,将所有蛋白样品调至等浓度,分装后储于-70℃备用。②电泳及电转移 SDS-聚丙烯酰胺(SDS-PAGE)电泳凝胶配制,分离胶Tris溶液为 1.5 mol/LTris(pH8.8),积层胶Tris溶液为1.0 mol/L Tris(pH6.8);各实验组以40μg总蛋白上样,以起始电压80 V电泳,待样品电泳至分离胶,电压调至120 V,电泳结束后,取下凝胶进行电转移(100V/400mA 电转移1.5 h)。③封闭及杂交 将PVDF膜用PBST漂洗后,浸入封闭液中,缓慢振荡1h;PBST洗膜15min×3次;加入MeCP2一抗(1∶1000),4℃摇床孵育过夜;PBST洗膜15min×3次;加入羊抗兔IgG/HRP二抗(1∶10000)室温孵育1.5 h;PBST洗膜15min×3次;将PVDF膜置于HRP-ECL化学发光试剂中反应1~3 min。暗室中使X光片曝光,常规方法显影定影。④图像分析 将X光片上的目的蛋白条带在Gel DoC 2000凝胶成像系统中扫描存档,通过目的蛋白与内参照β-actin的光密度比值来衡量表达情况。
1.2.5 逆转录多聚酶链反应(RT-PCR) ①引物设计 根据Bdnf、β-actin的mRNA序列(genebank序列号NM_007540、NM_007393),应用在线引物设计软件primer3设计,相关引物由上海生工生物工程公司合成纯化。Bdnf PCR引物设计如下:

目的基因 引物序列(5’-3’) 大小(bp)循环次数Bdnf 正义链:atgagacccggttccttcaa反义链:tcgtcgtcagacctctcgaa退火条件(℃)341 60 32 β-actin 正义链:caactgggacgacatggaga反义链:aaccgctcgttgccaatagt 534 60 32
2 结果
2.1 各月龄组小鼠耳蜗和蜗核组织MeCP2的Western blot分析 MeCP2在不同月龄小鼠耳蜗和蜗核组织中均有表达,并随月龄增长MeCP2蛋白表达水平均逐渐下降,耳蜗及蜗核组织的MeCP2蛋白表达OD比值(MeCP2/β-actin)在3、6、12、18月龄组分别为 0.7816±0.049、0.4008±0.059、0.1806±0.029、0.051±0.011(见图 1)及 0.7964±0.036、0.6356±0.022、0.2941±0.030、0.1287±0.029(见图2)。6、12、18月龄组小鼠耳蜗及蜗核的MeCP2蛋白表达量均明显低于3月龄组,进行组间两两比较,其差异均有显著统计学意义(P<0.01)。

图1 各组耳蜗中MeCP2蛋白表达电泳图
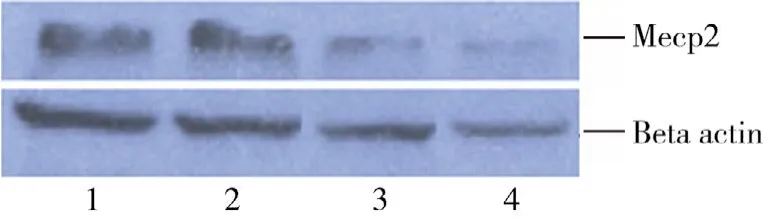
图2 各组蜗神经核中MeCP2蛋白表达电泳图
2.2 各月龄组小鼠耳蜗和蜗核组织BDNF mRNA的表达 BDNF在不同月龄组小鼠耳蜗和蜗核组织中均有表达,并随月龄增长BDNF基因表达逐渐减弱,耳蜗及蜗核组织的BDNF mRNA表达OD比值(Bdnf/β-actin)在3、6、12、18月龄组分别为0.3759±0.037、0.310±0.023、0.201±0.028、0.132±0.021(见图 3)及0.4156±0.032、0.3331±0.032、0.2264±0.031、0.1031±0.029(见图4)。6、12、18月龄组小鼠耳蜗及蜗核组织的BDNF mRNA表达量均比3月龄组明显减少,且组间两两比较均存在显著差异(P<0.01)。

图3 各组耳蜗中Bdnf mRNA表达电泳图

图4 各组蜗神经核中Bdnf mRNA表达电泳图
2.3 PCR产物测序及BLAST比较分析 分别用合成的引物对PCR产物进行测序,运用DNASTAR软件中的Seqman Ⅱ对测序结果进行分析,证实RT-PCR产物与目的基因Bdnf mRNA序列完全一致(见图5)。
3 讨论
老年性耳聋的发病率很高,人类40岁以后随年龄增长听力逐渐减退。12月龄小鼠相当于人类60~65岁,开始进入初老阶段。BALB/c纯种小鼠易患年龄相关性听力损失,表现为进行性的高频听力损失,其听力下降的模式与人类相似,而且鼠与人类的遗传基因组非常相似,适用于老年性耳聋的研究。
老年性耳聋是人体老化在听觉器官中的表现,听觉系统的老化不仅累及耳蜗外周,而且多级听觉中枢均受到影响。MeCP2年龄依赖性的减少是普遍老化所共有的,年龄依赖性的MeCP2减少亦可能与听觉系统的老化密切相关。而MeCP2启动听觉系统老化、导致老年性耳聋的关键点,可能是通过调控其下游靶基因BDNF的表达来实现的。
近年研究[6-7]发现,BDNF是MeCP2的下游靶基因,脑中MeCP2的缺乏已显示出降低了BDNF的全面表达,但MeCP2缺乏引起BDNF表达的全面下调是一个谜。Abuhatzira等[10]报道,在人和小鼠脑中MeCP2的缺乏引起两个神经元基因转录抑制子REST(RE1 silencing transcription factor,REST)和CoREST表达的增加,MeCP2与其结合并卷入Rest和CoRest启动子的抑制中;在MeCP2缺乏鼠的脑中增高的REST和CoREST水平导致BDNF的下调,显然是依靠它们(MeCP2和BDNF)与RE1成分的结合,RE1定位于BDNF基因开始的两个启动子之间。有趣的是,编码BDNF受体TrkB的NTRK2基因在MeCP2缺乏的人和小鼠脑中过表达,或直接地、或作为一代偿企图补偿BDNF的不足。本实验结果,年龄相关听力损失小鼠耳蜗和蜗核组织中MeCP2的表达随增龄明显减少,同时BDNF的表达亦随增龄明显减少,其机制有可能涉及上述假说。
BDNF,是与神经元的生存、分化和突触的可塑性有关的脑源性神经营养因子,对听觉和前庭系统神经的发育和存活有重要作用,与感音神经性老年性耳聋的发病有直接关系。内耳感觉上皮中前体细胞为BDNF合成细胞,前庭与耳蜗神经元以及支配内耳的自主神经与传出神经的分化、发育与存活均可能受某些神经营养因子NTs(如BDNF)及其受体(如TrkB)调节。BDNF为可塑性反应受动器,成熟期神经元可塑性降低,认为是与BDNF水平下降有关。近来研究[8-9]发现,在老化时高频段的耳蜗神经元和毛细胞中的BDNF表达减少,表明BDNF与老年性耳聋的发病有关。
而MeCP2是BDNF的转录调节者,MeCP2的缺乏引起两个神经元基因转录抑制子REST和CoREST表达的增加,并依靠MeCP2和BDNF与RE1成分的结合,导致BDNF表达的全面下调。BDNF对听觉系统神经的发育和存活有重要作用,年龄依赖性的BDNF表达减少与感音神经性老年性耳聋的发病有直接关系。本研究结果,年龄相关听力损失小鼠耳蜗和蜗核组织中MeCP2及BDNF的表达水平随增龄呈一致性下降趋势,暗示年龄依赖性的MeCP2减少亦或致BDNF表达下调而与老年性聋相关。
因此我们推测,年龄相关性听力损失可能与听觉系统中MeCP2及其相关基因BDNF的表达下调密切相关,为进一步寻找一种直接、有效、可行的防治老年性耳聋的方法打下基础。
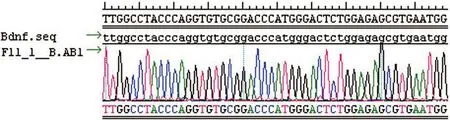
图5 Bdnf基因RT-PCR产物测序结果
[1] Richardson B. Impact of aging on DNA methylation[J]. Ageing Res Rev, 2003, 2(3): 245-261.
[2] Maeqawa S, Hinkal G, Kim HS, et al. Widespread and tissue specific age-related DNA methylation changes in mice[J]. Genome Res, 2010,20(3): 320-340.
[3] 蒋腊梅, 张勇, 葛圣雷, 等. 小鼠增龄过程中耳蜗MeCP2的变化[J].激光生物学报, 2011, 20(1): 7-10.
[4] 蒋腊梅, 伍伟景, 彭斌, 等. 不同月龄小鼠蜗神经核中甲基化CpG结合蛋白2的表达及临床意义[J]. 中国老年学杂志, 2011, 31(20):3966-3968.
[5] 蒋腊梅, 伍伟景, 陈勇. 年龄相关听力损失小鼠耳蜗组织中甲基化CpG结合蛋白2的变化[J]. 医学临床研究, 2016, 33(12): 2312-2314.
[6] Chen WG, Chang Q, Lin Y, et al. Derepression of BDNF transcription involves calcium-dependent phosphorylation of MeCP2[J]. Science.2003, 302(5646): 885-889.
[7] Im, H. -I. , Hollander, J. A. , Bali, P. , & Kenny, P. J. . MeCP2 controls BDNF expression and cocaine intake through homeostatic interactions with microRNA-212. Nature Neuroscience, 2010, 13(9), 1120–1127.
[8] Rüttiger L, Panford-Walsh R, Schimmang T, et al. BDNF mRNA expression and protein localization are changed in age-related hearing loss[J]. Neurobiol Aging, 2007, 28(4): 586-601.
[9] 李玉茹, 刘得龙, 张媛媛, 等. 脑衍生的神经营养因子及其受体trk B在老年性大鼠耳蜗中的表达[J]. 临床耳鼻咽喉科杂志.2006,20(19): 894-895.
[10] Abuhatzira L, Makedonski K, Kaufman Y. MeCP2 deficiency in the brain decreases BDNF levels by REST/CoREST - mediated repression and increases TRKB production[J]. Epigenetics.2007, 2(4): 214-222.
Changes of MeCP2 and BDNF in the cochlea and cochlear nuclei of BALB/c mice with age- related hearing loss
Jiang La-mei1, Wu Wei-jing2, Chen Yong3, Zhang Yong1
(1. The Medicine College of Hunan Normal University, Changsha 410013, China; 2. Second Xiangya Hospital of Central South University,Changsha 410005, China; 3. Hunan Family Planning Research Institute, Changsha 410008, China)
ObjectiveTo investigate the changes of methyl-CpG-binding protein 2(MeCP2), and brain-derived neurotrophic factor (BDNF) expressions in the auditory system of BALB/c mice with age-related hearing loss.MethodsThe levels of MeCP2 protein in the cochlea and cochlear nuclei of BALB/c mice among four age groups (3-, 6-, 12- and 18-month-old) were detected and compared via Western blot assay. Detection and analysis of the expression of BDNF mRNA in the cochlea and cochlear nuclei were carried out by reverse transcription polymerase chain reaction (RT-PCR) on 3-, 6-, 12- and 18-month- oldBALB/c mice, respectively.ResultsMeCP2 and BDNF were expressed in both cochlea and cochlear nuclei of BALB/c mice in four age groups. Western blot assay showed that the levels of MeCP2 protein in the cochlea and cochlear nuclei tissues of mice gradually decline with the increase of age.Resultsof RT-PCR demonstrated that the mRNA expression of BDNF decreased as the age increasing. The optical density (OD) ratio of MeCP2 and BDNF were significantly lower in 6-, 12- and 18-monthold mice than in 3-month-old mice, there was a statistically significant difference between each two groups.ConclusionThe age-related hearing loss is close related to the consistent age-relatedly down-regulated expression of MeCP2 and its correlation genes BDNF in auditory system.
age-related hearing loss; MeCP2; BDNF; auditory system; BALB/c mice
R764.436
A
1673-016X(2017)06-0008-05
2017-06-12
湖南省教育厅科学研究重点项目(13A061);湖南省财政厅教育支出立项课题(湘财教指〔2015〕199号)
蒋腊梅,E-mail:1421129082@qq.com

