C反应蛋白作为阻塞性睡眠呼吸暂停患儿扁桃体腺样体切除术后残余嗜睡的潜在生物标志物研究
明 昊,田爱民,刘 冰,程良军
(徐州市中心医院耳鼻喉科,徐州 221009)
C反应蛋白作为阻塞性睡眠呼吸暂停患儿扁桃体腺样体切除术后残余嗜睡的潜在生物标志物研究
明 昊,田爱民,刘 冰,程良军
(徐州市中心医院耳鼻喉科,徐州 221009)
目的:探讨C反应蛋白作为阻塞性睡眠呼吸暂停(Obstructive Sleep Apnea,OSA)患儿扁桃体腺样体切除术(Adenotonsillectomy,AT)后残余嗜睡(residual sleepiness,RS)的潜在生物标志物。方法:AT术前和术后采用多导睡眠图检测诊断OSA。扁桃体腺样体切除术前,检测所有患儿血清hs-CRP浓度,大部分患儿术后也进行hs-CRP测定。 OSA完全缓解是指扁桃体腺样体切除术后患儿呼吸暂停低通气指数(Apnea hypopnea index,AHI)<1.5次/h总睡眠时间(total sleep time,TST),而AHI 5次/h TST则被认为存在残余嗜睡,具有临床意义。结果:182例患儿扁桃体腺样体切除术后,OSA明显改善,AHI从15.9±16.4降至4.1±5.3/h TST。182例患儿中,46例患儿(25%)残余嗜睡(AT术后AHI>5)。155例患者AT术前和AT术后都测定hs-CRP水平,AT术前平均hs-CRP水平为0.98±1.91 mg/L,AT术后显著下降(0.63±2.24 mg/dL;P=0.011)。AT术后AHI<1.5次/h TST,1.5次/h TST<AHI<5次/h TST和AHI>5次/h TST分别对应AT术后hs-CRP水平的0.09±0.12,0.57±2.28和1.49±3.34 mg/L,残余嗜睡患儿(AHI>5/h TST)hs-CRP含量明显高于OSA完全缓解患儿(AHI<1.5/h TST),差异具有统计学意义。多元回归模型证实AT术前AHI和AT术后hs-CRP水平与RS显著相关。结论:尽管AT能改善大多数患儿OSA,但RS也时常发生。AT术后hs-CRP是评潜在的有效的生物标志物,可预测RS。
C反应蛋白;阻塞性睡眠呼吸暂停;腺样体扁桃体切除术;生物标志物
阻塞性睡眠呼吸暂停(Obstructive sleep apnea,OSA),是睡眠呼吸紊乱(sleep disordered breathing,SDB)中最为严重的综合征,是非常普遍的疾病,影响2%到3%的儿童,在肥胖儿童中发生风险增加近五倍[1,2]。OSA的主要特点是响亮的间歇性或连续打鼾、上气道阻力增加,导致偶发性氧血红蛋白去饱和、高碳酸血症和碎片化睡眠[3]。
扁桃体组织肥大与儿童OSA发展相关。扁桃体组织增大影响上呼吸道使咽部阻力呈指数增加,导致偶发性呼吸道狭窄和OSA特征性塌陷。然而,并不是所有扁桃体腺样体肥大儿童均患OSA[4]。OSA严重程度与扁桃体和腺样体大小密切相关,也可能与颅面结构,神经肌肉及其他家庭因素有关[5]。因此,美国儿科学会的实践指南建议扁桃体切除术(AT)作为治疗儿童OSA的一线治疗方案。进一步研究表明,儿童OSA诱导几个特定的炎症级联反应,这可能与包括心血管疾病在内的终末器官并发症有关[6]。
C反应蛋白(CRP),一种重要的炎性介质和心血管疾病的独立标志。研究已经表明,血浆高敏CRP(hs-CRP)浓度与儿童OSA有关,hs-CRP水平随OSA严重性的增加而增加[7]。尽管现有证据支持hs-CRP作为儿童OSA的候选生物标志物,但是尚未见研究探讨hs-CRP作为小儿OSA AT术后结局评估的价值,如准确识别残余嗜睡。AT已被证明能显著改善多数小儿OSA患者的症状,但不能根除所有儿童的OSA症状。Bhattacharjee等研究表明AT术后只有27%的OSA完全治愈,有22%的儿童具有中度或重度残余嗜睡。考虑到AT术后残余嗜睡患病率较高,残余嗜睡生物标志物的鉴定在临床上显然具有重要价值,本研究推测,AT术后血浆hs-CRP水平有助于预测AT术后残余嗜睡。
1 资料与方法
1.1 人口统计学 2013年1月~2015年12月182例在我院接受AT术的OSA患儿纳入本次研究,在研究期间使用气道正压通气的儿童被排除在外。
1.2 多导睡眠图评价 多导睡眠图(PSG)数据事后分析标准如下:花费在各个睡眠阶段的时间比例以占总睡眠时间(TST)百分比。计数中央,阻塞和混合性呼吸暂停事件。阻塞性呼吸暂停定义为在没有气流的情况下,胸壁和腹部运动持续至少两个呼吸的时间。呼吸减弱被定义为在口鼻气流的减少大于等于50%,导致外周血氧饱和度(SpO2)相应减少3%或更多和/或脑电图(EEG)的觉醒。阻塞性睡眠呼吸暂停低通气指数(AHI)定义为每小时TST阻塞性呼吸暂停或呼吸减弱次数。觉醒根据美国睡眠障碍协会的任务报告的建议,包括呼吸相关的(呼吸暂停,呼吸减弱,或打鼾后立即发生)和自发的觉醒。觉醒表示为每小时睡眠觉醒的总次数。
AT术前AHI<5次/h TST被认为是正常到轻度OSA,AT术前AHI大于5次/h TST但小于10次/h TST是中度OSA,AT术前AHI>10次/h TST被认为是重度OSA。手术后,AT术后AHI<1.5次/h TST后被认为是OSA完全治愈,AT术后AHI大于1.5次/h TST但小于5次/h TST是轻度残余嗜睡或上呼吸道阻力,AT术后AHI > 5次/h TST被认为是显著残余嗜睡。
采用记录中已测得的身高和体重计算身体质量指数(BMI),采用美国疾病控制和预防中心(CDC)计算2000生长标准(www.cdc.gov/growthcharts)和在线软件(www.cdc.gov/epiinfo)计算BMI Z评分。BMI Z评分>1.65(>第九十五百分位)被认为符合肥胖标准。BMI数据在AT术前和AT术后PSGs时收集。
1.3 血浆hs-CRP测定 血液在早晨受试者接受多导睡眠图检测后采集。采集后的2到3h内测量血浆hs-CRP,采用免疫比浊法测定,检出水平为0.05mg/dL,线性行为25mg/dL,批内和批间变异系数分别为9%和18%。
1.4 数据分析 采用SPSSl8.0统计学软件,所有数据用平均值±标准差表示。AT术前和AT术后的所有结果使用配对t检验进行比较相关分析采用皮尔森相关性检验。最后,使用AT术后AHI作为主要因变量创建分层多元逻辑回归模型。所有P值均进行双尾检验,当P<0.05时报告为有统计学差异。
2 结果
2.1 一般资料 182例患儿中110例(60.4%)男性,所有患儿均无哮喘、过敏性鼻炎或早产史(表1)。

表1 人口统计学特征
2.2 患儿AT术前后多导睡眠图和hs-CRP检测结果比较及相关性分析 多导睡眠图结果显示,AT术后患儿AHI得到明显改善,从15.89±6.38次/h TST降低至4.06±1.33次/h TST(P<0.001)(表2)。46例患儿(25.3%)仍存在中度到重度残余嗜睡,其AHI>5次/h TST(图1)。
所有182例患儿AT术前接受hs-CRP水平测定,但只有155例患儿AT术后接受hs-CRP水平测定。AT术前hs-CRP水平与AT术前AHI显著相关(r:0.238,P=0.001;图2)。AT术前后都接受hs-CRP测定的患儿中,AT术后平均hs-CRP水平显著下降,从0.98±0.11mg/dL 下降至 0.63±0.24mg/dL(P=0.011)(表 2)。AT术后,,中到重度残余嗜睡患儿(AT术后AHI>5 /h TST)s-CRP水平明显高于OSA完全治愈患儿(AT术后AHI<1.5/h TST ;1.49±0.34 对 0.09±0.02,P=0.006 ;图3),,中到重度残余嗜睡患儿和轻度残余嗜睡患儿相hs-CRP水平无统计学差异(1.49±0.34mg/L对0.57±0.28 mg/L,P=0.106;图3)。AT术后hs-CRP水平与相应AT术后AHI显著相关(r:0.222,P<0.005;表3;图4)。AT术后AHI与AT术前AHI(r=0.688,P<0.001)和AT术前hs-CRP(r=0.222,P=0.005)显著相关。然而,无论是年龄还是AT术前和AT术后BMI Z评分都与AT术后AHI无相关性(表3,图4)。
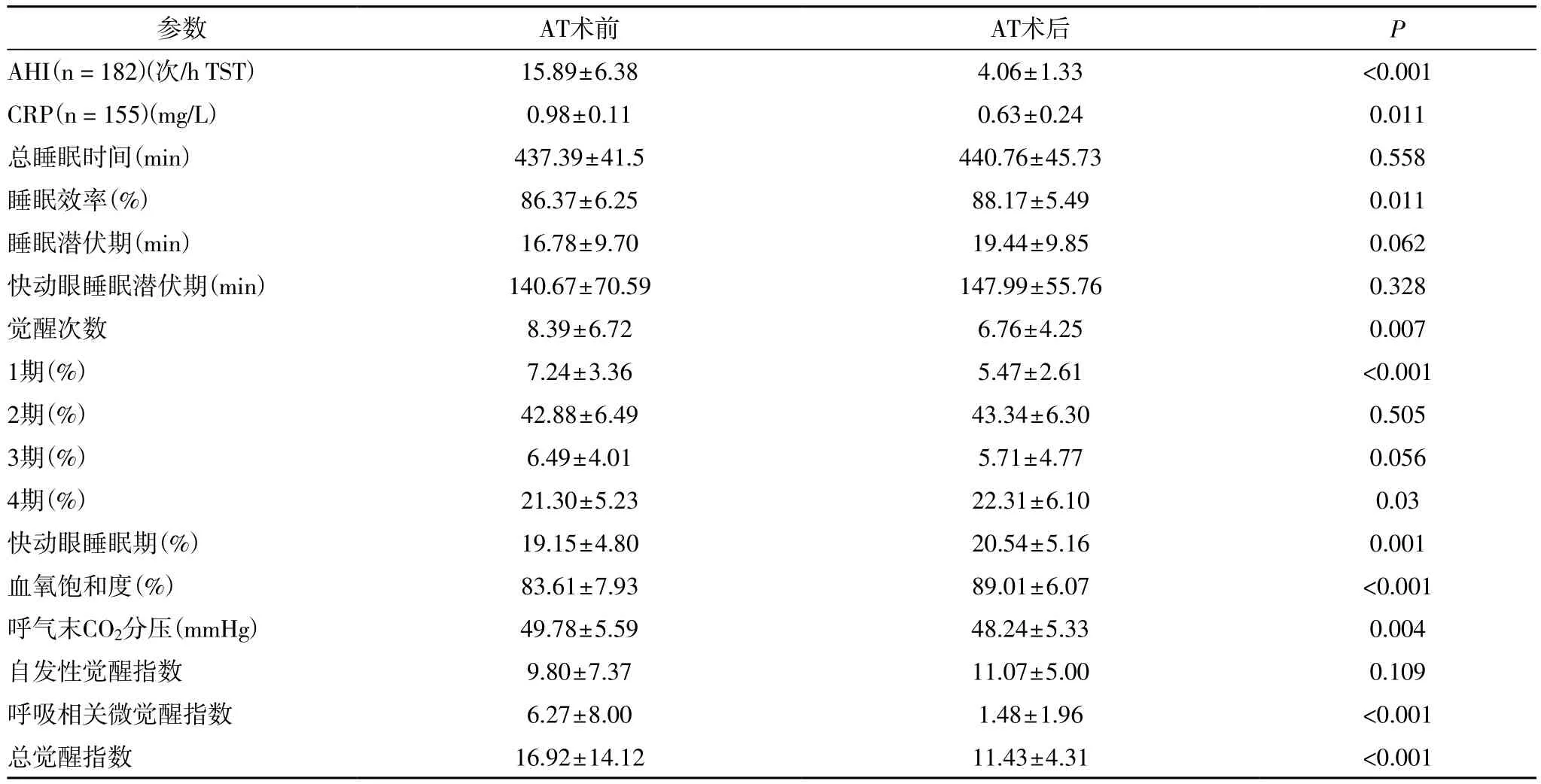
表2 AT术前和AT术后多导睡眠图结果比较
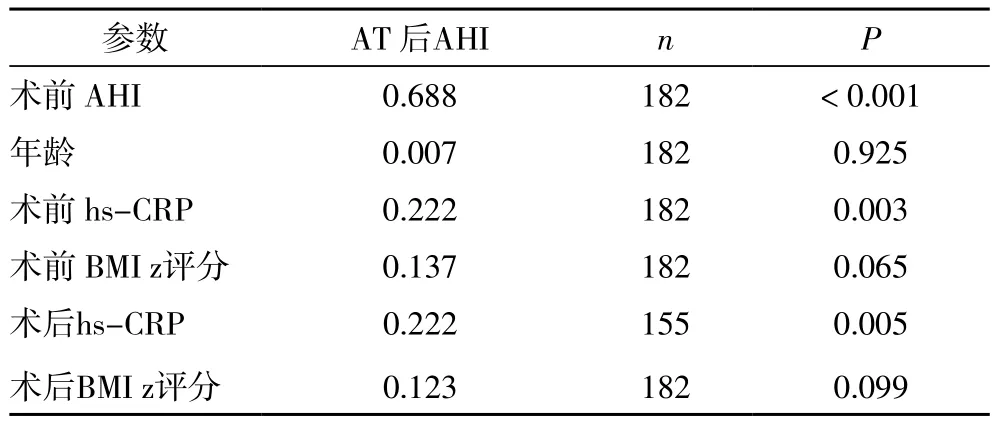
表3 已知干扰因素与术后AHI的相关性分析

图1 182例OSA患儿AT术后AHI指数情

图2 AT术前OSA严重程度与AT术前hs-CRP含量相关性分析
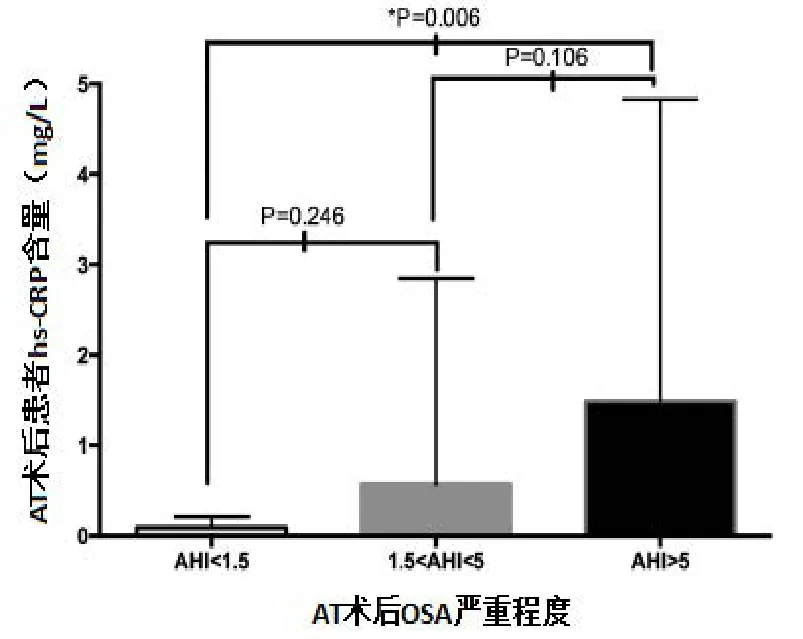
图3 AT术后OSA严重程度与AT术后hs-CRP含量相关性分析
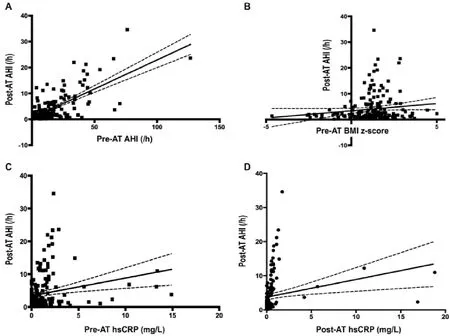
图4 AT术后AHI与术前AHI、术前BMIz评分、术前hs-CRP和术后hs-CRP相关性分析
2.3 多元回归分析 多元线性回归模型(表4)表明,控制AT术前AHI后发现,AT术后hs-CRP水平而非AT术前hs-CRP水平,与AT术后AHI显著相关(标准化β系数:0.133,P=0.024)。由于在先验假设中,肥胖会引起全身炎症反应,因此我们选择控制模型BMI Z评分。为完整性起见,尽管以冗余为代价,当所有的变量,AT术前AHI,AT术前hs-CRP水平,AT术前BMIZ评分,AT术后BMI Z评分都被保留在模型中,关联性后发现,AT术后hs-CRP和AT术后AHI的显著相关性不受到影响(标准化β系数:0.153,P=0.011)。
虽然在分层建模和控制AT术前AHI后,AT术前hs-CRP水平与AT术后AHI无统计学相关性,但是AT术前hs-CRP仍能预测中到重度残余嗜睡。OSA治愈患儿AT术前hs-CRP为0.67±1.15mg/L,而轻度残余嗜睡患儿为1.08±2.21mg / L(P=0.508);在中到重度残余嗜睡中,AT术前hs-CRP显著较高,达到2.95±0.44 mg/L(与OSA治愈相比,P=0.001;与轻度残余嗜睡相比,P=0.024)。然而,根据分层建模研究发现,这种关系可能受AT术前AHI驱动。
如图5A所示,ROC分析显示hs-CRP临界值>0.4mg/L,可以预测AT术后残余嗜睡(即AT术后AHI>5次/h TST),灵敏度为78.3%,特异性为89.7%[曲线下面积(AUC):0.819,P<0.0001]。当使用两种临界标准时,残余嗜睡预测得到进一步增强,即同时使用hs-CRP>0.4mg/L和AT术前AHI>10次/h TST,产生的灵敏度为76.1%,特异性为94.9%(AUC:0.876;P<0.0001;图5B)。
3 讨论
本研究表明,OSA患儿接受AT术后常发生残余嗜睡,AT术前AHI和AT术后hs-CRP水平有望作为残余嗜睡的生物标志物。目前AT术是OSA患者的一线治疗方案[8]。然而,与研究相似的是[9],本研究发现 AT术后并不能彻底有效根治OSA,特别是当OSA严重程度高等条件下。在这种情况下,本研究表明,AT术后3~24个月进行AT术后hs-CRP测定,能够有效预测残余嗜睡。
AT术后残余嗜睡患儿的理想生物标志物应该在所有受到影响的患者中存在(即高灵敏度和高特异性),并应在表现出明显临床特征前含量明显变化。使用生物标志物的最佳实践指南能够减少病患诊断残余嗜睡的总成本和负担,从而降低疾病的检测费用(生物标志物与PSG),并进一步降低与误诊相关的成本(例如,由于残余嗜睡增加的医疗服务[10])。基于这些考虑,充足的hs-CRP水平作为AT术后中度至重度残余嗜睡的生物标志物(即AT术后AHI>5/h TST)显示出可接受的特异性;换句话说,~90%AT术后hs-CRP>0.4mg/L的病患,会有残余嗜睡;如果既满足AT术前AHI大于10次/h TST,又满足AT术后hs-CRP>0.4mg/L,概率会增加到~ 95%。
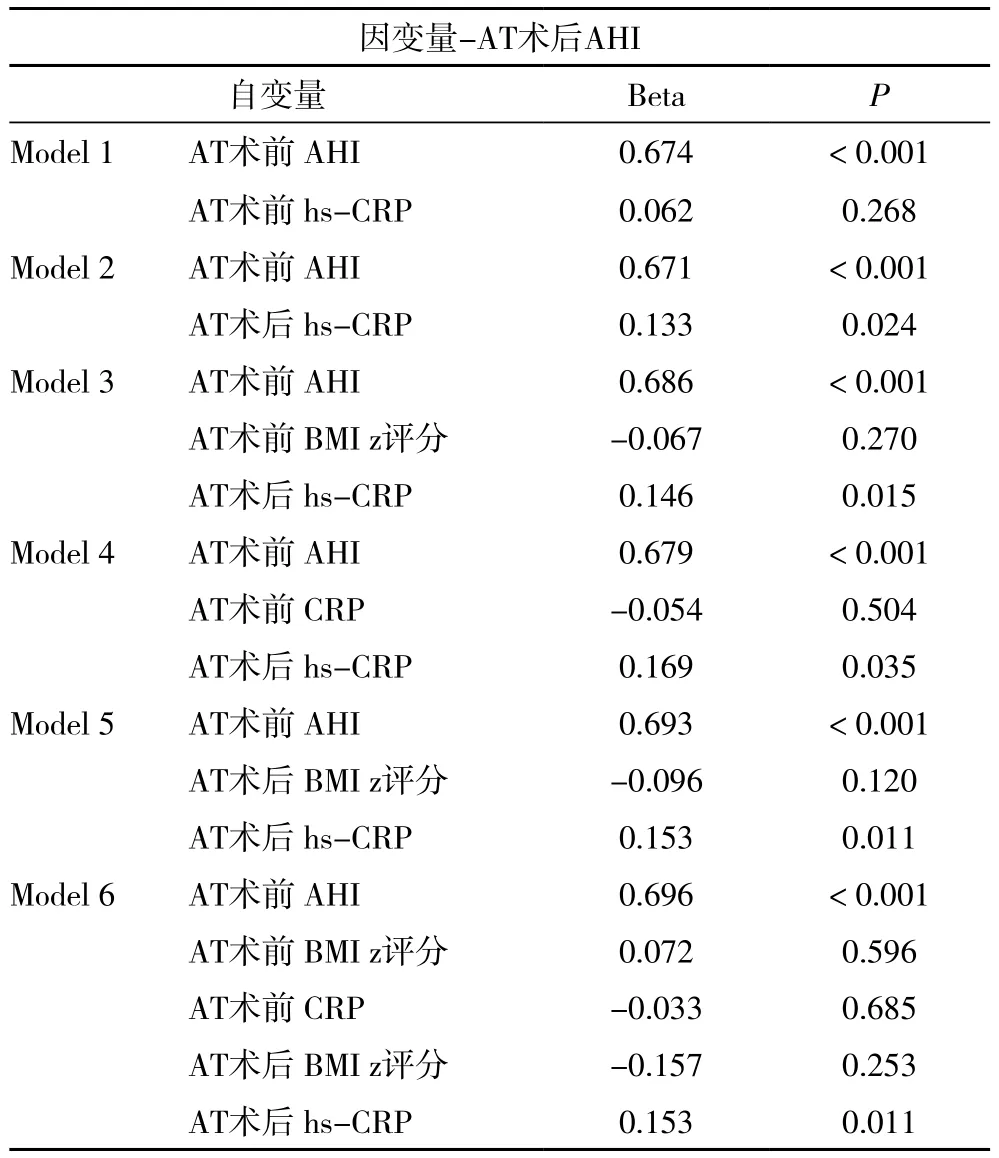
表4 以AT术后AHI作为因变量的多元线性回归分析
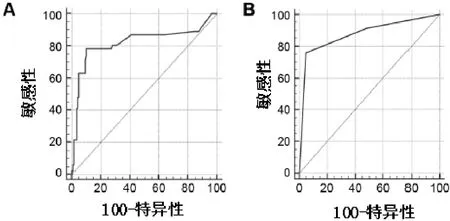
图5 ROC曲线分析hs-CRP预测AT术后残余嗜睡的特异性和敏感性
儿童肥胖会引起炎症状态,其与循环hs-CRP升高密切相关,大量的研究支持hs-CRP与不同年龄和不同民族儿童发生肥胖有关[11-13]。因此,测定hs-CRP和AT术后AHI,对于控制多元回归模型中BMI-Z得分十分重要。同样,虽然迄今为止有一定数量的研究支持hs-CRP与儿童OSA之间有相关性[14],但是几乎没有研究证实OSA治疗对这种生物标志物的影响。本研究证明hs-CRP与儿童OSA在某些方面具有相关性。首先,与以往的研究类似[15],本研究发现hs-CRP与AT术前AHI呈正相关关系。其次,OS患儿AT术后,hs-CRP含量显著下降。最后,本研究发现AT术后hs-CRP水平与AT术后AHI显著相关,即使控制了OSA潜在的严重程度(AT术前AHI)和肥胖(AT术前和AT术后BMI Z评分)。此外,AT术后hs-CRP与AT术后AHI后仍显著相关,但AT术前hs-CRP没有。因此,无论在AT术前是否有增加hs-CRP浓度的决定因素,hs-CRP升高超出0.4mg/L能有效预测AT术后AHI升高。虽然0.4mg/L的hs-CRP血浆值可以认为是微乎其微的,特别是在其他重要的炎症情况如脓毒症或自身免疫性疾病中,hs-CRP值<0.4mg/L被认为能可靠地预测出AT术后疾病被治愈,在超过85%的情况下,这个假设是正确的。
总之,腺样体扁桃体切除术是OSA患儿的一线治疗方案,但其疗效有差异。基于这一发现,AT术后hs-CRP检测是预测患儿残余嗜睡的有效生物标志物。
[1] 何权瀛, 王莞尔. 阻塞性睡眠呼吸暂停低通气综合征诊治指南 (基层版) [J]. 中国呼吸与危重监护杂志, 2015, 14(4): 398-405.
[2] 许志飞, 申昆玲. 儿童肥胖与阻塞性睡眠呼吸暂停/低通气综合征关系的新进展[J]. 中国实用儿科杂志, 2013, 28(1): 9-12.
[3] Melamed K H, Goldhaber S Z. Obstructive sleep apnea[J]. Circulation,2015, 132(6): e114-e116.
[4] 陈芳, 李晓艳. 扁桃体腺样体切除对儿童阻塞性睡眠呼吸暂停低通气综合征术后免疫功能的影响[J]. 临床耳鼻咽喉头颈外科杂志,2012, 26(7): 333-336.
[5] Brietzke SE, Katz ES, Roberson DW. Can history and physical examination reliably diagnose pediatric obstructive sleep apnea/hypopnea syndrome [J]. A systematic review of the literature. Otolaryngol Head Neck Surg ,2004, 131: 827–32.
[6] Marcus CL, Brooks LJ, Draper KA, et al. Diagnosis and management of childhood obstructive sleep apnea syndrome[J]. Pediatrics, 2012, 130:e714–55.
[7] Gozal D, Crabtree VM, Sans Capdevila O, et al. C-reactive protein,obstructive sleep apnea, and cognitive dysfunction in school-aged children [J]. Am J Respir Crit Care Med, 2007, 176: 188–93.
[8] 李大伟, 张庆丰, 宋伟. 低温等离子射频治疗儿童阻塞性睡眠呼吸暂停低通气综合征 768 例研究[J]. 临床耳鼻咽喉头颈外科杂志,2014, 28(7): 453-454.
[9] Marcus CL, Moore RH, Rosen CL, et al. A randomized trial of adenotonsillectomy for childhood sleep apnea [J]. N Engl J Med, 2013, 368:2366–76.
[10] Yoshida T, Kaneshi T, Shimabukuro T, et al. Serum C-reactive protein and its relation to cardiovascular risk factors and adipocytokines in Japanese children [J]. J Clin Endocrinol Metab, 2006, 91: 2133–7.
[11] Kheirandish-Gozal L, Capdevila OS, Tauman R, et al. Plasma C-reactive protein in nonobese children with obstructive sleep apnea before and after adenotonsillectomy [J]. J Clin Sleep Med, 2006, 2: 301–4.
[12] Nachalon Y, Lowenthal N, Greenberg-Dotan S, et al. Inflammation and growth in young children with obstructive sleep apnea syndrome before and after adenotonsillectomy [J]. Mediators Inflamm, 2014, 2014:146893.
[13] Quante M, Wang R, Weng J, et al. The effect of adenotonsillectomy for childhood sleep apnea on cardiometabolic measures [J]. Sleep, 2015,38: 1395–403.
[14] Chu L, Yao H, Wang B. Impact of adenotonsillectomy on highsensitivity C-reactive protein levels in obese children with obstructive sleep apnea[J]. Otolaryngol Head Neck Surg 2012, 147: 538–43.
[15] Kheirandish L, Goldbart AD, Gozal D. Intranasal steroids and oral leukotriene modifier therapy in residual sleep-disordered breathing after tonsillectomy and adenoidectomy in children [J]. Pediatrics, 2006, 117: e61–6.
C-reactive Protein as a Potential Biomarker of Residual Obstructive Sleep Apnea Following Adenotonsillectomy in Children
Ming Hao, Tian Ai-min, Liu Bing, Cheng Liang-jun
(Department of Otorhinolaryngology, The Central Hospital of Xuzhou City, Xuzhou 221009, China)
Objectives Adenotonsillectomy (AT) is first-line treatment for pediatric obstructive sleep apnea (OSA), with most children having improvements in polysomnography (PSG). However, many children have residual OSA following AT as determined through PSG. Identification of a biomarker of residual disease would be clinically meaningful to detect children at risk.We hypothesize serum high-sensitivity C-reactive protein (hs-CRP), an inflammatory biomarker, is predictive of residual OSA following AT.MethodsPSG was performed both preoperatively and postoperatively on children undergoing AT for the diagnosis of OSA. hs-CRP serum concentrations were determined in all children pre-AT, and in most children post-AT. Resolution of OSA after AT was defined by a post-AT apnea-hypopnea index (AHI) <1.5/h total sleep time (TST). Residual OSA was defined as a post-AT AHI>5/h TST, which is considered clinically significant.ResultsAT significantly improved the AHI from 15.9±16.4 to 4.1±5.3/h TST in 182 children. Of 182 children, residual OSA (post-AT AHI>5) was seen in 46 children (25%). Among children who had hs-CRP levels measured pre- and post-AT (n=155), mean hs-CRP levels pre-AT were 0.98±1.91 mg/L and were significantly reduced post-AT (0.63±2.24 mg/dL; P=0.011). Stratification into post-AT AHI groups corresponding to <1.5/h TST, 1.5/h TST<AHI<5/h TST, and AHI>5/h TST revealed post-AT hs-CRP levels of 0.09±0.12, 0.57±2.28, and 1.49±3.34 mg/L with statistical significance emerging comparing residual AHI>5/h TST compared to post-AT AHI<1.5/h TST(P=0.006). Hierarchical multivariate modeling confirmed that ATpre-AT AHI and post-AT hs-CRP levels were most significantly associated with residual OSA.ConclusionEven though AT improves OSA in most children, residual OSA is frequent.Assessment of post-AT hs-CRP levels emerges as a potentially useful biomarker predicting residual OSA.
c-reactive protein; obstructive sleep apnea; adenotonsillectomy; biomarker
R587.1;R766
A
1673-016X(2017)06-0025-06
2017-07-14
徐州市中心医院硕士创新团队科技项目(NO.XZS201614)
程良军,E-mail:chengliangjun_xz@163.com

