含蔗糖体系CO2水合物生成与分解
陈 硕,俞冬梅,王树立,赵书华,吕晓方,郭 燕
(常州大学 石油工程学院,江苏 常州 213016)
含蔗糖体系CO2水合物生成与分解
陈 硕,俞冬梅,王树立,赵书华,吕晓方,郭 燕
(常州大学 石油工程学院,江苏 常州 213016)
采用蔗糖作为抑制剂,利用可视化高压反应釜实验装置,研究了不同含量的蔗糖溶液体系对CO2水合物生成和分解过程的影响,并分析了体系中由于蔗糖的存在对CO2水合物的生成起到抑制作用、分解起到促进作用的微观机理。实验结果表明,25%(w)蔗糖溶液体系抑制生成效果最佳,生成水合物的CO2气体消耗量相比蒸馏水体系降低了68.76%;5%(w)的蔗糖溶液体系对水合物的分解促进效果最佳,CO2生成速率曲线峰值最大,相比蒸馏水体系增长了82%,水合物分解反应活化能为70.48 kJ/mol。蔗糖抑制水合物生成和促进分解的微观机理主要是由于蔗糖分子的多羟基结构影响水分子间氢键的作用,阻碍形成水合物结构及减少解构所需的能量。
蔗糖;CO2水合物;抑制剂;微观机理
水合物是由水和客体分子在低温和高压的条件下形成的非化学计量性类冰状晶体。CO2输送管线及油气输送管线中的CO2分子和水易形成稳定的水合物,会阻塞阀门、破坏设备甚至造成管道冰堵,在造成经济损失的同时带来潜在的安全问题[1],是油气工业流动安全保障面临的严峻挑战。常见的水合物防治技术主要包括脱水、加热、降压和注抑制剂等,其中注抑制剂的方法是防治天然气水合物的有效途径[2-4]。
长期以来国内外众多的专家学者都在研究各种类型的抑制剂对水合物生成或分解的影响。传统的盐类和醇类热力学抑制剂[5-8],虽然抑制效果良好,但很难克服其重复利用价值低、用量大、对人体及环境和设备有危害等缺陷。因此,开发新型高效及环境友好型水合物抑制剂是当前研究的热点[9-14]。Ferrari等[9]研究了乙醇对二氧化碳水合物生成的抑制效果,测定了相平衡压力并建立了预测模型。蔗糖是一种碳水化合物,广泛存在于各种植物内,分子式为C12H22O11,作为多羟基的极性化合物,分子结构中含有许多羟基,极易与水分子形成氢键,会阻碍水合物的生成。Sm ith等[12]研究了蔗糖对制冷剂水合物分解的影响,结果表明蔗糖对制冷剂水合物的分解起到了促进作用;Viliano等[13]研究了离子液体对水合物生成的影响,结果表明离子液体具有动力学和热力学两方面的抑制效果。
本工作采用蔗糖作为抑制剂,利用可视化高压反应釜实验装置,研究了不同含量的蔗糖溶液体系对CO2水合物生成和分解过程的影响,并分析了体系中由于蔗糖的存在对CO2水合物的生成起到抑制作用、分解起到促进作用的微观机理。
1 实验部分
1.1 实验材料
蔗糖:分析纯,江苏强盛功能化学股份有限公司;CO2:纯度大于99.0%(φ),常州市京华工业气体有限公司;蒸馏水:实验室自制。
1.2 实验装置
采用高压反应釜研究水合物的生成与分解,工作压力0~20 MPa,工作温度-5~90 ℃,釜内容积500 m L,搅拌转速0~1 500 r/m in。
1.3 实验步骤
分别配制蔗糖含量(w)为5%,10%,15%,20%,25%的溶液。蒸馏水清洗反应釜2~3次,再用CO2气体冲洗反应釜2~3次(以保证釜内没有空气),泄压至0 MPa,设定水浴温度为2 ℃。向反应釜中注入200 m L已配制好的蔗糖溶液或蒸馏水,当反应釜内温度降至2 ℃后打开进气阀,快速通入CO2气体,反应釜内压力达到实验初始压力3 MPa后,关闭进气阀停止进气。开启搅拌器并设定转速为600 r/min,以加快CO2水合物生成,通过水浴和反应釜的视窗观察CO2水合物生成情况。压力稳定后持续1 h,控制水浴以2 ℃/h的速率升温,促使各体系下的水合物在相同的压力驱动力和温度驱动力下开始等容分解。采用数据采集系统,记录实验过程中压力和温度的变化情况。为了减少实验过程中产生误差和排除实验的偶然性,上述每组实验均重复3次。
2 结果与讨论
2.1 含蔗糖体系中CO2水合物生成和分解过程
图1为CO2水合物生成过程中压力随时间变化曲线。由图1可知,0~50 min区域为CO2气体在溶液中溶解和水合物生成前的诱导期,压力曲线在该区域内未出现水平发展段,这可能是搅拌转速设定偏高和实验温度偏低的原因,导致水合物生成过快。但诱导期时间未能超过CO2气体在溶液中溶解至饱和所需的时间。在50 m in时观测到在靠近搅拌器的气液界面处出现白色絮状物(如图1 a所示),随着搅拌器高速旋转的同时逐渐聚集成颗粒状,同时在气相中的视窗内壁处也出现了水合物的结晶。50~700 m in区域为水合物从开始生成(图1 b)到反应完全稳定(图1c)期。700 min后开始以2 ℃/h速率升温,升温5 m in后水合物开始分解,分解过程初期通过观察视窗拍摄到的照片(图1 d)发现,近壁处的水合物首先分解,并产生大量气泡,之后水合物由外向内快速分解。
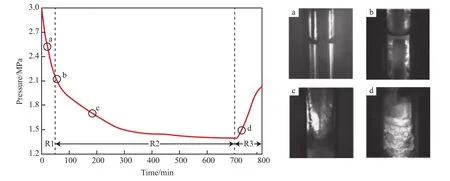
图1 CO2水合物生成过程压力随时间变化曲线Fig.1 The pressure changing with time of CO2 hydrate formation process.
2.2 蔗糖对CO2水合物生成过程的影响
根据上述CO2水合物生成实验中采集到的压力变化数据和恒温的生成条件,用Van der Waals实际气体状态方程[15]计算得到水合物生成过程中CO2的气体消耗总物质的量(n),见式(1)。

由式(1)计算得到的各个时刻对应n的组成见式(2)。

式中,nfh为生成水合物消耗的CO2的物质的量,mol;ns为溶解于溶液或蒸馏水中消耗的CO2的物质的量,mol。
因为水合物的分解是生成过程的逆过程[16],根据质量守恒定理,nfh应等于分解水合物消耗的CO2的物质的量(ndh),见式(3)。

则有:

式中,ndh可由分解实验数据得出,计算得到本工作各体系中的ns相差不大,因此ns取平均值,为0.18 mol。
图2为n随时间变化曲线。
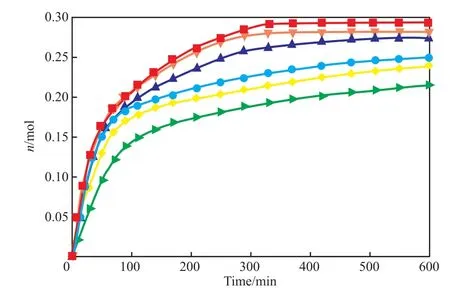
图2 n随时间变化曲线Fig.2 CO2 gas consumption(n) changing curve with time.
由图2可知,随着体系中蔗糖含量增加,曲线不断下移,这表明n在降低。对于25%(w)的蔗糖溶液体系,在600 min时n = 0.215 3 mol,由式(2)计算得到nfh为0.035 3 mol;在600 min时蒸馏水体系中的n = 0.293 0 mol,计算得nfh= 0.113 0。由此可见,25%(w)的蔗糖溶液体系nfh相比蒸馏水体系降低了68.76%,表明了体系中生成的CO2水合物的量也减少了,25%(w)的蔗糖溶液体系抑制生成效果最佳。
2.3 蔗糖对CO2水合物分解过程的影响
水合物分解是水合物晶体表面的笼型结构解构并释放出客体分子的过程,因此可用分解产生CO2的速率来表示水合物的分解速率。根据上述实验中采集到的压力和温度变化数据,由式(1)和式(2)计算得到水合物分解过程中的ndh,则气体生成速率(v)见式(5)。

采用Origin软件,并选用拟合方程Polynomial中的Poly方程进行非线性拟合得到拟合曲线,见图3。
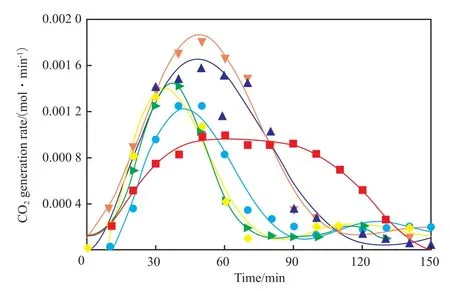
图3 CO2生成速率随时间变化曲线Fig.3 CO2 generation rate changing curve with time.
由图3可知,各体系中水合物分解过程中CO2的生成速率随时间的变化呈现先增后减的趋势,这是因为一开始温度的升高使得温度驱动力增大,分解速率随着温度驱动力的增加而增加,但随着分解反应的进行,体系的压力也在升高,所以压力驱动力随时间减小,当体系压力超过平衡压力后就会对分解反应起到抑制作用,当两种作用相互抵消时就达到了曲线的峰值,之后在压力随时间升高产生的抑制作用下,水合物分解速率逐渐减慢。曲线的峰值代表了水合物分解过程中CO2生成速率的最大值,说明该时刻对应的水合物分解速率达到了最大值。所有曲线中峰值最大的曲线是蔗糖含量为5%(w)的CO2生成速率曲线,相比较于蒸馏水体系的CO2生成速率峰值增长了82%,其余含蔗糖体系的曲线峰值也均大于蒸馏水体系下的曲线峰值。由此可见,体系中蔗糖的存在对CO2水合物的分解有促进作用,5%(w)的蔗糖体系对水合物的分解效果最佳。
2.4 蔗糖影响CO2水合物生成与分解的微观机理
图4为蔗糖分子结构图。作为多羟基的极性化合物,蔗糖分子结构中有许多羟基,与水分子以氢键相连接,成为结合水,因而体系中蔗糖的存在使得部分自由水转化为结合水。而水合物的形成过程是由体系中的水分子先以氢键连接形成体心立方结构的水合物晶体的框架,再由CO2分子进入已形成的框架的空腔中,使该结构脱离亚稳定状态形成稳定的水合物晶体的结构。虽然蔗糖分子和水分子及水分子之间形成的都是氢键,但蔗糖分子和水分子形成的氢键的另一端链接有一个sp3杂化的C原子,这样形成的CO—H键的键长要比水分子间形成的HO—H键的键长更短,键长短代表这样形成的化学键更稳定,这意味着已形成的CO—H键不会自主地向HO—H键转变,即体系中蔗糖分子的存在使得一部分自由水转变为结合水,减少了能形成水合物的自由水的量。除了通过影响水的活度来影响CO2水合物的形成外,体系中蔗糖的存在还会增大溶液的表面张力,表面张力越大,CO2分子从气相中进入液相就越困难,体系中蔗糖的存在通过影响溶液的表面张力从而影响了气液界面处气相的传质能力,减少了进入液相的CO2分子的量。
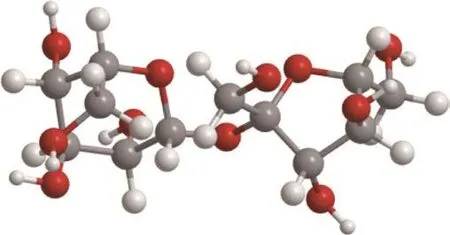
图4 蔗糖分子结构图Fig.4 Sucrose molecule structure.
分解过程包括笼形结构的解构及客体分子由笼形表面的解吸,这需要有足够的能量使分子振动,以克服范德华力,从而破坏氢键。水合物分解反应活化能(Ea)表示了水合物分解所需的最低能量。
由于分解过程中一直保持匀速搅拌,所以传质的影响可忽略,选用孙长宇等[17]建立的水合物分解速率方程式(6)。

式中,nH为水合物中气体的物质的量,mol;k′为表观分解速率常数,m in-1。
水合物分解过程中产生的气体的量应该等于水合物中的气体减少的量,见式(7)。

可得式(8)。

水合物分解推动力与k′呈线性关系,见式(9)。
在医药卫生体制改革建议当中,对于公立医院构建现代管理会计体系提出了极高的要求,在相关政策与改革意见的大力推动下,公立医院必须要结合改革实践对现有的组织结构进行有效调整,尽快构建起独立而专业的队伍,从而使得医院改革实践中的整体运行情况以及资源配置得到统筹,所以公立医院必须要大力推行总会计师制度,从而促进全新医药卫生体制改革的要求,实现公立医院财务管理组织的进一步完善。在落实相关部署与政策要求的过程中,应该逐步实现总会计师制度与精细化管理的有机结合,有效发挥财务组织的管理优势,进而提高管理效率。

式中,k为分解速率常数,min-1;fe为相平衡条件下的气体逸度,MPa;f为水合物晶体表面的气体逸度,MPa。不同实验体系的相平衡条件用软件Aspen HYSYS模拟得到。
k与水合物分解所需的Ea的Arrhenius方程见式(10)。

式中,k0为水合物的本征分解速率常数,min-1;R为摩尔气体常数,J/(mol·K)。
利用实验数据对式(10)进行线性拟合得到蒸馏水体系下的水合物分解Ea= 76.86 kJ/mol,5%(w)蔗糖溶液体系分解效果最好,水合物分解Ea=70.48 kJ/mol,所以体系中蔗糖的存在降低了CO2水合物分解所需的Ea,起到了促进分解的作用。
综上所述,体系中蔗糖的存在对CO2水合物的生成起到抑制作用,对分解起到促进作用。
3 结论
1)体系中蔗糖的存在对CO2水合物生成过程起到抑制作用,能减少整个过程中的压降和耗气量,25%(w)蔗糖溶液体系nfh相比蒸馏水体系降低了68.76%,表明了体系中生成的CO2水合物的量也减少了,25%(w)蔗糖溶液体系抑制生成效果最佳。
2)5%(w)蔗糖溶液体系的CO2生成速率曲线峰值最大,相比蒸馏水体系的CO2生成速率峰值增长了82%,其余含蔗糖体系的曲线峰值也均大于蒸馏水体系下的曲线峰值。由此可见,体系中蔗糖的存在对CO2水合物的分解有促进作用,5%(w)的蔗糖溶液体系对水合物的分解效果最佳,水合物分解Ea= 70.48 kJ/mol。
3)蔗糖抑制水合物生成和促进分解的微观机理主要是由于其分子的多羟基结构影响水分子间氢键的作用,阻碍形成水合物结构和减少其解构所需的能量。以蔗糖作为水合物抑制剂效果良好,且经济环保。
符 号 说 明
Ea反应活化能,kJ/mol
f 水合物晶体表面的气体逸度,MPa
fe相平衡条件下的气体逸度,MPa
k 分解速率常数,m in-1
k0水合物的本征分解速率常数,min-1
k′ 表观分解速率常数,min-1
n CO2的气体消耗总物质的量,mol
ndh分解水合物消耗的CO2的物质的量,mol
nfh生成水合物消耗的CO2的物质的量,mol
nH水合物中气体的物质的量,mol
ns溶解于溶液或蒸馏水中消耗的CO2的物质的
量,mol
p 气相压力,Pa
R 摩尔气体常数,J/(mol·K)
T 气相温度,K
V 摩尔体积,m3/mol
VG反应釜内气相体积,m3
Vt1t1时刻对应的摩尔体积,m3/mol
Vt2t2时刻对应的摩尔体积,m3/mol
v 气体的生成速率,mol/min
[1] Sloan D,Koh C,Sum A K,et al. Natural gas hydrates in flowassurance[M].New York:Elsevier Inc,2011:1-11.
[2] 樊栓狮,王燕鸿,郎雪梅. 天然气水合物动力学抑制技术研究进展[J].天然气工业,2011,31(12):99-109.
[3] 赵欣,邱正松,黄维安,等. 天然气水合物热力学抑制剂作用机制及优化设计[J].石油学报,2015,36(6):760-766.
[4] 毕曼,贾增强,吴红钦,等. 天然气水合物抑制剂研究与应用进展[J].天然气工业,2009,29(12):75-78.
[5] Lü Qiunan,Li Lu,Li Xiaosen,et al. Clathrate hydrate dissociation conditions and structure of the methane+cyclopentane+t rimethylene sulfide hydrate in NaCl aqueous solution[J].Fluid Phase Equilib,2016,425:305-311.
[6] Kim H,Park J,Seo Y,et al. Hydrate risk management with aqueous ethylene glycol and electrolyte solutions in thermodynam ically under-inhibition condition[J].Chem Eng Sci,2017,158:172-180.
[7] Xu Shurui,Fan Shuanshi,Yao Haiyuan,et al. The phase equilibria of multicomponent gas hydrate in methanol/ethylene glycol solution based formation water[J].J Chem Thermodyn,2017,104:212-217.
[8] 李栋梁,唐翠萍,梁德青,等. 天然气水合物抑制过程中甲醇用量的影响[J].石油化工,2009,38(12):1292-1296.
[9] Ferrari P F,Guembaroski A Z,Moises A,et al. Experimental measurements and modelling of carbon dioxide hydrate phase equilibrium with and without ethanol[J].Fluid Phase Equilib,2016,413:176-183.
[10] 臧小亚,梁德青,樊栓狮. 3A型分子筛对四氢呋喃水合物分解的影响[J].制冷学报,2007,28(6):29-34.
[11] 臧小亚,梁德青,樊栓狮,等. 5A分子筛粉末对四氢呋喃水合物的生成及分解过程的影响[J].物理化学学报,2009,25(6):1047-1052.
[12] Sm ith A,Babaee S,Am ir H,et al. Clathrate hydrate dissociation conditions for refrigerant+sucrose aqueous solution:Experimental measurement and thermodynam ic modelling[J].Fluid Phase Equilib,2016,413(1):99-109.
[13] Viliano L D,Kelland M A. An investigation into the kinetic hydrate inhibitor properties of two im idazolium-based ionic liquids on structure Ⅱ gas hydrate[J].Chem Eng Sci,2010,65(19):5366-5372.
[14] 马维俊,周诗岽,王树立,等. 离子液体BM IM-Cl对甲烷水合物生成抑制的实验研究[J].天然气化工,2013,38(6):30-33.
[15] 代文杰,王树立,饶永超,等. 氧化石墨烯作为新型促进剂加速CO2水合物生成实验[J].天然气工业,2016,36(11):83-88.
[16] 陈光进,孙长宇,马庆兰. 气体水合物科学与技术[M].北京:化学工业出版社,2007:119.
[17] 孙长宇,马昌峰,陈光进,等. 二氧化碳水合物分解动力学研究[J].中国石油大学学报:自然科学版,2001,25(3):8-10.
The experimental study of CO2hydrate formation and dissociation with sucrose
Chen Shuo,Yu Dongmei,Wang Shuli,Zhao Shuhua,Lü Xiaofang,Guo Yan
(School of Petroleum Engineering,Changzhou University,Changzhou Jiangsu 213016,China)
The effects of sucrose on CO2hydrate formation and dissociation as hydrate inhibitor were studied by using the high-pressure reactor. We explored its m icroscopic mechanism of inhibiting hydrate formation and promoting dissociation in sucrose system. It is shown that 25%(w) of sucrose has the best inhibiting eff ect of hydrate formation. Compared with the formation experiment of CO2hydrate in distilled water,the gas consumption can be reduced by 68.76%. The optimum concentration for promoting dissociation is 5%(w). The peak of CO2generation rate can increase 82% compared to distilled water. The reaction activation energy of hydrate dissociation is 70.48 kJ/mol. The mechanism of inhibiting formation and promoting dissociation is chiefly because of the polyhydroxy structure of sucrose,it can eff ectively infl uence hydrogen bonding interaction between water molecules,hinder the formation of hydrate structure and reduce the energy required for its deconstruction.
sucrose;CO2hydrate;inhibitor;m icroscopic mechanism
1000-8144(2017)09-1156-05
TE 88
A
2017-02-28;[修改稿日期]2017-05-26。
陈硕(1992—),男,浙江省丽水市人,硕士生,电话 18815288689,电邮 544607969@qq.com。联系人:王树立,电话13813698610,电邮 wsl@cczu.edu.cn。
国家自然科学基金项目(51574045);江苏省研究生培养创新工程项目(SJLX16_0469);常州市科技计划项目(CJ20160041)。
10.3969/j.issn.1000-8144.2017.09.010
(编辑 杨天予)

