丙酮酸脱氢酶复合体E2亚基通过活化Toll样受体4影响单核细胞分泌细胞因子
杨再兴,梁艳,刘东红,张治宇,仲人前
(1.台州市第一人民医院 检验科,浙江 台州 318020;2.上海长征医院 实验诊断科,上海 200003;3.上海长征医院 贵宾科,上海 200003)
丙酮酸脱氢酶复合体E2亚基通过活化Toll样受体4影响单核细胞分泌细胞因子
杨再兴1,梁艳2,刘东红1,张治宇3,仲人前2
(1.台州市第一人民医院 检验科,浙江 台州 318020;2.上海长征医院 实验诊断科,上海 200003;3.上海长征医院 贵宾科,上海 200003)
目的:探讨丙酮酸脱氢酶复合体E2亚基(PDC-E2)是否可以活化Toll样受体4(TLR4)-NF-κB通路,并通过该通路诱导单核细胞分泌肿瘤坏死因子α(TNF-α)、白介素12(IL-12)和可溶性肿瘤坏死因子相关凋亡诱导配体(sTRAIL)。方法:培养单核细胞株U937,分为空白对照组、PDC-E2组、PDC-E2+HTA125组和PDCE2+PDTC组。空白对照组不予任何刺激;PDC-E2组予2、10和50 μg/mL的PDC-E2刺激;PDC-E2+HTA125组予10 μg/mL的TLR4功能抑制抗体HTA125孵育4 h后,再加入50 μg/mL的PDC-E2;PDC-E2+PDTC组加入100 nmol/mL的NF-κB抑制剂PDTC 0.5 h后,再加入50 μg/mL的PDC-E2。通过流式细胞术检测TLR4表达,EMSA实验检测NF-κB活化情况,ELISA法检测培养上清TNF-α、IL-12和sTRAIL浓度。结果:2、10和50 μg/mL浓度PDC-E2刺激U937细胞24 h,TLR4表达均明显增加,但无浓度依赖性。浓度为50 μg/mL的PDC-E2刺激U937细胞1 h,NF-κB即显著活化;至2 h,活化逐渐减少;至4 h,已明显减少。加入HTA125后,NF-κB活性较阻断前显著降低。浓度为50 μg/mL的PDC-E2刺激U937细胞24 h,培养上清TNF-α和sTRAIL的浓度显著高于空白对照组(P<0.05),IL-12与空白对照组比差异无统计学意义;至48 h和72 h,TNF-α、IL-12和sTRAIL的浓度均显著高于空白对照组(P<0.05)。加入HTA125或PDTC后,各时间点3种细胞因子的浓度均较阻断前显著降低(P<0.05)。结论:PDC-E2可以活化TLR4-NF-κB通路,并通过该通路刺激单核细胞分泌细胞因子TNF-α、IL-12和sTRAIL。
丙酮酸脱氢酶复合体;Toll样受体4;核因子;细胞因子;原发性胆汁性胆管炎
Abstract: Objective:To explore whether pyruvate dehydrogenase complex E2 subunit (PDC-E2) may activate Toll-like receptor 4 (TLR4)-NF-κB pathway and induce secretion of tumor necrosis factor-α (TNF-α),interleukin-12 (IL-12) and TNF-related apoptosis-inducing ligand (sTRAIL).Methods:PDC-E2 was used to stimulate monocyte line U937, combined with HTA125 (an inhibitory antibody of TLR4) and PDTC (an inhibitor of NF-κB). The study groups included control group, PDC-E2 group, PDC-E2+HTA125 group and PDCE2+PDTC group. TLR4 on U937 was detected by flow cytometry, activity of NF-κB was determined by EMSA,TNF-α, IL-12 and sTRAIL were measured by ELISA.Results:At 24 h after stimulation by 2, 10 and 50 μg/mL of PDC-E2, TLR4 expression on U937 cell was significantly increased. At 1 h after stimulation by 50 μg/mL of PDC-E2, NF-κB was markedly activated, while at 2 h, the activation of NF-κB was gradually decreased and at 4 h, the decrease was very significant. NF-κB activity was significantly decreased after HTA125 addition compared with that before. At 24 h after stimulation by 50 μg/mL of PDC-E2, supernant TNF-α and sTRAIL levels were significantly higher than that of control, while IL-12 level was of no significant difference. At 24 h and 48 h, the levels of TNF-α, IL-12 and sTRAIL were all significantly higher than that of control. The three cytokines were significantly lower after addition of HTA125 or PDTC than before.Conclusion:PDC-E2 can activate TLR4-NF-κB pathway, by which PDC-E2 stimulates the secretion of TNF-α, IL-12 and sTRAIL by monocyte.
Key words:pyruvate dehydrogenase complex; Toll-like receptor 4; nuclear factor; cytokine; primary biliary cholangitis
原发性胆汁性胆管炎(primary biliary cholangitis,PBC)是一种以肝内门管区中小胆管炎症性损伤为主要表现的慢性自身免疫性肝病,其病因和发病机制未明。该疾病的特征性标志是血清抗线粒体抗体阳性,该抗体的靶抗原主要是丙酮酸脱氢酶复合体E2亚基(pyruvate dehydrogenase complex E2 subunit,PDC-E2)。研究发现,PDC-E2抗原特异性T淋巴细胞可能在PBC的发病过程中发挥重要作用[1]。PDC-E2抗原通过抗原递呈细胞如树突状细胞、单核巨噬细胞等递呈给T细胞,引起后者活化,而发挥作用。研究证实,在PBC的肝组织门管区存在大量单核巨噬细胞的浸润[2-4],但PDC-E2对单核巨噬细胞本身有何生物学作用目前尚不明确。因此,本研究探讨PDC-E2对单核细胞Toll样受体4(Toll-like receptor 4,TLR4)的表达,转录因子NF-κB活化,TNF-α、IL-12、可溶性肿瘤坏死因子相关凋亡诱导配体(soluble tumor necrosis factor related apoptosis-inducing ligand,sTRAIL)分泌的影响,以及TLR4通路及NF-κB对PDC-E2上述生物学功能的调节作用。
1 材料和方法
1.1 主要试剂 PE-Cy5标记鼠抗人TLR4单抗和抗TLR4功能阻断性单抗HTA125(eBioscience,美国);NF-κB抑制剂吡咯烷二硫氨基甲酸(pyrrolidine dithiocarbamate,PDTC)(Sigma,美国);TNF-α和IL-12 ELISA检测试剂盒(Bender,美国);sTRAIL ELISA检测试剂盒(Diaclone,法国);NF-κB活性检测试剂盒(Active Motif,美国);胎牛血清、RPMI1640培养基(Gibco,美国);75 mL细胞培养瓶、6或24孔细胞培养板(Corning,美国);细胞核蛋白抽提试剂盒(Pierce,美国);电泳迁移率阻滞试验(electrophoretic mobility shift assay,EMSA)探针标记试剂盒(Roche,德国)。PDC-E2为上海富纯中南生物技术公司(现更名为上海科新生物技术股份有限公司)惠赠,并且已应用ThermoSCIENTIFIC Pierce公司的Detoxi-GelTM Endotoxin Removing Gel去除了其中的内毒素(含量低于10 pg/mL);U937细胞为上海长征医院耿红莲博士惠赠。
1.2 主要仪器 流式细胞仪(美国Beckman Coulter公司);KUBOTA 5420台式高速离心机(日本Kubota公司);550型酶联免疫检测仪和水平电泳仪(美国Bio-Rad公司);721型紫外分光光度仪(美国Beckman Coulter公司)。
1.3 方法
1.3.1 U937细胞培养及PDC-E2刺激:U937细胞株培养在含10%胎牛血清、100 IU/mL青霉素、100 IU/mL链霉素的RPMI1640培养液中,置于37 ℃、5%的CO2孵箱中培养传代。选取第3代细胞,以每孔5×105的浓度,接种至24孔板,待细胞同步化后,进行下述实验:①分别加入2、10和50 μg/mL的PDC-E2,相同条件设3复孔,并以培养基为对照。24 h后,收集细胞,检测细胞TLR4的表达。②加入10 μg/mL的HTA125,孵育4 h后,再加入50 μg/mL的PDC-E2,分别于24、48和72 h后收集培养上清用于细胞因子浓度检测。③加入10 μg/mL的HTA125,孵育4 h后,再加入50 μg/mL的PDC-E2,分别于1、2和4 h后,收集细胞,抽提核蛋白,EMSA法检测NF-κB活性。④加入100 nmol/mL的PDTC,0.5 h后,加入50 μg/mL的PDC-E2,分别于24、48和72 h后收集培养上清用于细胞因子浓度检测。
1.3.2 TLR4表达检测:以PE-Cy5标记鼠抗人TLR4单抗,采用流式细胞仪检测U937细胞TLR4表达水平。操作按流式细胞仪检测流程进行。
1.3.3 NF-κB活性检测:抽提核蛋白,EMSA法检测核蛋白NF-κB活性,操作按试剂盒说明进行,其中标记的探针序列如下:正义序列5’-AGTTGAGGGGACT TTCCCAGGC-3’,反义序列5’-GCCTGGGAAAGTCCCCTCA ACT-3’,以地高辛标记。
1.3.4 细胞因子浓度检测:采用ELISA法检测细胞因子TNF-α、IL-12和sTRAIL的浓度,操作按试剂盒说明进行。
1.4 统计学处理方法 所有数据采用SPSS13.0进行统计。计量资料以 ±s表示,多组间比较采用两因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 PDC-E2对U937细胞TLR4表达的调节作用 单核细胞系U937细胞在无任何刺激的情况下即表达TLR4,其阳性表达率为33.99%±0.33%。浓度为2 μg/mL的PDC-E2刺激24 h,TLR4阳性表达率有显著增高(为44.89%±3.43%)(P<0.05),PDC-E2浓度增加至10 μg/mL和50 μg/mL时,TLR4阳性表达率分别为44.28%±0.43%和46.24%±1.65%,与2 μg/mL刺激相比无明显增加(P>0.05),见图1。对荧光强度进行分析显示,在无任何刺激的情况下,TLR4平均荧光强度为1.61±0.05,浓度为2、10、50 μg/mL的PDC-E2刺激24 h后,TLR4平均荧光强度分别为1.74±0.01、1.77±0.02和1.85±0.10,均较刺激前明显增加,但3种浓度之间差异无统计学意义(F=2.491,P>0.05)。
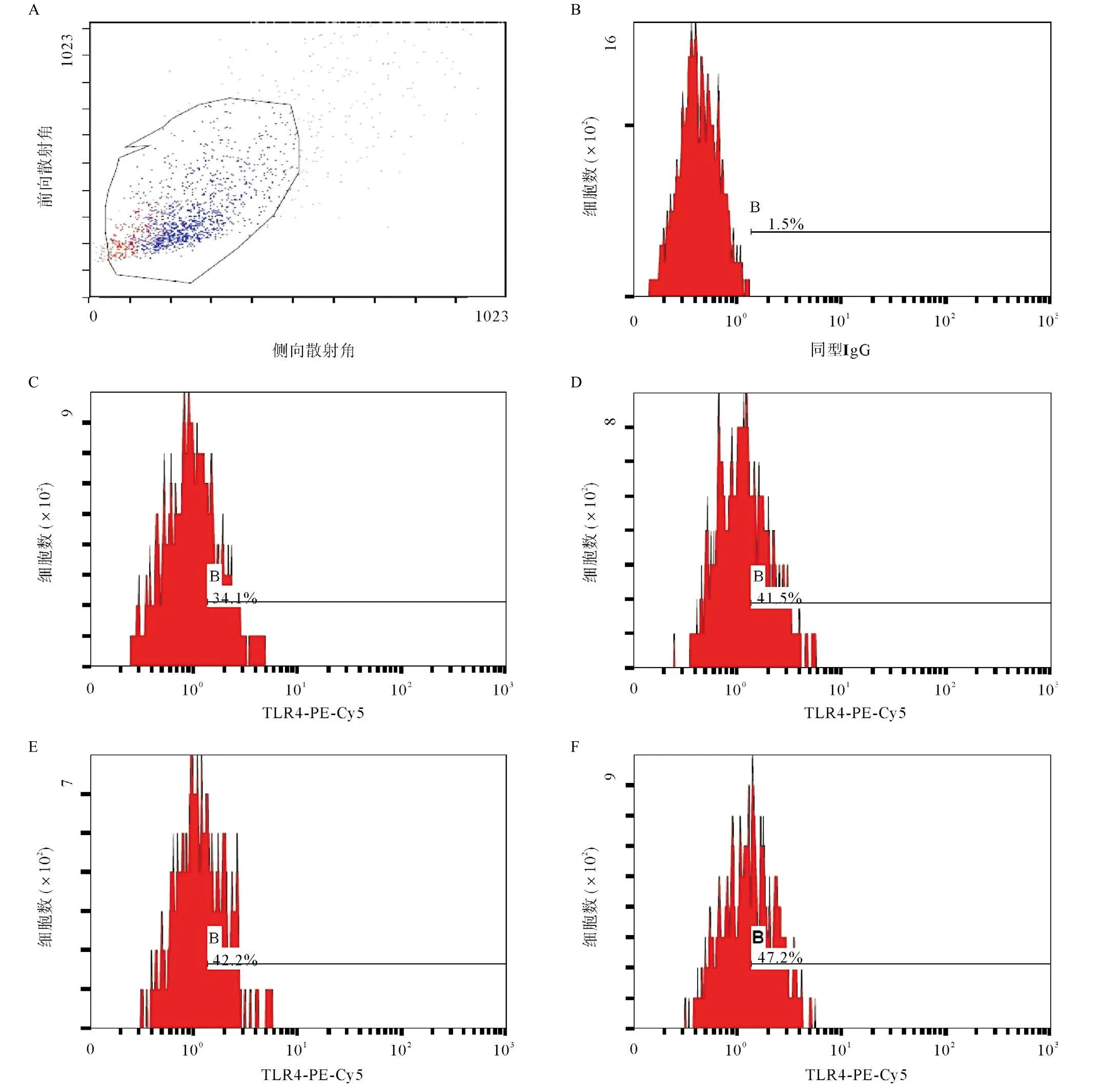
图1 不同浓度PDC-E2对U937细胞TLR4阳性表达的影响
2.2 HTA125阻断TLR4活性对NF-κB活性的影响
EMSA检测结果显示,在无任何刺激情况下,U937细胞核内未检测到具有结合DNA活性的NF-κB;浓度为50 μg/mL的PDC-E2刺激U937细胞1 h,细胞核内具有结合DNA活性的NF-κB即显著增加;至2 h,又逐渐减少;至4 h,已明显减少。应用HTA125抑制TLR4功能后,再以浓度为50 μg/mL的PDC-E2刺激U937细胞1、2和4 h,细胞核内具有结合DNA活性的NF-κB较阻断前显著减少,尤其是刺激4 h时,细胞核内已基本检测不出具有结合DNA活性的NF-κB。见图2。
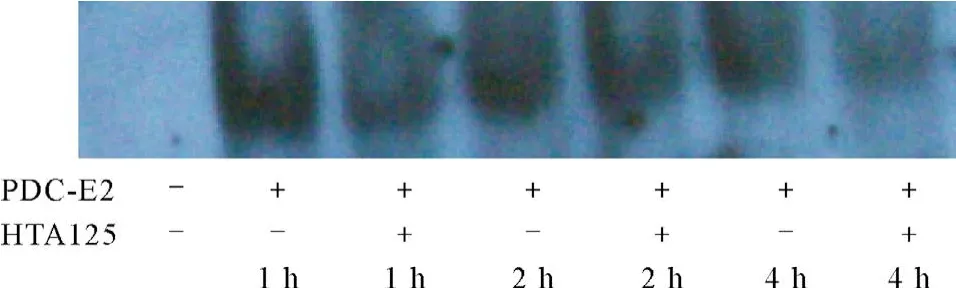
图2 EMSA法检测不同时间点不同干预措施下细胞核内NF-κB结合DNA活性
2.3 应用HTA125抑制TLR4功能或PDTC抑制NF-κB活性前后,PDC-E2对U937细胞分泌细胞因子TNF-α、IL-12和sTRAIL的调节作用 浓度为50 μg/mL的PDC-E2刺激U937细胞24 h,培养上清中TNF-α和sTRAIL的浓度显著高于空白对照组(P<0.05),IL-12与空白对照组比较差异无统计学意义(P>0.05);至48 h,TNF-α、IL-12和sTRAIL的浓度均较24 h和空白对照组显著增加(P<0.05);至72 h,TNF-α和sTRAIL浓度与48 h时无显著变化(P>0.05),IL-12浓度较48 h显著增加(P<0.05),TNF-α、IL-12和sTRAIL较空白对照组显著增加(P<0.05)。
应用HTA125抑制TLR4功能后,各时间点3种细胞因子的浓度均较阻断前显著降低(P<0.05)。与此相似,应用PDTC抑制NF-κB活性后,各时间点3种细胞因子的浓度均较阻断前显著降低(P<0.05)。见表1。
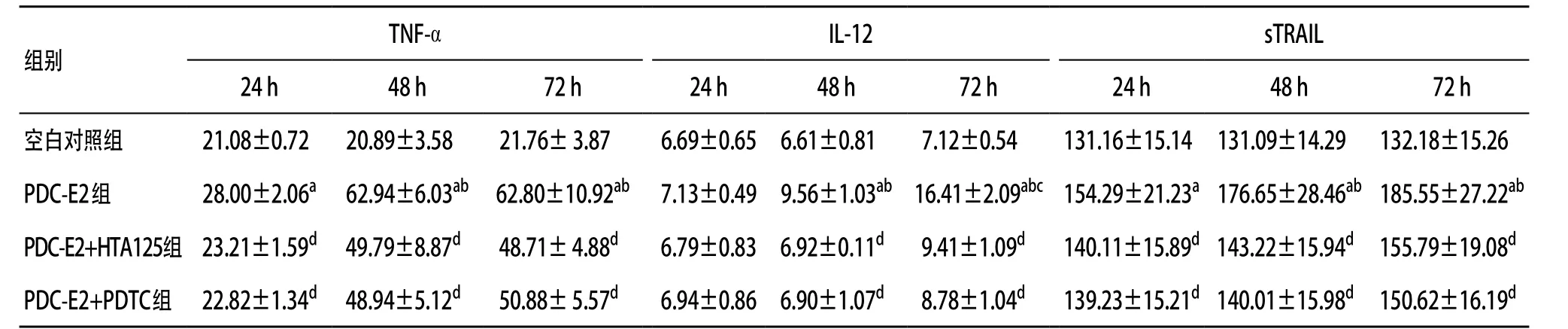
表1 各组细胞不同时间点培养上清TNF-α、IL-12和sTRAIL的浓度(n=3, ±s,pg/mL)
3 讨论
研究证实,在PBC的单核巨噬细胞中,TLR4存在过表达和过度活化现象[5-7],但原因不明。本研究发现,作为PBC特异性自身抗原,PDC-E2可以上调U937细胞TLR4的表达。U937细胞是一种具有单核细胞性质的白血病肿瘤细胞株,已作为单核/巨噬细胞模型,广泛应用于各种体外研究[8-10]。本研究亦采用U937细胞作为单核/巨噬细胞模型。因此,我们有理由推测,PDC-E2可能是PBC单核巨噬细胞TLR4过表达和过度活化的一个重要原因。
本研究进一步发现,PDC-E2刺激U937细胞后,除了可以明显上调TLR4的表达外,还可以诱导转录因子NF-κB活化,促进细胞因子TNF-α、IL-12和sTRAIL的分泌。而应用HTA125以后,NF-κB活化,TNF-α、IL-12和sTRAIL分泌受到明显抑制,应用PDTC以后,TNF-α、IL-12和sTRAIL分泌亦受到明显抑制。有研究证实,HTA125具有抑制TLR表达的作用,PDTC则是NF-κB的抑制剂[11-12]。本研究结果表明,PDC-E2对单核巨噬细胞分泌TNF-α、IL-12和sTRAIL的调节作用可能主要是通过活化TLR4通路,并依赖于NF-κB。当然,TLR4通路比较复杂,包括MyD88依赖和非依赖,其下游又涉及NF-κB、MAPK、干扰素调节因子等多个信号蛋白或转录因子[13],本结果无法证明究竟是哪一条通路发挥的主要作用,只能初步提示PDC-E2对单核细胞的上述作用可能部分是由NF-κB介导的,对这一结果的解释需要谨慎对待。已有研究表明,这3种细胞因子在PBC患者外周血或肝门管区均显著增加[14-17]。TNF-α和sTRAIL可以直接诱导胆管细胞凋亡[18],IL-12可以调节淋巴细胞的活性和功能,有助于特异性杀伤胆管上皮细胞,IL-12刺激活化的信号通路已被证实对PBC发病起重要作用[19]。
综上所述,PDC-E2不仅可以作为一种自身抗原,指引抗原特异性T细胞杀伤肝内胆管上皮细胞,造成PBC的炎症损伤,还可以部分活化TLR4通路,刺激单核巨噬细胞分泌对PBC发病具有重要作用的细胞因子TNF-α、IL-12和sTRAIL,且NF-κB在其中可能发挥一定的作用。由于技术的局限性,本研究无法证实PDC-E2是否可以作为TLR4的一个内源性配体与TLR4直接结合发挥作用,但正反两方面功能验证均证实PDC-E2是可以活化TLR4通路的。
[1] HIRSCHFIELD G M, GERSHWIN M E. The immunobiology and pathophysiology of primary biliary cirrhosis[J]. Annu Rev Pathol, 2013, 8: 303-330.
[2] SASAKI M, KAKUDA Y, MIYAKOSHI M, et al. Infiltration of inflammatory cells expressing mitochondrial proteins around bile ducts and in biliary epithelial layer may be involved in the pathogenesis in primary biliary cirrhosis[J]. J Clin Pathol, 2014, 67(6): 470-476.
[3] LEICESTER K L, OLYNYK J K, BRUNT E M, et al. Differential findings for CD14-positive hepatic monocytes/macrophages in primary biliary cirrhosis, chronic hepatitis C and nonalcoholic steatohepatitis[J]. Liver Int, 2006, 26(5): 559-565.
[4] TSUNEYAMA K, HARADA K, KONO N, et al. Scavenger cells with gram-positive bacterial lipoteichoic acid infiltrate around the damaged interlobular bile ducts of primary biliary cirrhosis[J]. J Hepatol, 2001, 35(2): 156-163.
[5] WANG A P, MIGITA K, ITO M, et al. Hepatic expression of toll-like receptor 4 in primary biliary cirrhosis[J]. J Autoimmun, 2005, 25(1): 85-91.
[6] MAO T K, LIAN Z X, SELMI C, et al. Altered monocyte responses to defined TLR ligands in patients with primary biliary cirrhosis[J]. Hepatology, 2005, 42(4): 802-808.
[7] ZHAO J, ZHAO S, ZHOU G, et al. Altered biliary epithelial cell and monocyte responses to lipopolysaccharide as a TLR ligand in patients with primary biliary cirrhosis[J]. Scand J Gastroenterol, 2011, 46(4): 485-494.
[8] ZHANG Z, SMITH C, LI W, et al. Characterization of nitric oxide modulatory activities of alkaline-extracted and enzymatic-modified arabinoxylans from corn bran in cultured human monocytes[J]. Agric Food Chem, 2016, 64(43): 8128-8137.
[9] DING J, GUO C, HU P, et al. CSF1 is involved in breast cancer progression through inducing monocyte differentiation and homing[J]. Int J Oncol, 2016, 49(5): 2064-2074.
[10] TSENG H H, VONG C T, KWAN Y W, et al. TRPM2 regulates TXNIP-mediated NLRP3 inflammasome activation via interaction with p47 phox under high glucose in human monocytic cells[J]. Sci Rep, 2016, 6: 35016.
[11] WANG R, STEPHENS J, LACY M J. Characterization of monoclonal antibody HTA125 with specificity for human TLR4[J]. Hybrid Hybridomics, 2003, 22(6): 357-365.
[12] BOYD J H, MATHUR S, WANG Y, et al. Toll-like receptor stimulation in cardiomyoctes decreases contractility and initiates an NF-kappaB dependent inflammatory response[J].Cardiovasc Res, 2006, 72(3): 384-393.
[13] 余国庆, 陈晓明. 多糖免疫受体研究进展[J]. 温州医学院学报, 2 0 1 2, 4 2(4): 3 9 6-4 0 1.
[14] FLOREANI A, INFANTOLINO D, BIASIN R, et al. Tumour necrosis factor alpha and cellular proliferation in primary biliary cirrhosis[J]. Ital J Gastroenterol Hepatol, 1999, 31(1):56-60.
[15] 闫惠平, 庄辉, 刘燕敏, 等. 原发性胆汁性肝硬化患者的免疫学特点分析[J]. 中华肝脏病杂志, 2 0 1 5, 1 3(1): 1 2-1 6.
[16] YANG C Y, MA X, TSUNEYAMA K, et al. IL-12/Th1 and IL-23/Th17 biliary microenvironment in primary biliary cirrhosis: implications for therapy[J]. Hepatology, 2014, 59(5):1944-1953.
[17] LIANG Y, YANG Z, LI C, et al. Characterisation of TNF-related apoptosis-inducing ligand in peripheral blood in patients with primary biliary cirrhosis[J]. Clin Exp Med, 2008,8(1): 1-7.
[18] HARADA K, NAKANUMA Y. Biliary innate immunity:function and modulation[J]. Mediators Inflamm, 2010, 2010(1): 60-68.
[19] ARNDTZ K, HIRSCHFIELD G M. The pathogenesis of autoimmune liver disease[J]. Dig Dis, 2016, 34(4): 327-333.
(本文编辑:丁敏娇)
Biological effect of pyruvate dehydrogenase complex E2 subunit on monocyte U937 by activating Toll-like receptor 4-NF-κB pathway
YANG Zaixing1, LIANG Yan2, LIU Donghong1, ZHANG Zhiyu3, ZHONG Renqian2.1.Department of Laboratory Medicine, Taizhou First People’s Hospital, Taizhou, 318020; 2.Department of Laboratory Diagnostics, Shanghai Changzheng Hospital, Shanghai, 200003; 3.Department of VIP, Shanghai Changzheng Hospital, Shanghai, 200003
R392.32
A
10.3969/j.issn.2095-9400.2017.09.003
2016-11-23
国家自然科学基金面上项目(81671594,81571591)。
杨再兴(1978-),男,辽宁锦州人,研究员,博士。

