大剂量柔红霉素联合标准剂量阿糖胞苷对中青年初发急性髓系白血病患者的近、远期疗效
艾国,李文倩,冯建明
(青海省人民医院 血液科,青海 西宁 810000)
大剂量柔红霉素联合标准剂量阿糖胞苷对中青年初发急性髓系白血病患者的近、远期疗效
艾国,李文倩,冯建明
(青海省人民医院 血液科,青海 西宁 810000)
目的分析大剂量柔红霉素(DNR)联合标准剂量阿糖胞苷(Ara-C)对中青年初发急性髓系白血病(AML)患者的近、远期效果。方法选取2011年1月-2015年5月该院血液内科收治的并接受的大剂量[60mg/(m2·d)] DNR联合100mg/(m2·d)Ara-C的DA方案行诱导化疗的133例中青年初治AML患者为研究对象,归为观察组。并随机选择同期该院接受标准剂量DA诱导方案[45mg/(m2·d)DNR联合100mg/(m2·d)Ara-C]的125例中青年初治AML患者为对照组。比较两组的完全缓解率(CR)、各不良反应的发生率、早期死亡率、血中性粒细胞绝对计数(ANC)减少的持续时间以及血小板(PLT)减少持续时间,并均进行随访,截止至2016年12月,比较两组的1、2及3年的总生存率(OS)和无瘤生存率(DFS),采用单因素与多因素Cox比例风险模型筛选出影响达到CR的观察组患者OS和DFS的影响因素。结果①两组的化疗前基线资料比较,差异无统计学意义(P>0.05),具有可比性。②观察组、对照组患者行1个疗程诱导化疗后的CR率分别为67.7%和57.6%,两组比较差异无统计学意义(P>0.05)。观察组患者2个疗程诱导化疗后的总CR率为82.0%,高于对照组的70.4%,差异有统计学意义(P<0.05)。两组的各不良反应发生率、早期死亡率、ANC和PLT减少的持续时间比较,差异无统计学意义(P>0.05)。③经过诱导化疗达到CR后,两组分别有103例(95.%)和84例(67.2%)患者均行1~4个疗程的巩固化疗,之后分别有21例(15.8%)、17例患者(13.6%)行异基因造血干细胞移植,2例(1.5%)、1例(0.8%)行自体造血干细胞移植。截止至末次随访时,两组患者的中位随访时间分别为26.8和28.0个月,两组化疗后1、2及3年的OS和DFS比较,差异无统计学意义(P>0.05)。④多因素Cox回归分析结果表明,对观察组患者诱导化疗达到CR的109例患者而言,预后危险分层、接受≥2个疗程大剂量Ara-C巩固化疗是影响患者OS的影响因素(P<0.05);预后危险分层、FMS样的酪氨酸激酶3-内部串联重复(FLT3-ITD)突变阳性是影响患者DFS的影响因素(P<0.05)。结论与标准剂量DNR相比,大剂量DNR联合标准剂量Ara-C能提高中青年初发AML患者的CR率,且不增加不良反应的发生风险,但对改善其远期生存状况未见明显优势。
柔红霉素;急性髓系白血病;不同剂量;阿糖胞苷;预后
对于急性髓系白血病(acute myeloid leukemia,AML)患者而言,柔红霉素(daunorubicin,DNR)联合阿糖胞苷(cytarabine,Ara-C)的DA方案仍然是当前国内外推荐的一线诱导化疗方案,其中DNR和Ara-C标准剂量分别为45mg/(m2·d)和100mg/(m2·d)。国外近年来有多个研究[1-3]表明,与标准剂量的DA方案相比,采用大剂量[60~90mg/(m2·d)]的DNR联合标准剂量Ara-C的方案对年轻的初治AML患者有更高的诱导完全缓解(complete remission,CR)率,延长其生存时间,但也有学者[4-5]认为,2个方案的疗效并无区别,大剂量DNR并不能提高CR率。由于亚洲人种的不同、患者经济原因等,国内目前尚无采用90mg/(m·d)的DNR来诱导AML患者的大宗研究报道,主要是比较60mg/(m·d)与标准剂量DNR对AML患者的CR率,缺乏其远期生存状况的报道。对此,本研究回顾性分析本院采用60mg/(m2·d)与标准剂量DNR的DA方案诱导化疗的中青年初治AML患者的临床资料,旨在比较两者的近、远期效果,为临床提供参考依据。
1 资料与方法
1.1 研究对象
选取2011年1月-2015年5月本院血液内科收治的并接受的60mg/(m2·d)DNR联合100mg/(m2·d)Ara-C的DA方案行诱导化疗的133例中青年初治AML患者为研究对象,归为观察组。并随机选择同期我院接受标准剂量的DA诱导方案的125例中青年初治AML患者为对照组。入选标准:①经骨髓细胞学检查、骨髓活检、染色体核型、流式细胞术等确诊为AML;②初治患者,既往未接受任何相关治疗;③年龄18~65岁;④临床及随访资料完整。排除标准:①合并肝、肾功能异常或严重的心、肺等疾病;②合并其他血液系统疾病或先前诊断为骨髓增生异常综合征转化为AML者。其纳入和排除标准同观察组。本研究已得到本院医院伦理审查委员会批准。
1.2 方法
1.2.1 治疗方法 全部患者均采用DA方案行诱导化疗,对于化疗前高白细胞患者,给予羟基脲治疗,待WBC<50×109个/L时进行诱导化疗。观察组的方案为:DNR 60mg/(m2·d),静脉滴注,d1~3;Ara-C 100mg/(m2·d),皮下注射,1次/12 h,d1~7。对照组的方案为:DNR 45mg/(m2·d),静脉滴注,d1~3;Ara-C 100mg/(m2·d),皮下注射,1次/12 h,d1~7。对于出现贫血症状或血红蛋白(Hemoglobin,Hb)<60 g/L者输悬浮红细胞,对于出现出血倾向或PLT<10×109个/L者输血小板。在骨髓抑制期常规口服抗真菌药,监测其血常规变化,必要时给予粒细胞刺激因子。
若患者进行2个DA诱导化疗方案仍未达到CR者,则继续进行再诱导化疗或者行姑息治疗,前者多为DAE(DNR+Ara-C+VP-16)方案,少数选择MA(米托葱醌+阿糖胞苷)、CAG(重组人粒细胞集落刺激因子+阿糖胞苷+阿克拉霉素)、CLAG(重组人粒细胞集落刺激因子+阿糖胞苷+顺铂)方案。对于诱导化疗达到CR者,则根据患者的具体情况及其意愿来决定下一步巩固治疗方案,可进行大剂量或中剂量的Ara-C为主的化疗方案2~4个疗程,对于美国国家综合癌症网络(national comprehensive cancer network,NCCN)危险分层标准为预后中等或不良者则建议行异基因造血干细胞移 植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)或自体造血干细胞移植(autologous hematopoietic stem cell transplantation,AHSCT)。
1.2.2 染色体核型分析及预后分层 所有患者在化疗前均行染色体核型分析,包括有无、FMS样的酪氨酸激酶3-内部串联重复(FLT3-ITD)、核仁磷酸蛋白(NPM1)等突变,t(9;22)、t(8;21)及inv(16)等。并根据美国国家综合癌症网络(NCCN)制定的标准进行预后分层[6],包括:①预后不良:FLT3-ITD突变、-7、7q-、-5、5q-、inv(3)、t(6;9)、t(3;3),t(9;22)、非 t(9;11)的11q23异常或复杂核型(≥3个克隆性核型异常);②预后良好组:t(8;21)、inv(16)或正常核型伴有NPMl突变且FLT3-ITD突变阴性;③预后中等:正常核型,t(9;11)、+8,或者其他非上述两组的核型异常、t(8;21)、inv(16)或t(16;16)伴有C-KIT突变。
1.2.3 随访及观察指标 全部患者均定期采取电话或门诊随访,截止日期为2016年12月30日,以患者死亡为随访终点,记录其总体生存率(overall survival,OS)及无瘤生存率(disease free survival,DFS),即患者确诊至患者死亡或末次随访时间或失访时间。在第1、2个诱导化疗疗程后,参考AML国际工作组修订的标准进行疗效评价,包括CR、部分缓解(PR)、未缓解(NR)及进展(PD),并记录所有患者的不良反应,包括感染性发热、出血、血栓等,以及化疗早期(30 d内)死亡率,血中性粒细胞绝对计数(ANC)减少的持续时间(化疗开始至血ANC>0.5×109/L),PLT减少持续时间(化疗开始至PLT>20×109/L)。
1.3 统计学方法
数据分析采用SPSS 18.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验,计数资料以率(%)表示,比较用χ2检验,影响因素的分析用Cox比例风险模型,P<0.05为差异有统计学意义。
2 结果
2.1 两组化疗前的基线资料比较
结果表明,两组的性别、年龄、血WBC、PLT、Hb计数、FAB分型及预后分层等化疗前基线资料比较,差异无统计学意义(P>0.05),具有可比性(见表1)。
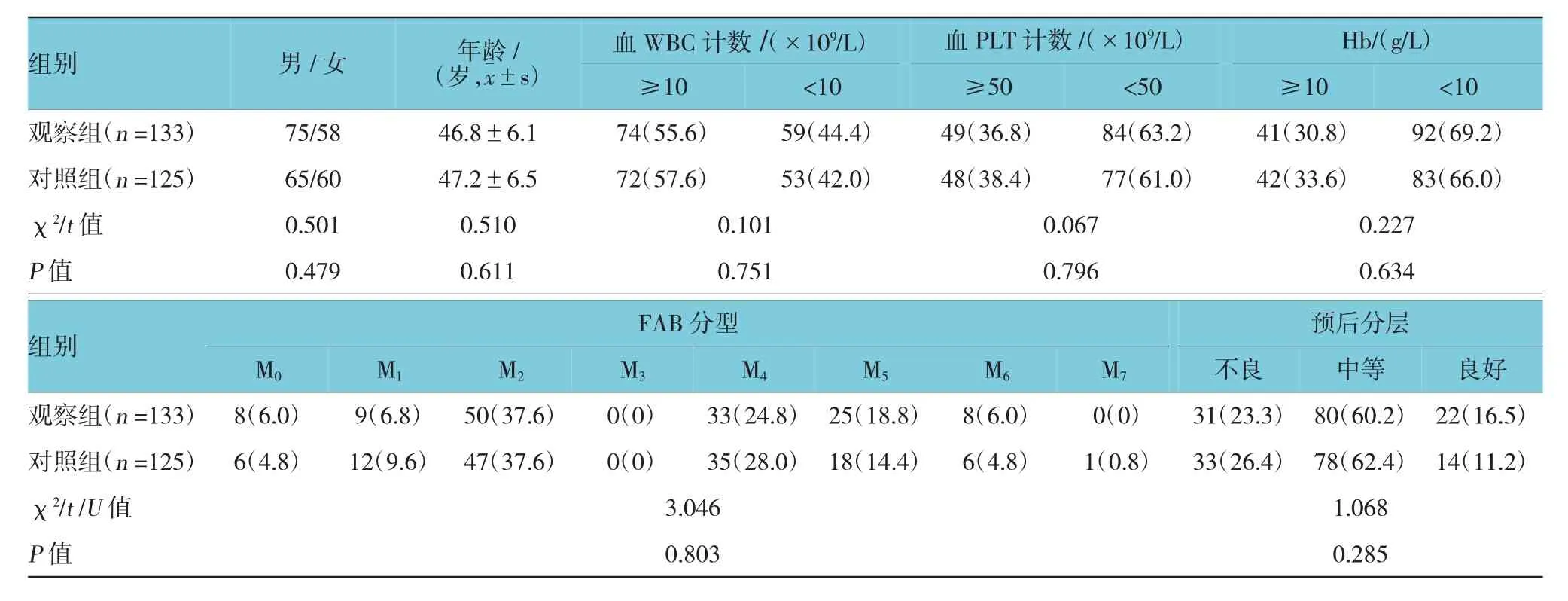
表1 两组患者化疗前的基线资料比较
2.2 两组诱导化疗的效果比较
观察组、对照组患者经过1个疗程的诱导化疗后,分别有90例(67.7%)、72例(57.6%)患者达到CR,两组比较差异无统计学意义(P>0.05),两组剩余的43例(32.3%)、53例(42.4%)患者中分别有37例(27.8%)、42例(33.6%)患者接受再诱导化疗,其余患者放弃治疗,最终分别有19例(14.3%)、16例(12.8%)患者在经过第2个诱导化疗后获得CR,观察组患者的总CR率高于对照组,差异有统计学意义(P<0.05)。
不良反应方面,两组在化疗期间分别出现119例(89.5%)、102例(70.4%)感染性发热,分别包括真菌感染25例、22例,细菌感染引起感染性休克3例、2例,结核杆菌感染2例、3例,卡氏肺孢子菌肺炎各1例。两组分别出现13例(9.8%)、8例(6.4%)出血,分别包括皮肤黏膜出血9例、6例,咯血2例、1例,阴道出血各1例,腹腔出血1例、0例。两组分别出现4例(3.0%)、1例(0.8%)血栓,均为行中心静脉导管引起。两组分别有2例(1.5%)、1例(0.8%)血栓,分别为窦性心动过缓各1例,频发室性早搏1例、0例,经过对症处理后均好转,未停止治疗。两组分别有4例(3.0%)、2例(1.6%)患者在第1个诱导化疗疗程后30 d内死亡,观察组患者的死因为感染性休克2例、腹腔出血1例,真菌性肺炎1例,对照组2例患者的死因分别为感染性休克和肠道感染。两组的各个不良反应发生率、死亡率、血ANC、PLT减少持续时间比较,差异无统计学意义(P>0.05)。见表2。
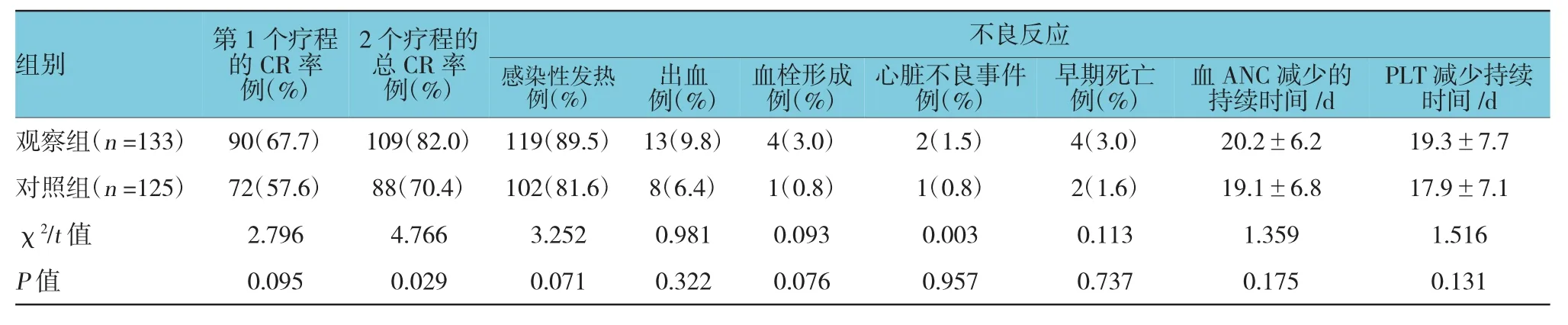
表2 两组诱导化疗的效果比较
2.3 两组远期生存状况比较
两组经过诱导化疗达到CR的109例(82.0%)、88例(70.4%)患者中,分别有6例(4.5%)、4例(3.2%)患者未行任何巩固治疗,原因包括直接行allo-HSCT、早期复发及个人意愿等,其余103例(95.%)、84例(67.2%)患者均行1~4个疗程的巩固化疗,平均疗程数分别为3.1个、2.8个,之后有21例(15.8%)、17例患者(13.6%)行allo-HSCT,2例(1.5%)、1例(0.8%)行AHSCT。截止至末次随访时,两组患者的中位随访时间分别为26.8和28.0个月,分别有16例(12.0%)、19例(15.2%)患者持续未缓解,77例(57.9%)、74例(59.2%)出现复发,79例(59.4%)、85例(68.0%)患者死亡。两组化疗后1、2及3年的OS和DFS比较,差异无统计学意义(P>0.05)。见表3。
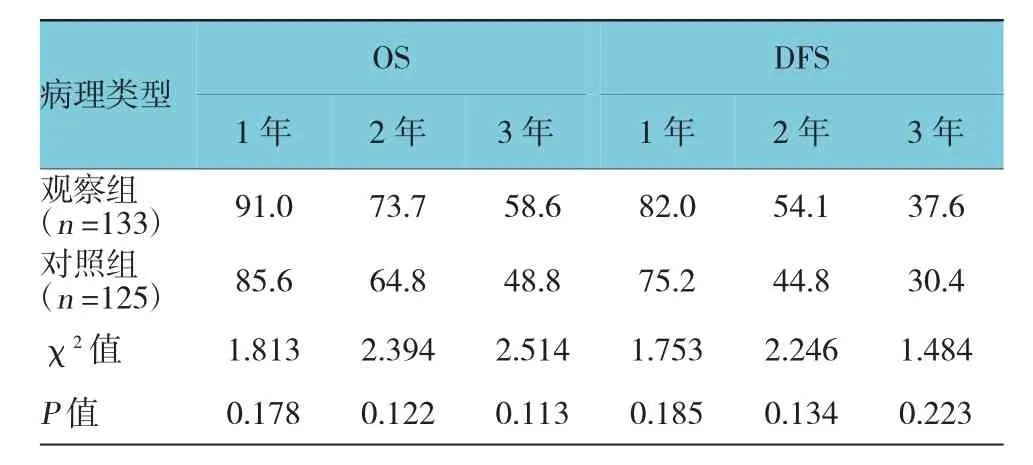
表3 两组远期生存状况比较 %
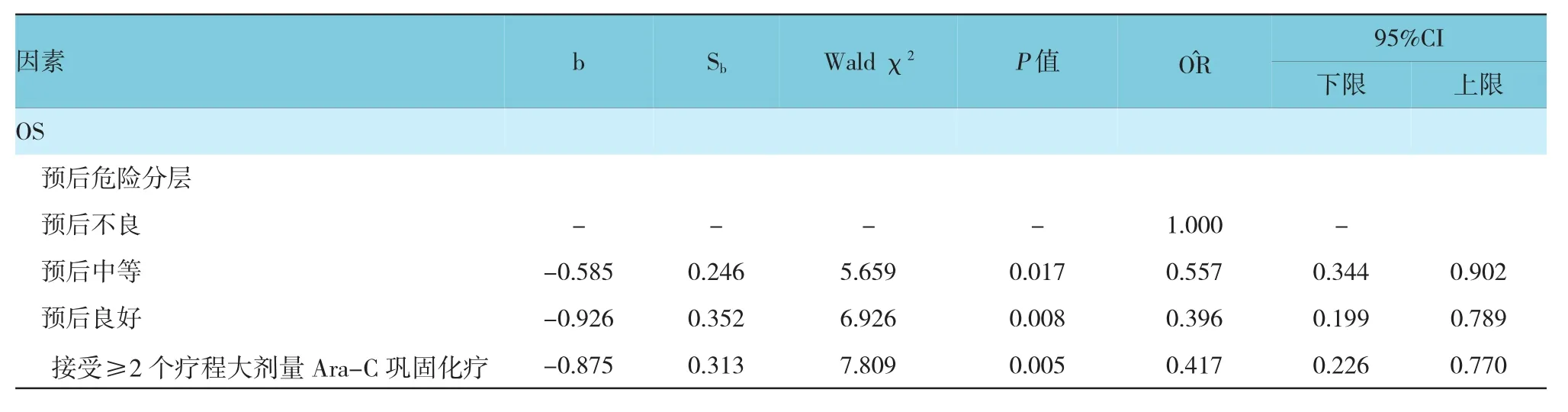
表4 多因素Cox回归分析相关参数
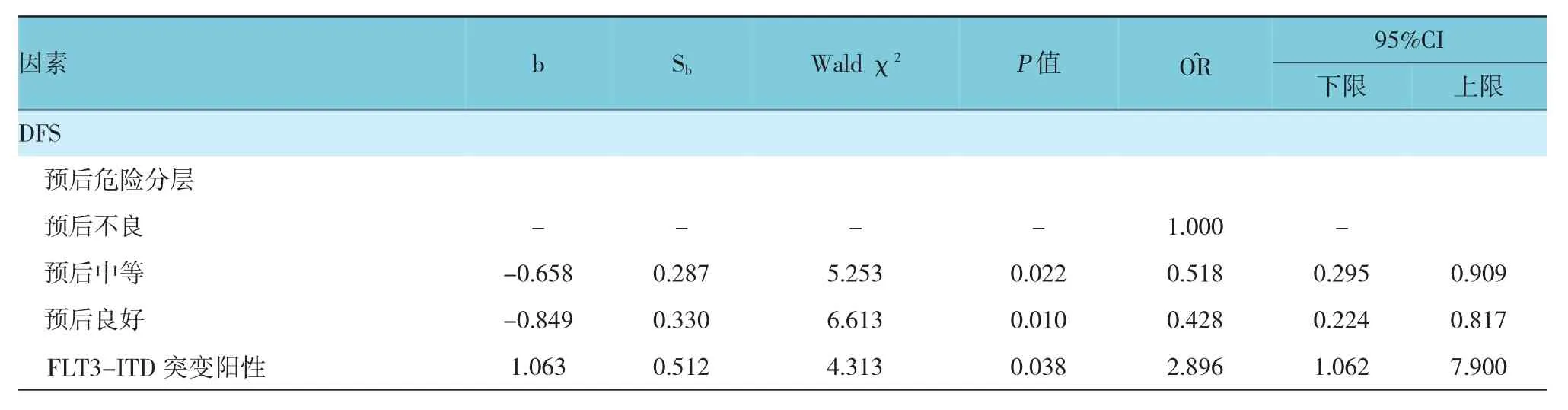
续表4
2.4 单因素与多因素Cox回归分析
首先对观察组患者诱导化疗达到CR的109例患者的OS和DFS进行单因素Cox回归分析,自变量为患者基线资料、预后分层、各种突变类型、巩固化疗的疗程、有无行allo-HSCT或AHSCT等,将P<0.20的因素进行多因素Cox回归分析,结果表明,预后危险分层、接受≥2个疗程大剂量Ara-C巩固化疗是影响患者OS的影响因素(P<0.05);预后危险分层、FLT3-ITD突变阳性是影响患者DFS的影响因素(P<0.05)。见表4。
3 讨论
虽然DA方案早已被国际上公认的AML患者的一线诱导化疗方案,但其用药剂量仍然有较大争议,尤其是DNR是采用标准剂量[45mg/(m2·d)]还是大剂量[60~90mg/(m2·d)]。国外多个随机对照试验(randomized controlled trial,RCT)研究[1-3]表明,与45mg/(m2·d)DNR比较,采用90mg/(m2·d)的DNR对AML患者有更高的诱导CR率,延长其OS和DFS,且不良反应发生率无明显升高,故采用大剂量的DNR能改善患者的预后。但也有学者提出不一样的观点。PAUTAS等[5]研究表明,对于儿童AML患者而言,采用60mg/(m2·d)的DNR与12mg/(m2·d)去甲柔红霉素行诱导化疗的CR率、无病生存率比较无差异,其认为采用大剂量DNR尚未得出更好的疗效。2015年的一项回顾性研究表明,对初治AML患者而言,采用90mg/(m2·d)DNR与60mg/(m2·d)DNR的DA方案的CR率、无复发生存率(RFS)、OS比较无差异[4]。目前,NCCN指南推荐大剂量[60~90mg/(m2·d)]的DNR联合100~200mg/(m2·d)Ara-C的DA方案作为年轻的初治AML患者的首选诱导方案。由于人种差异、经济原因及安全性考虑等,国内目前仍然主要采用标准剂量的DNR,即使采用大剂量的DNR,也多为60mg/(m2·d),未见关于60~90mg/(m2·d)DNR的多中心、大样本研究报道。
本院从2011年开始对部分≤65岁的初治AML患者给予60mg/(m2·d)DNR联合标准剂量Ara-C的诱导化疗方案,应用效果较为满意。本研究结果表明观察组、对照组患者经过1个疗程的诱导化疗后的CR率分别为67.7%和57.6%,2个疗程后的总CR率分别为82.0%、70.4%,与国外的研究[1,3]报道的疗效相似。虽然两组的1个疗程后的CR率比较无差异,但观察组患者的总CR率高于对照组(P<0.05),提示大剂量DNR较标准剂量有更好的近期疗效。安全性方面,本研究两组的各个不良反应发生率、死亡率、血ANC和PLT减少持续时间比较无差异,提示加大DNR的应用剂量并未带来更多的不良反应,整体安全性尚可,早期死亡率仅为3.0%,且死因为感染性休克、腹腔出血与真菌性肺炎,无心源性死亡。田飞等[7]研究表明,与采用45mg/(m2·d)DNR比较,采用60mg/(m2·d)DNR联合200mg/(m2·d)Ara-C的诱导化疗方案的肺部感染、败血症发生率提高,恶性呕吐、口腔溃疡、脱发、发热或肝肾功能异常等不良反应发生率比较无差异,提示采用大剂量DNR联合Ara-C在治疗AML患者时不会增加中、重度不良反应。该学者的另外一个研究表明,大剂量DNR的DA方案在初治AML患者的疗效令人满意,其1个疗程的总有效率达到93.3%,高于标准剂量DNR的74.0%。但也有研究得出阴性结果[8]。王琰等[9]一份总共包括33例初治AML患者的研究报道表明,采用60mg/(m2·d)DNR与45mg/(m2·d)DNR的CR率、ANC减少、PLT减少及感染等不良反应发生率比较无差异,提示采用大剂量与标准剂量的DNR的疗效和安全性相近。远期疗效方面,本研究大部分诱导化疗达到CR的患者行1~4个疗程的巩固化疗,分别有15.8%和13.6%行allo-HSCT,数个患者行AHSCT,随访截止时有超过50%的患者出现复发,死亡率达到59.4%和68.0%,两组化疗后1、2及3年的OS和DFS比较无差异,提示与标准剂量DNR比较,采用大剂量DNR不能提高改善患者的远期生存状况,但本研究为单中心研究,样本量有限,随访时间不够长,故有待大样本的多中心RCT研究探讨两者的远期疗效差异。
本研究还对行大剂量DNR联合标准剂量Ara-C诱导化疗达到CR的109例患者的OS和DFS进行单因素与多因素Cox回归分析,结果表明,预后危险分层是OS和DFS的独立因素,对患者的远期生存状况影响最大,该分层主要是根据患者的染色体核型分析结果而制定,以往研究[10-11]同样认为,细胞遗传学与分子生物学的异常是影响AML患者的主要预后因素。刘辉等[12]研究表明,急性白血病患者的染色体核型分析是预后分层的重要依据,AML患者随着年龄的增长,其预后不良的核型比例逐渐增高。王瑞芳等[13]将行DA或IA方案诱导治疗、至少2个疗程的大剂量Ara-C巩固治疗的AML患者进行预后分析,结果表明,初诊WBC数、预后危险分层是影响OS的独立因素,预后危险分层则是RFS的独立因素,与本研究结果类似。在众多突变中,FLT3-ITD突变对AML患者的预后影响较大,本研究表明,FLT3-ITD突变是DFS的危险因素,其阳性患者出现肿瘤复发的风险是阴性者的2.896倍。以往的多个研究也认为,其是染色体核型正常者预后不良的独立危险因素。中美联合上海市白血病协作组的研究[14]表明,AML患者较常出现FLT3基因突变,其中FLTS-ITD突变对患者的CR率与OS时间均有影响,而FLT3-D835点突变对其预后影响不大。丁莎莎等[15]发现,对除M3以外的AML患者而言,FLT3-ITD突变比例<10%的患者预后优于突变比例≥10%者。此外,本研究还发现接受≥2个疗程大剂量Ara-C巩固化疗能延长患者的OS。目前,国内外对AML患者行大剂量的Ara-C进行巩固治疗的观点也被广泛认同,毛建平等[16]研究表明,含有大剂量的Ara-c巩固化疗方案能延长AML患者的RFS和OS,提高其生活质量。因此,对于诱导化疗后达到CR的AML患者而言,在一般情况和经济条件允许下,尽可能实施2个疗程以上的大剂量Ara-C巩固化疗,以改善其生存状况。
综上所述,与标准剂量DNR比较,大剂量DNR联合标准剂量Ara-C能明显提高中青年初发AML患者的CR率,且不增加不良反应的发生风险,但对改善其远期生存状况未见明显优势。
[1]LEE J H,JOO Y D,KIM H,et al.A randomized trial comparing standard versus high-dose daunorubicin induction in patients with acute myeloid leukemia[J].Blood,2011,118(14):3832-3841.
[2]LUSKIN M R,LEE J W,FERNANDEZ H F,et al.Benefit of high-dose daunorubicin in AML induction extends across cytogenetic and molecular groups[J].Blood,2016,127(12):155l-1558.
[3]FERNANDEZ H F,SUN Z,YAO X,et al.Anthracycline dose intensification in acute myeloid leukemia[J].New England Journal of Medicine,2009,361(13):1249-1259.
[4]DEVILLIER R,BERTOLI S,PREBET T,et al.Comparison of 60 or 90mg/m2of daunorubicin in induction therapy for acute myeloid leukemia with intermediate or unfavorable cytogenetics[J]. American Journal of Hematology,2015,90(2):E29-30.
[5]PAUTAS C,MERABET F,THOMAS X,et al.Randomized study of intensified anthracycline doses for induction and recombinant interleukin-2 formaintenancein patientswith acute myeloid leukemia age 50 to 70 years:results of the ALFA-9801 study[J]. Journal of Clinical Oncology,2010,28(5):808-814.
[6]O’DONNELL MR,ABBOUD CN,ALTMAN J,et al.Acute myeloid leukemia[J].J Natl Compr Canc Netw,2012,10(8):984-1021.
[7]田飞.大剂量柔红霉素治疗急性髓系白血病不良反应监测[J].中国保健营养,2013,23(12):7560-7561.
[8]田飞.不同剂量柔红霉素治疗急性髓系白血病的疗效评价[J].中国保健营养,2013,23(11):6800.
[9]王琰,陈精予.中大剂量柔红霉素诱导治疗急性髓系白血病16例[J].中国实用医刊,2014,41(3):17-19.
[10]SMITH M L,HILLS R K,GRIMWADE D.Independent prognostic variables in acute myeloid leukaemia[J].Blood Reviews, 2011,25(1):39-51.
[11]MRÓZEK K,MARCUCCI G,NICOLET D,et al.Prognostic significance of the European leukemianet standardized system for reporting cytogenetic and molecular alterations in adults with acute myeloid leukemia[J].Journal of Clinical Oncology,2012, 30(36):4515-4523.
[12]刘辉,常乃柏,裴蕾,等.老年急性白血病患者的染色体核型分析[J].中华老年医学杂志,2011,30(10):833-835.
[13]王瑞芳.急性髓系白血病的疗效及其影响因素分析[D].长春:吉林大学,2016.
[14]中美联合上海市白血病协作组.468例急性白血病患者FLT3基因突变及其预后价值分析[J].中华血液学杂志,2010,31(1):1-5.
[15]丁莎莎,沈宏杰,陈子兴,等.FLT3-ITD突变数量、长度及水平对急性髓系白血病患者预后的影响[J].中华血液学杂志,2015,36(6): 449-454.
[16]毛建平,赵利东,贾韬,等.含大剂量阿糖胞苷方案治疗急性髓系白血病疗效观察[J].中国现代医学杂志,2013,23(3):87-91.
Short-term and long-term efficacy of high-dose Daunorubicin combined with standard dose Ara-C in young and middle-aged patients with acute myeloid leukemia
Guo Ai,Wen-qian Li,Jian-ming Feng
(Department of Hematology,Qinghai People's Hospital,Xining,Qinghai 810000,China)
ObjectiveTo analyse the short-term and long-term efficacy of high-dose Daunorubicin(DNR) combined with standard dose cytarabine (Ara-C)in young and middle-aged patients with acute myeloid leukemia(AML).MethodsTotally 133 young and middle-aged patients with newly diagnosed AML
high-dose[60mg/(m2·d)]DNR combined with standard dose[100mg/(m2·d)]of Ara-C from January 2011 to May 2015 were enrolled for study in observation group.And 125 young and middle-aged patients with newlydiagnosed AML received standard dose DA induction therapy[45mg/(m2·d)DNR combined with 100mg/(m2·d) Ara-C]during the same period were randomly selected for study in control group.Complete remission(CR) rate,the incidence of adverse reactions,early mortality,duration of reduction of blood absolute neutrophil count (ANC)and PLT were compared between the two groups.All cases were followed up until December 2016.1-,2-,3-year overall survival(OS)and disease-free survival(DFS)were compared between the two groups.Univariate and multivariate Cox proportional hazard model were used to screen out the independent related factors for OS and DFS of patients reached CR in the observation group.ResultsThere were no statistically significant differences in baseline data before treatment between the two groups(P>0.05).The CR rates after 1 course of induction chemotherapy in the observation group and the control group were 67.7% and 57.6%,respecfively and there was no significant difference between them (P>0.05).The total CR rate after 2 courses in the observation group was 82.0%which was significantly higher than 70.4%in the control group (P<0.05).There were no significant differences in the incidences of all adverse reactions,early mortality,duration of ANC and PLT reduction between the two groups (P>0.05).Researching CR after induction chemotherapy,103 cases (95%)and 84 cases (67.2%)in the two groups received 1-4 courses of consolidation chemotherapy,then 21 cases (15.8%)and 17 cases (13.6%)underwent allogeneic hematopoietic stem cell transplantation,2 cases (1.5%)and 1 case (0.8%)underwent autologous hematopoietic stem cell transplantation.At the end of the last follow-up,the median follow-up time was 26.8 months and 28 months in the two groups.There were no statistically significant differences in 1-,2-and 3-year OS or DFS after chemotherapy between the two groups (P>0.05).Multivariate Cox regression analysis results showed that for the 109 cases of patients reached CR after induction chemotherapy in the observation group,prognostic risk stratification and receiving more than 2 courses of high-dose Ara-C consolidation chemotherapy were the independent related factors of OS(P<0.05),and prognostic risk stratification and FLT3-ITD mutation were the independent related factors of DFS (P<0.05).ConclusionsCompared with standard dose DNR,high-dose DNR combined with standard dose Ara-C can significantly improve the CR rate in young and middle-aged patients with AML and does not increase the risks of adverse reactions,but there is no obvious advantage in improvement of long-term survival.
Daunorubicin;acute myeloid leukemia;different dosage;Cytarabine;prognosis
R733.71
A
10.3969/j.issn.1005-8982.2017.18.011
1005-8982(2017)18-0056-06
2017-02-09

