大鼠骨髓单核细胞的快速分离方法及向破骨细胞的诱导分化*
王礼宁,马勇,郑苏阳,郭杨,袁翰,孙杰
[1.南京中医药大学 骨伤研究所(骨伤修复与重建新技术实验室),江苏 南京 210023;2.南京中医药大学附属医院 骨伤科,江苏 南京 210029]
基础研究·论著
大鼠骨髓单核细胞的快速分离方法及向破骨细胞的诱导分化*
王礼宁1,马勇2,郑苏阳1,郭杨1,袁翰1,孙杰1
[1.南京中医药大学 骨伤研究所(骨伤修复与重建新技术实验室),江苏 南京 210023;2.南京中医药大学附属医院 骨伤科,江苏 南京 210029]
目的建立一种简便高效的体外分离大鼠骨髓单核细胞的方法,观察其体外生长特性,并诱导其分化为破骨细胞。方法无菌条件下分离出SD大鼠的胫骨和股骨,使用环氧树脂管(EP管)和移液枪头快速分离骨髓组织,再用红细胞裂解液去除红细胞。细胞培养过夜后收集悬浮细胞,加入巨噬细胞集落刺激因子(M-CSF)继续培养扩增后得到贴壁的骨髓单核细胞。观察骨髓单核细胞生长过程中的形态学特征;通过细胞计数试剂盒法(CCK-8)测绘细胞的生长曲线;用流式细胞仪检测细胞表面CD11b的表达;在加入M-CSF和核因子κB受体活化因子配基(RANKL)诱导分化后,用抗酒石酸酸性磷酸酶(TRAP)染色和降钙素受体(CTR)免疫荧光染色鉴定其是否能分化为成熟破骨细胞。结果通过该方法获得的大鼠骨髓单核细胞培养1d后基本呈小圆形,杂细胞较少。3d后细胞数目稍多,两端开始出现触角,5d后数目增多,细胞呈椭圆形,两端触角明显;细胞的增殖依赖于M-CSF;流式结果显示,通过此方法获得的单核细胞纯度较高;TRAP染色和CTR免疫荧光染色结果提示,通过该方法获得的单核细胞可以诱导为成熟破骨细胞。结论通过EP管和移液枪头装置可快速分离获取单核细胞,获得的细胞表型稳定,适合用于骨代谢疾病的进一步研究。
分离培养方法;破骨细胞;骨髓单核细胞;分化;骨代谢疾病
破骨细胞是生理状态下唯一具有骨吸收功能的细胞[1]。骨吸收作为骨重建过程的重要环节,与骨形成具有相同重要的地位[2]。病理状态下破骨细胞所引起的过度骨吸收是导致骨质疏松症、骨关节炎等骨代谢疾病的重要病理过程[3]。因此,如何获得破骨细胞是进一步研究骨代谢疾病的关键。然而,破骨细胞作为一种高代谢终末分化细胞,具有无法传代、存活时间短等特点,且破骨细胞在体内数量极少,机械分离获取困难[4]。所以目前获取破骨细胞的常规方法多是通过骨髓单核细胞诱导。通过该方法获得的破骨细胞在数量、纯度及成熟度等方面均优于脾细胞诱导法和外周血单核细胞诱导法[5-6]。但是作者在使用传统的注射器冲洗骨髓腔分离骨髓细胞的方法时,发现该方法的一些局限性。如:①分离新生动物的长骨时需要尽量将周围软组织去除,这样需要较高的外科技术和较多的时间;②新生乳鼠的长骨极小且脆,在分离的过程中易折断导致骨髓流出;③新生乳鼠的骨髓腔极细,通常只有针眼大小,使用注射器冲洗时十分困难,无法将骨髓完全冲出。因此,本文探讨建立一种简便高效的体外分离、扩增骨髓单核细胞的方法,为进一步探索骨代谢疾病提供研究基础。
1 材料与方法
1.1 材料
出生24h内的SD大鼠雌雄各2只[来源于南京青龙山动物繁殖场,合格证书:SCXK(苏)2012-0008]。实验过程中对动物的处置符合 2009年《Ethical issues in animal experimentation》相关动物伦理学标准的条例。
1.2 试剂与仪器
巨噬细胞集落刺激因子(macrophage colonystimulating factor,M-CSF)和核因子κB受体活化因子配基(receptor activator for nuclear factor-κB ligand,RANKL)(购自美国Peprotech公司),藻红蛋白(P-phycoerythrin,PE)荧光标记的CD11b抗体及其同型对照抗体(购自美国BD公司),抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒、赫斯特(Hochest33342)荧光染液(购自美国SIGMA公司),兔抗大鼠降钙素受体(calcitonin receptor,CTR)抗体(购自北京博奥森公司),Alexa-488标记的山羊抗兔(购自英国Abcam公司)二抗,胎牛血清(fetal bovine serum,FBS)、基本培养基(alpha minimum essential medium,α-MEM)(购自美国GIBCO公司),细胞计数试剂盒(cell counting Kit-8,CCK-8)(购自日本同仁化学研究所),倒置相差显微镜CKX31型(日本Olympus光学仪器株式会社),徕卡倒置荧光显微镜DMI-3000型(德国徕卡公司),二氧化碳CO2培养箱BB16/BB5060型(德国Heraus公司),流式细胞仪(美国Beckman公司),多功能酶标仪(美国PE公司)。
1.3 实验方法
1.3.1 大鼠骨髓单核细胞的体外分离、培养[7]无菌条件下分离出新生大鼠的胫骨和股骨,并放入无血清α-MEM中备用;将1ml移液枪头下端1cm剪下,使用镊子将吸液口扩大,将大鼠长骨从中间剪断,断面朝下,各放入1个移液枪头中,再将枪头转移至1.5ml环氧树脂(epoxy epoxide,EP)管中,形成一个特殊的骨髓分离装置(见图1);将EP管6 000r/min离心30 s。然后将EP管中的枪头移除,每管用含1%青链双抗(penicillin-streptomycin,PS)、5%胎牛血清FBS的α-MEM培养基200μl吹打重悬,将细胞悬液从200目筛网中滤过后,1 500r/min离心5min,弃上清液;加入10倍于细胞体积的红细胞裂解液,轻轻吹打混匀,冰上裂解8min,1 500r/min离心5min,弃红色上清液;用含25ng/ml的M-CSF、1%PS、5% FBS的α-MEM培养基重悬,并按照4×105个/cm2的密度接种,于37℃、体积分数5%CO2培育箱静置培养过夜;收集上清液1 200r/min离心5min,用 含 25ng/ml的 M-CSF、1%PS、5%FBS的α-MEM重悬,直至细胞增殖的合适密度后,用含25ng/ml的M-CSF、100ng/ml的RANKL、1%PS、5% FBS的α-MEM进行诱导。

图1 骨髓分离提取装置简单示意图
1.3.2 大鼠骨髓单核细胞生长曲线的绘制[8]取对数生长期的原代大鼠单核细胞数量按照104/孔,分为两组,每组8孔,一组加入含100ng/ml的M-CSF的含血清培养基,另外一组只加完全培养基,各100μl。分别在接种后的第1、3、5、7和9天,以CCK-8法检测其细胞活力。每次检测时均加入10μl的CCK-8检测液,放入培养箱中孵育4h,用酶标仪检测其在450 nm处的吸光度,每组取8孔测定值做统计分析后,绘制生长曲线。
1.3.3 流式细胞术检测大鼠骨髓单核细胞CD11b的表达 将生长状态良好的原代大鼠单核细胞轻轻吹下,调整密度至106/ml,收集于2个EP管中各400μl,各加入含1%FBS[用1%叠氮钠(NAN3)溶解]200μl冰上封闭30min,并标记A、B。A管加入0.5μl同型对照抗体,B管加入0.5μl CD11b荧光抗体,冰上静置30min。离心后用PBS清洗2次,转移到流式管中上机检测。
1.3.4 大鼠骨髓单核细胞的诱导分化以及TRAP染色 将纯化增殖后原代大鼠骨髓单核细胞轻轻吹下,离心重悬后按照1.5×105/cm2的密度接种,并在培养基中加入 25ng/ml的 M-CSF、100ng/ml的RANKL,每2天半量换液[9]。直至6d后可在镜下发现大量融合的多核细胞,即可行抗酒石酸酸性磷酸酶(TARP)染色,细胞用4%的多聚甲醛固定10min后,按照Sigma试剂盒说明书进行染色,染色后尽快在倒置显微镜下观察拍照。
1.3.5 免疫荧光检测诱导分化后的细胞中CTR的表达 同样将纯化增殖后原代大鼠骨髓单核细胞按照1.5×105/cm2的密度接种,诱导方法同前。培养6d后将细胞用预冷的4%多聚甲醛固定10min,加入含0.3%Triton-X100的PBS冰上放置30min,再加入含5%FBS的PBS冰上封闭30min,加入兔抗大鼠CTR抗体(1∶100稀释)后4℃过夜。次日PBS洗3次后,加入Alexa-488标记的山养抗兔二抗37℃孵育1h后,PBS洗3次。再用Hochest33342染液复染细胞核10min,PBS洗3次后。荧光显微镜下观察荧光分布范围及强度。
1.3.6 主要观察指标 ①大鼠骨髓单核细胞的形态学观察。②大鼠骨髓单核细胞生长曲线的测绘结果。③大鼠骨髓单核细胞表面抗原CD11b的表达。④大鼠骨髓单核细胞分化后TARP染色结果。⑤大鼠骨髓单核细胞分化后降钙素受体免疫荧光染色结果。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠骨髓单核细胞的形态学观察
分离培养过夜后收集的原代大鼠骨髓单核细胞在含25ng/ml的M-CSF的培养基中培养1d后基本呈小圆形,杂细胞较少。3d细胞数目增多,体积稍大,大多呈椭圆形,部分细胞两端长出触角。5d后细胞数目增多,细胞触角更加明显,形态均一,大小一致,细胞密度可达90%以上。见图2。
在信息化时代,企业要与时俱进,根据市场需求和企业实际需求,利用信息化技术建立企业内部资源共享平台。同时利用企业员工学术交流、技术交流、深造等方式,整合国内外先进的经验技术,研发一套符合自身企业发展的新思路和新技术,并且运用到实际工作中。
2.2 大鼠骨髓单核细胞的生长曲线
通过CCK-8法测定大鼠骨髓单核细胞在有无M-CSF存在时生长增殖活性之间的差异。将各时间测得的光密度值(optical density,OD)绘制成生长曲线后,发现3d后各时间诱导组的细胞数量与对照组比较差异均有统计学意义(P<0.05)。M-CSF可促进大鼠骨髓单核细胞的增殖(见图3),在接种前3d细胞的生长相对较缓,应属于平台期。3d后细胞快速生长,进入对数生长期。5d后细胞增速逐渐放缓,进入平台期。而未加入M-CSF的对照组生长基本停滞。提示M-CSF是大鼠骨髓单核细胞增殖过程中的必要生长因子。
2.3 大鼠骨髓单核细胞表面CD11b的表达
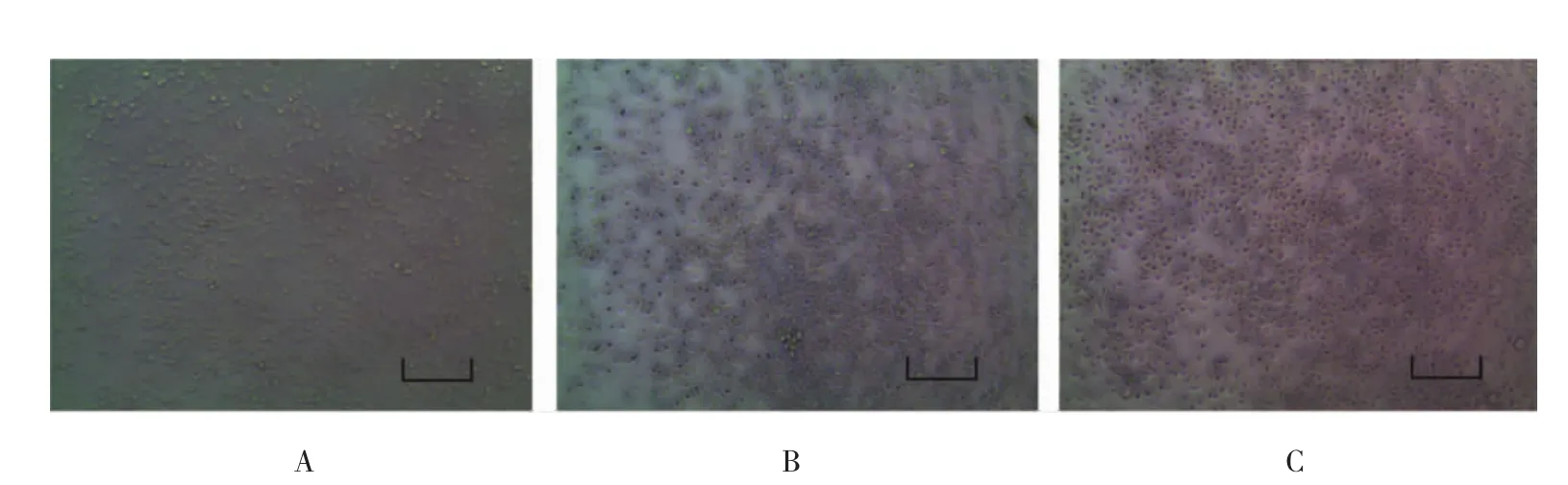
图2 原代大鼠骨髓单核细胞第1、3及5天的形态 (倒置显微镜,标尺=50μm)
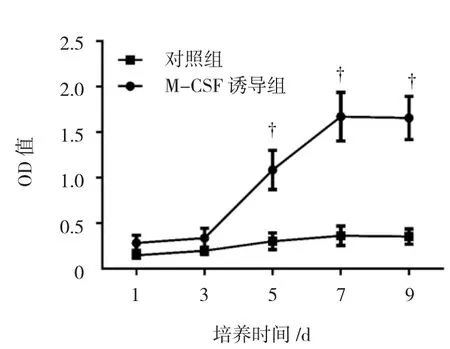
图3 原代大鼠骨髓单核细胞的生长曲线
流式细胞仪的结果显示,原代单核细胞表面CD11b表达率可达99.3%。见图4。
2.4 大鼠骨髓单核细胞诱导分化后TRAP染色结果
诱导培养6d后的大鼠骨髓单核细胞中出现大量体积较大(30~150μm)的细胞,细胞多呈椭圆形或不规则形,TRAP染色后可见胞浆中有紫红色颗粒,分布均匀,伪足和褶皱清晰可见,细胞核呈蓝紫色,每个细胞中可见大量细胞核,大部分细胞呈TRAP阳性。而未诱导的大鼠骨髓单核细胞TRAP染色呈阴性。见图5。
2.5 大鼠骨髓单核细胞诱导分化后CTR的荧光表达
诱导培养6d后的大鼠骨髓单核细胞免疫荧光染色后细胞膜和核周细胞质中均呈现较强的绿色荧光,Hochest33342染色可见诱导后的细胞的核中呈蓝色荧光,每个细胞中基本含有≥3个的细胞核。而未诱导的大鼠骨髓单核细胞中则不存在CTR的表达。见图6。

图4 原代大鼠骨髓单核细胞表面CD11b表达
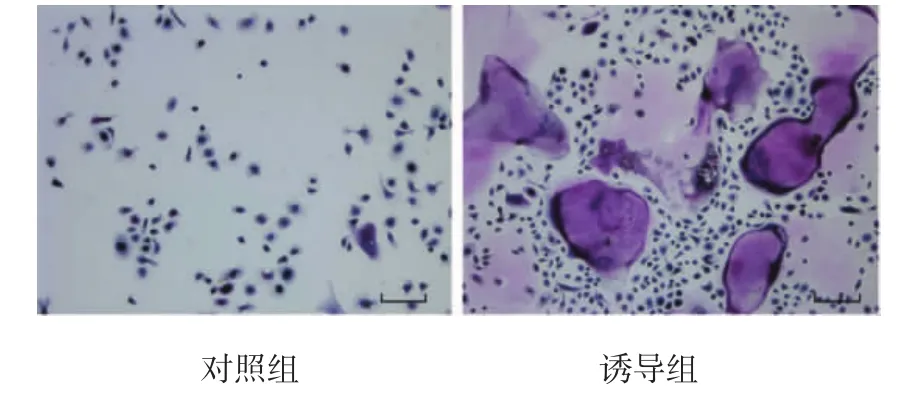
图5 M-CSF和RANKL诱导单核细胞分化后的TRAP染色 (倒置显微镜,标尺=50μm)

图6 免疫荧光染色观察诱导组中CTR的表达 (荧光显微镜,标尺=20μm)
3 讨论
目前,除了使用骨髓单核细胞诱导破骨细胞外,使用小鼠单核巨噬细胞白血病细胞系(RAW264.7细胞系)细胞系诱导也是一种常用的方法。小鼠RAW264.7是Abelson鼠白血病病毒诱导BALB/C小鼠肿瘤生成后,收集小鼠腹水中单核样巨噬细胞从而得到的细胞株[10]。其突破破骨前体细胞存活时间短的限制,使得人们能从中稳定获取破骨样细胞,从而受到一部分研究者的青睐。然而,由于RAW264.7是细胞系,与原代细胞基因系是否存在差异仍然不得而知[11]。而骨髓单核细胞作为一种较其更为前体的破骨前体细胞,采用其作为研究对象则更有说服力[12]。多项研究也已证实[13-14],通过骨髓单核细胞诱导而来的破骨细胞较通过RAW264.7诱导而来的细胞数量更多、骨吸收功能更活跃。但是传统的原代细胞特别是骨髓细胞的分离提取过程较为复杂,需要消耗研究者大量的时间和精力。因此,笔者希望能够建立一套更为简易、行之有效的体外分离、纯化和大量扩增骨髓单核细胞的方法。
本实验采用实验室中常见的EP管和移液枪头作为工具,使其在只需要粗略分离骨骼周围软组织的情况下,就能够获取大量较纯的骨髓组织,同时也避免精细分离过程中骨干断裂、骨髓冲洗不彻底的情况,大大降低原代分离的工作量。然后用红细胞裂解液去除骨髓中的红细胞,并使用经典的药物贴壁筛选法进一步纯化骨髓细胞[8]。由于骨髓间充质细胞更容易贴壁的特性,将获得的细胞培养过夜后,收集悬浮细胞继续培养,并在培养液中加入巨噬细胞集落刺激因子。在生长因子的刺激下,其中的单核细胞大量增殖贴壁。隔天半量换液,去除悬浮细胞剩余的淋巴细胞等杂细胞。5d后可见培养皿中存在大量的骨髓单核细胞,纯度可达85%~90%。
通过CCK-8法测绘的大鼠骨髓单核细胞的生长曲线观察该细胞的生长特性,发现该细胞只有在巨噬细胞集落刺激因子存在的情况下才具有增殖的能力。整个生长周期可分为潜伏期(1~2d)、对数生长期(3~7d)、平台期(7d后)。说明大鼠骨髓单核细胞可在体外稳定扩增1周时间。CD11b作为单核细胞表面的重要抗原之一[15-16],在原代大鼠骨髓单核细胞中的表达率高达99.3%,提示通过该方法获得的单核细胞具有较高的纯度。TRAP是破骨细胞的特征性酶,是破骨细胞重要的酶组化识别标志之一[17]。CTR只在定向破骨细胞前体和成熟破骨细胞中表达,是破骨细胞特异性鉴别指标之一[18]。通过本方法获取的细胞在相关细胞因子诱导分化5d后,可成功的通过TRAP染色和CTR免疫荧光染色鉴定为成熟的破骨细胞,进一步证明通过该方法获取的骨髓单核细胞可以用于进一步的实验研究。
综上所述,本实验创造性地采用由实验室中普通的耗材合成的简易骨髓提取装置,成功地缩短整个原代提取过程从需要的时间和工作量,提高原代提取方法的效率。通过该方法得到大鼠骨髓单核细胞具有单核细胞的一般生物学特征,经过鉴定能够成功诱导为成熟破骨细胞。该方法具有简便可行的优点,能够在短时间、低成本的条件下获取一批数量可观、性状稳定、活性较高的骨髓单核细胞,为后续的骨代谢疾病的基础研究提供可靠稳定的细胞来源。
[1]SIMONET W S,LACEY D L,BOYLE W J.Osteoclast differentiation and activation[J].Nature,2003,423(6937):337-342.
[3]REDLICH K,SMOLEN J S.Inflammatory bone loss:pathogenesis and therapeutic intervention[J].Nat Rev Drug Discov,2012,11(3): 234-250.
[4]吕明波,陈克明,刘兴炎.破骨细胞体外培养研究进展[J].国际骨科学杂志,2006,27(5):308-310.
[5]HENRIKSEN K,KARSDAL M A,TAYLOR A,et al.Generation of human osteoclasts from peripheral blood[J].MethodsMol Biol, 2012,816(816):159-175.
[6]BORASCHI-DIAZ I,KOMAROVA S V.The protocol for the isolation and cryopreservation of osteoclast precursors from mouse bone marrow and spleen[J].Cytotechnology,2016,68(1):105-114.
[7]MARINO S,LOGAN J G,MELLIS D,et al.Generation and culture of osteoclasts[J].BoneKEy Reports,2014(3):570.
[8]TAKESHITA S,KAJI K,KUDO A.Identification and characterization of the new osteoclast progenitor with macrophage phenotypes being able to differentiate into mature osteoclasts[J].J Bone Miner Res,2000,15(8):1477-1488.
[9]董伟,于静,戚孟春,等.M-CSF、RANKL浓度及M-CSF预诱导对破骨细胞生成影响的研究[J].生物医学工程学杂志,2010(6):1336-1340.
[10]COLLIN-OSDOBY P,OSDOBY P.RANKL-mediated osteoclast formation from murine RAW 264.7 cells[J].Methods Mol Biol, 2012(816):187-202.
[11]SUDA T,TAKAHASHI F,TAKAHASHI N.Bone effects of vitamin D-Discrepancies between in vivo and in vitro studies[J]. Arch Biochem Biophys,2012,523(1):22-29.
[12]肖新华,廖二元,董源媛,等.小鼠单核细胞RAW264.7的细胞生物学特征[J].南华大学学报(医学版),2008,36(3):282-285.
[13]OGASAWARA T,YOSHIMINE Y,KIYOSHIMA T,et al.In situ expression of RANKL,RANK,osteoprotegerin and cytokines in osteoclasts of rat periodontal tissue[J].J Periodontal Res,2004, 39(1):42-49.
[14]张鲲,陈晓亮,王德春,等.两种方法培养大鼠破骨细胞的比较研究[J].中国骨质疏松杂志,2006,12(6):561-564.
[15]SPRINGER T,GALFRE G,SECHER D S,et al.Mac-1:a macrophage differentiation antigen identified by monoclonal antibody[J].Eur J Immunol,1979,9(4):301-306.
[16]MATSUMOTO Y,WATABE K,IKUTA F.Immunohistochemical study on neuroglia identified by the monoclonal antibody against a macrophage differentiation antigen(Mac-1)[J].J Neuroimmunol, 1985,9(6):379-389.
[17]HENRIKSEN K,GRAM J,SCHALLER S,et al.Characterization of osteoclasts from patients harboring a G215R mutation in ClC-7 causing autosomal dominant osteopetrosis typeⅡ[J].Am J Pathol,2004,164(5):1537-1545.
[18]QUINN J M,MORFIS M,LAM M H,et al.Calcitonin receptor antibodies in the identification of osteoclasts[J].Bone,1999,25(1): 1-8.
A method about isolation and cultivation of rat bone marrow monocytes and differentiation into osteoclasts*
Li-ning Wang1,Yong Ma2,Su-yang Zheng1,Yang Guo1,Han Yuan1,Jie Sun1
[1.Institute of Traumatology(Laboratory of New Technology on Bone Trauma Repairment and Reconstruction),Nanjing University of Chinese Medicine,Nanjing,Jiangsu 210023,China; 2.Department of Orthopedics,Hospital Affiliated to Nanjing University of Chinese Medicine,Nanjing,Jiangsu 210029,China)
ObjectiveTo establish a simple and efficient method to isolate the rat bone marrow monocytes in vitro,observe the characteristics of growth and induce the differentiation of osteoclasts.MethodsThe tibia and femur of SD rats were isolated under aseptic condition.The bone marrow tissues were separated by EP tube and the transfer gun head.Red blood cell lysate was used to remove the red blood cells.The suspended cells were collected after cell culture overnight.Then M-CSF was added to culture the cells and adherent bone marrow monocytes were obtained.The growth process of bone marrow monocytes was morphologically observed.The cell growth curve was measured by CCK-8.Flow cytometry was used to detect CD11b expression on cell surface.After differentiation of the monocytes by adding M-CSF and RANKL,TRAP staining and CTR immunofluorescence staining were used to identify whether they can differentiate to matureosteoclasts.ResultsThe rat bone marrow monocytes obtained after culturing for 1 day by these methods showed small circular shape with few mixed cells.After 3 days,the number of the cells increased slightly and the antennae began to appear at both sides.After 5 days,the cells increased significantly and were in oval shape,the antennae at both sides were obvious.The cell proliferation depended on M-CSF.Flow cytometryshowed thatmonocytesobtained had high purity by thismethod.TRAP staining and CTR immunofluorescence staining results showed that monocytes obtained by this method could be successfully induced to mature osteoclasts.ConclusionsMonocytes can be isolated and obtained rapidly by this method. The phenotype of the obtained cells is stable and suitable for further study on bone metabolic diseases.
isolation and culture method;osteoclast;bone marrow monocyte;differentiation;bone metabolic disease
Q813.11
A
10.3969/j.issn.1005-8982.2017.18.001
1005-8982(2017)18-0001-06
2017-03-17
国家自然科学基金面上项目(No:81473692);江苏省自然科学基金青年基金项目(No:BK20151007)
马勇,E-mail:zhongyi-my@263.net;Tel-13505153212

