siRNA沉默YKL-40对支气管哮喘小鼠气道平滑肌增殖及迁移的影响*
韩连奎,许川,梅宏,孙勇攀,刘波
(贵州省人民医院 胸外科,贵州 贵阳 550002)
siRNA沉默YKL-40对支气管哮喘小鼠气道平滑肌增殖及迁移的影响*
韩连奎,许川,梅宏,孙勇攀,刘波
(贵州省人民医院 胸外科,贵州 贵阳 550002)
目的探讨小干扰核糖核酸(siRNA)沉默人软骨糖蛋白39(YKL-40)对支气管哮喘小鼠气道平滑肌增殖及迁移的影响。方法20只健康雌性BALB/c小鼠随机分为健康组(n=10)和哮喘组(n=10),采取腹腔注射抗原和雾化吸入卵蛋的方式复制哮喘模型,健康组小鼠处理与哮喘组相同,只是将致敏物换成生理盐水,留取气管和支气管进行细胞培养,两组小鼠气道壁平滑肌细胞根据转染物不同分为siRNA-YKL-40组、阴性对照组和空白对照组,MTT法检测不同转染组小鼠气道壁平滑肌细胞增殖情况,Transwell法检测不同转染组小鼠气道壁平滑肌细胞迁移能力,实时荧光定量聚合酶链反应(qRT-PCR)和蛋白免疫印迹法(Western blot)检测不同转染组小鼠气道壁平滑肌细胞中YKL-40、白细胞介素4(IL-4)和干扰素-γ(IFN-γ)基因和蛋白表达。结果哮喘组中siRNA-YKL-40组48~96h时细胞吸光度A值均低于阴性对照组和空白对照组,哮喘组中siRNA-YKL-40组、阴性对照组和空白对照组48~96 h时细胞吸光度A值均高于健康组,差异有统计学意义(P<0.05);哮喘组中siRNA-YKL-40组迁移细胞数(86.38±8.61)个,低于阴性对照组和空白对照组,哮喘组迁移细胞数均高于健康组,差异有统计学意义(P<0.05);哮喘组和健康组中siRNA-YKL-40组YKL-40基因和蛋白相对表达量均低于阴性对照组和空白对照组(P<0.05),哮喘组中siRNA-YKL-40组IL-4基因和蛋白相对表达量均低于阴性对照组和空白对照组,而IFN-γ基因和蛋白相对表达量与IFN-γ/IL-4均高于阴性对照组和空白对照组(P<0.05),与健康组比较,哮喘组中siRNA-YKL-40组、阴性对照组和空白对照组IL-4基因和蛋白相对表达量均升高,而IFN-γ基因和蛋白相对表达量和IFN-γ/IL-4均降低,差异有统计学意义(P<0.05)。结论靶向YKL-40基因沉默能抑制气道壁平滑肌细胞增殖及迁移,可能与调节IL-4/IFN-γ失衡状态而减少气道炎症反应有关。
支气管哮喘;人软骨糖蛋白39;沉默核糖核酸;细胞增殖;细胞迁移
支气管哮喘作为气道慢性炎症性疾病,近年来,随着生活环境不断恶化,其发病率呈逐渐升高趋势[1],发病急,且多在夜间或凌晨发病,出现气促、咳嗽、喘息及胸闷等症状,严重时可危及患者生命[2]。研究表明[3],慢性炎症所致气道重塑是支气管哮喘的重要病理特征之一。而气道平滑肌细胞增殖及肥大在气道重塑中处于中心地位,因而,气道平滑肌逐渐成为哮喘治疗的靶位[4]。YKL-40又称人软骨糖蛋白39(human cartilage glycoprotein-39,HCgp39),是存在于人体内的甲壳酶样蛋白,参与调控炎症反应、组织重构、纤维化及肿瘤发生[5]。研究表明[6],哮喘急性发作期气道和血清中YKL-40水平升高。但具体作用机制尚不明确。本研究拟采用小干扰核糖核酸(small interfering ribonucleic acid,siRNA)靶向沉默YKL-40,观察其对气道平滑肌增殖及迁移的影响,以期为支气管哮喘机制研究提供基础资料。
1 材料与方法
1.1 主要试剂和设备
胎牛血清(购自美国Hyclone公司),DMEM高糖培养基、胰蛋白酶、四甲基偶氮唑蓝(tetramethylazo blue,MTT)及二甲基亚砜(dimethyl sulfoxide,DMSO)(购自美国Gibco公司),DMEM培养基及Trizol总核糖核酸(ribonucleic acid,RNA)提取试剂盒(购自美国Invitrogen公司),逆转录和聚合酶链反应(polymerase chain reaction,PCR)试剂盒(均购自辽宁省大连宝生物有限公司),YKL-40及内参引物、干扰序列和阴性序列均由生工生物工程(上海)股份有限公司设计合成,METAFECTENE PRO转染试剂(购自德国Biontex公司),免疫组织化学染色试剂盒(购自北京中杉金桥生物公司),MTT细胞增殖及细胞毒性检测试剂盒(购自北京碧云天生物公司),兔抗人YKL-40多克隆抗体(购自美国Quidel公司),白细胞介素4(interleukin 4,IL-4)抗体(购自上海博升生物公司),干扰素γ(interferon-γ,IFN-γ)抗体(购自上海瑞齐生物有限公司),Transwell小室(购自美国Corning Costar公司),酶标分析仪(购自美国Bio-RAD公司)。
1.2 方法
1.2.1 复制小鼠哮喘模型20只健康雌性BALB/c小鼠购自河南省实验动物中心,4~6周龄,饲养于标准环境下,自由饮水、进食,利用随机数字表将小鼠随机分为健康组和哮喘组,哮喘组参考文献[7]中的方法复制小鼠哮喘模型:第1天将0.2ml抗原溶液(10%卵蛋+10%氢氧化铝)腹腔注射致敏,14 d后,采取超声雾化的方式吸入2.5%的卵蛋约40min以诱发哮喘,复制成功标志是小鼠出现呛咳、烦躁、轻度发绀和呼吸加快等哮喘发作表现,间隔1d,再次诱发,连续进行6周。健康组小鼠处理与哮喘组相同,只是将致敏物换成生理盐水。两组小鼠均于最后1次雾化吸入后24 h时,采取脱颈处死,留取气管和支气管进行细胞培养,取左肺中叶进行苏木精-伊红(hematoxylin-euphorbia,HE)染色观察,其余肺组织利用组织铁块法分别对两组小鼠气道壁平滑肌细胞进行培养,连续培养5代。
1.2.2 小鼠气道壁平滑肌细胞分组和转染 两组小鼠气道壁平滑肌细胞根据转染物不同进行分组:siRNA-YKL-40组[转染siRNA-YKL-40序列,正向引物:5'-CAAUGUAAGACUCGGGAUUUU-3';反向引物:5'-(P)AAUCCCGAGUCUUACAUUGUU-3'];阴性对照组(转染siRNA-NC:5'-UGGUUUACAUGUCG ACUAA-3')和空白对照组(只加入磷酸盐缓冲溶液(phosphate buffered saline,PBS)。将小鼠气道壁平滑肌细接种于6孔板中,调整细胞密度为1×105/孔,于37℃恒温培养箱中培养。待细胞融合度达70%~80%时,弃去培养液,换成不含血清DMEM溶液,过夜培养,按照转染试剂盒说明进行转染,转染后置于37℃恒温培养箱中培养48 h完成后续实验。
1.2.3 MTT法检测不同转染组小鼠气道壁平滑肌细胞增殖情况 取转染后各组处于对数生长期的气道壁平滑肌细胞,接种于96孔板中,调整细胞密度为5×103个/孔,分别于培养48、72和96 h时,加入MTT液,继续培养4h,弃去培养液,加入DMSO,室温下振荡15min混匀。用酶标分析仪取570 nm波长处检测各孔吸光度A值。
1.2.4 Transwell法检测不同转染组小鼠气道壁平滑肌细胞迁移能力 取转染后各组培养48 h的气道壁平滑肌细胞,接种于24孔板,调整细胞密度为5×104个/孔,Transwell小室下室中加入含10%胎牛血清的DMEM液,于37℃培养箱中培养12 h,取出小室,轻轻去除小室上室培养基,甲醛固定6min,结晶紫染色8min,利用倒置显微镜进行观察,随机选取5个视野进行拍照,计数穿膜细胞数。
1.2.5 实时荧光定量PCR(qRT-PCR)检测不同转染组小鼠气道壁平滑肌细胞中YKL-40、IL-4和IFN-γ基因表达 取转染后培养48 h小鼠气道壁平滑肌细胞,细胞裂解液裂解后,用Trizol总RNA提取试剂盒对总RNA进行提取,用紫外分光光度计对总RNA纯度进行检测,取A280/A260≥1.80作为合格样品。用逆转录试剂盒逆转录为模板单链互补脱氧核糖核酸(complementary DNA,cDNA),以cDNA为模板进行PCR。基因序列。YKL-40正向引物:5'-CCTGCTCAGCGCAGCACTGT-3',反向引物:5'-GCT TTTGACGCTTTCCTGGTC-3';IL-4正向引物:5'-AG CAGTTCCACAGGCACAAG-3',反向引物:5'-CTGGG TGGCTTCCTTCACAG-3';IFN-γ正向引物:5'-AGA GGATGGTTTGCATCTGGGTCA-3';反向引物:5'-AC AACGCTATGCAGCTTGTTCGTG-3'。甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH),正向引物:5'-ACCACAGTCCATGCCATCA C-3',反向引物:5'-TCCACCACCCTGTTGCTGTA-3'。反应条件:94℃预变性1min,92℃变性45 s,58℃退火30 s,72℃延伸30 s,连续进行40次循环,每个样品均设置3个平行反应复孔。用2-△△Ct法获得不同转染组小鼠气道壁平滑肌细胞中YKL-40、IL-4和IFN-γ相对表达量。
1.2.6 蛋白质印迹法检测不同转染组小鼠气道壁平滑肌细胞中YKL-40、IL-4和IFN-γ蛋白表达取转染后培养48 h小鼠气道壁平滑肌细胞,细胞裂解液裂解后,利用总蛋白提取试剂盒对总蛋白进行提取,利用总蛋白检测试剂盒检测纯度,加热变性。取30 μg蛋白,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳进行电泳,电转移到聚偏氟乙烯膜,用5%脱脂奶粉进行封闭2h,缓冲盐溶液冲洗,分别加入一抗YKL-40多克隆抗体、IL-4抗体和IFN-γ抗体(稀释比分别为1∶200、1∶500和1∶800),4℃过夜孵育,加入二抗,室温下孵育45min,TBST冲洗5次,用电化学发光试剂盒进行发光显影,拍照并用Quantity One软件进行分析,对细胞中YKL-40、IL-4和IFN-γ蛋白表达量进行分析。
1.3 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较用单因素方差分析,组间两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠哮喘模型鉴定
哮喘组小鼠在复制过程中均出现烦躁、呼吸急促、呛咳、四肢震颤、活动减少及抓挠等表现,随着致敏时间推移,严重的小鼠出现轻度口鼻发绀、点头呼吸及反应迟钝表现;健康组小鼠则在整个复制过程中未出现异常表现,呼吸、进食及行为正常。对两组小鼠肺组织进行免疫组织化学染色观察,哮喘组小鼠气道上皮造破坏,支气管周围出现大量炎症细胞浸润,平滑肌细胞层出现增厚;健康组小鼠气道上皮完整,支气管周围未见炎症细胞,平滑肌正常。见图1。
2.2 不同转染组小鼠气道壁平滑肌细胞增殖情况比较
哮喘组中siRNA-YKL-40组48~96 h时细胞吸光度A值均低于阴性对照组和空白对照组,差异有统计学意义(F=32.944、5.182和11.839,P=0.000、0.012和0.000);哮喘组中siRNA-YKL-40组、阴性对照组和空白对照组48~96 h时细胞吸光度A值均高于健康组,差异有统计学意义(t=5.362、12.918、10.148、7.056、7.901、7.906、3.389、6.327和7.828,均P=0.000)。见表1。
2.3 不同转染组小鼠气道壁平滑肌细胞迁移能力比较

图1 小鼠肺组织病理学改变 (免疫组织化学×100)
哮喘组中 siRNA-YKL-40组迁移细胞数(86.38±8.61)个,低于阴性对照组和空白对照组,分别为(179.64±11.32)和(176.51±9.26)个,差异有统计学意义(F=288.926,P<0.05);健康组中siRNAYKL-40组、阴性对照组和空白对照组迁移细胞数分别为(61.35±4.98)、(65.68±6.42)和(63.42±5.71)个,差异无统计学意义(F=3.180,P=0.53);哮喘组迁移细胞数均高于健康组,差异有统计学意义(t=8.827、29.676、45.165,均P=0.000)。见图2、3。
2.4 不同转染组小鼠气道壁平滑肌细胞中YKL-40、IL-4和IFN-γ基因表达
哮喘组和健康组中siRNA-YKL-40组YKL-40信使RNA(messenger RNA,mRNA)相对表达量均低于阴性对照组和空白对照组,差异有统计学意义(F=21.019和 798.315,均 P=0.000);哮喘组中siRNA-YKL-40组IL-4 mRNA相对表达量均低于阴性对照组和空白对照组,而IFN-γ mRNA相对表达量和IFN-γ/IL-4均高于阴性对照组和空白对照组,差异有统计学意义(F=20.769、3.456及9.933,P=0.000、0.046及0.001);与健康组比较,哮喘组中siRNA-YKL-40组、阴性对照组和空白对照组IL-4mRNA相对表达量均升高,而IFN-γ mRNA相对表达量和IFN-γ/IL-4均降低,差异有统计学意义(t=21.419、33.695、47.787、23.115、16.665、31.470、11.699、24.122和66.060,均P=0.000)。见表2。
表1 不同转染组小鼠气道壁平滑肌细胞增殖情况比较(A值±s)
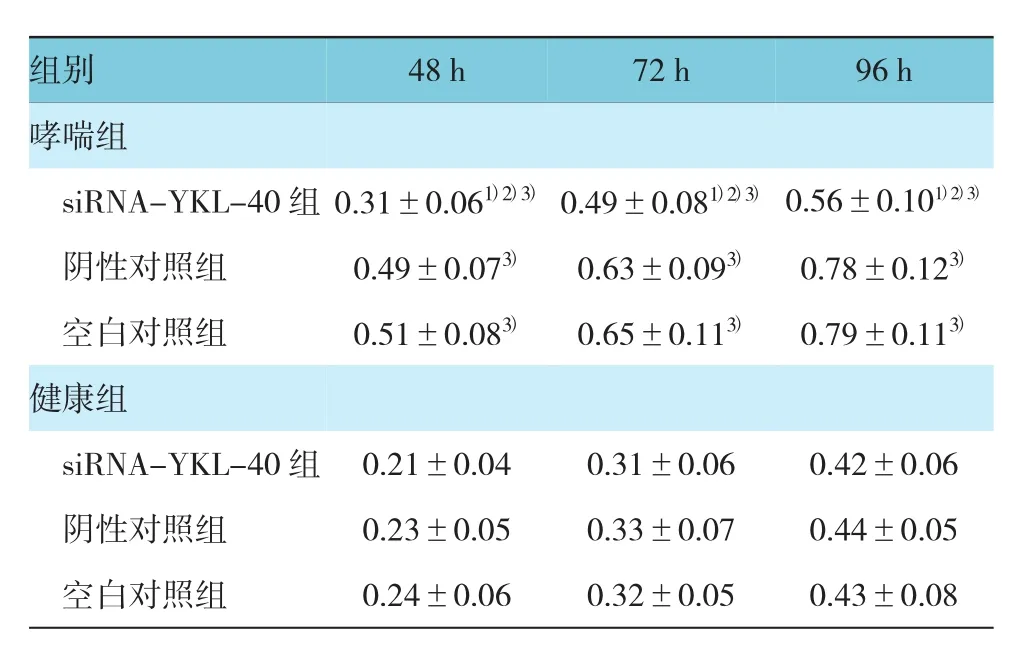
表1 不同转染组小鼠气道壁平滑肌细胞增殖情况比较(A值±s)
注:1)与同组空白对照组比较,P<0.05;2)与同组阴性对照组比较,P<0.05;3)与健康组相应亚组比较,P<0.05
组别48 h72 h96 h哮喘组siRNA-YKL-40组 0.31±0.061)2)3)0.49±0.081)2)3)0.56±0.101)2)3)阴性对照组 0.49±0.073)0.63±0.093)0.78±0.123)空白对照组 0.51±0.083)0.65±0.113)0.79±0.113)健康组siRNA-YKL-40组 0.21±0.04 0.31±0.06 0.42±0.06阴性对照组 0.23±0.05 0.33±0.07 0.44±0.05空白对照组 0.24±0.06 0.32±0.05 0.43±0.08

图2 哮喘组中不同转染组小鼠气道壁平滑肌细胞迁移细胞比较

图3 健康组中不同转染组小鼠气道壁平滑肌细胞迁移细胞比较
2.5 不同转染组小鼠气道壁平滑肌细胞中YKL-40、IL-4和IFN-γ蛋白表达
哮喘组和健康组中siRNA-YKL-40组YKL-40蛋白相对表达量均低于阴性对照组和空白对照组,差异均有统计学意义(F=17.386、9.481,P<0.05);哮喘组中siRNA-YKL-40组IL-4蛋白相对表达量均低于阴性对照组和空白对照组,而IFN-γ蛋白相对表达量和IFN-γ/IL-4均高于阴性对照组和空白对照组,差异有统计学意义(F=7.810、3.990和12.283,P<0.05);与健康组比较,哮喘组中siRNA-YKL-40组、阴性对照组和空白对照组IL-4蛋白相对表达量均升高,而IFN-γ蛋白相对表达量和IFN-γ/IL-4均降低,差异有统计学意义(t=10.115、4.874、19.059、11.490、4.890、13.474、11.886、3.266和10.634,P=0.000、0.000、0.000、0.000、0.000、0.000、0.000、0.002和0.000)。见表3和图4、5。
表2 不同转染组小鼠气道壁平滑肌细胞中YKL-40、IL-4及IFN-γ基因表达 (±s)
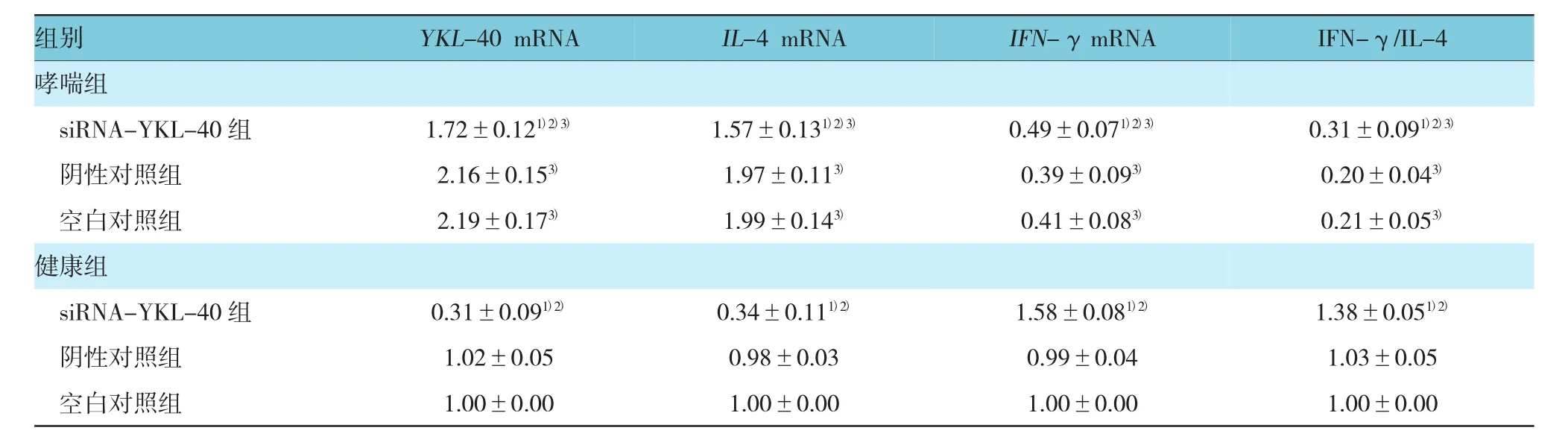
表2 不同转染组小鼠气道壁平滑肌细胞中YKL-40、IL-4及IFN-γ基因表达 (±s)
注:1)与同组空白对照组比较,P<0.05;2)与同组阴性对照组比较,P<0.05;3)与健康组相应亚组比较,P<0.05
组别YKL-40 mRNAIL-4 mRNAIFN-γmRNAIFN-γ/IL-4哮喘组siRNA-YKL-40组 1.72±0.121)2)3)1.57±0.131)2)3)0.49±0.071)2)3)0.31±0.091)2)3)阴性对照组 2.16±0.153)1.97±0.113)0.39±0.093)0.20±0.043)空白对照组 2.19±0.173)1.99±0.143)0.41±0.083)0.21±0.053)健康组siRNA-YKL-40组 0.31±0.091)2)0.34±0.111)2)1.58±0.081)2)1.38±0.051)2)阴性对照组 1.02±0.05 0.98±0.03 0.99±0.04 1.03±0.05空白对照组 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00
表3 不同转染组小鼠气道壁平滑肌细胞中YKL-40、IL-4及IFN-γ蛋白表达 (±s)
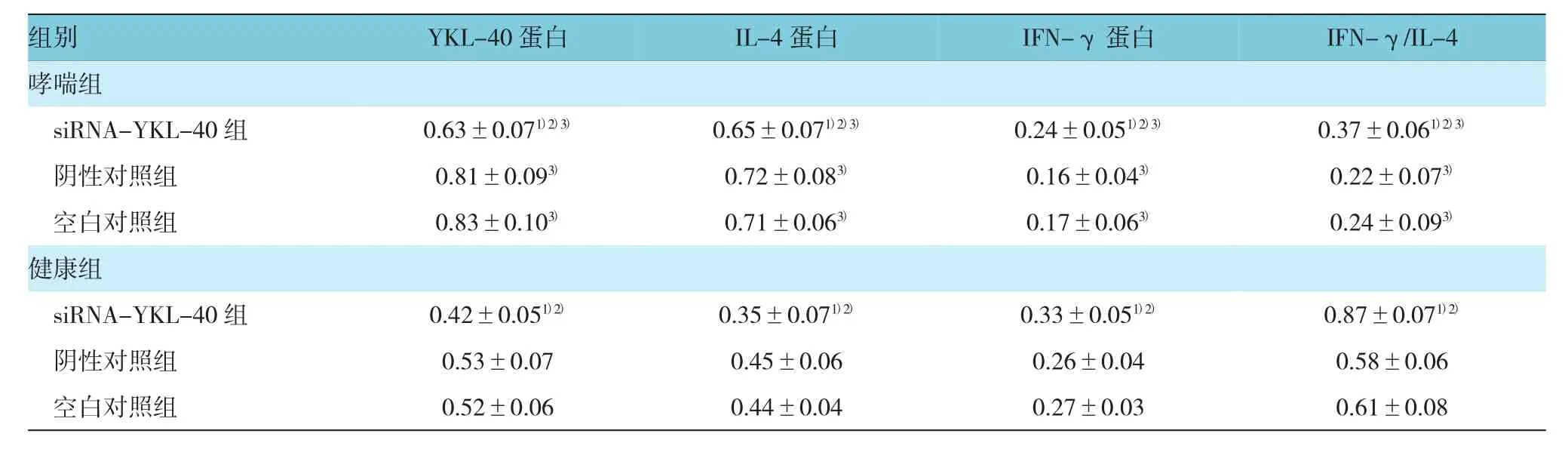
表3 不同转染组小鼠气道壁平滑肌细胞中YKL-40、IL-4及IFN-γ蛋白表达 (±s)
注:1)与同组空白对照组比较,P<0.05;2)与同组阴性对照组比较,P<0.05;3)与健康组相应亚组比较,P<0.05
组别YKL-40蛋白IL-4蛋白IFN-γ蛋白IFN-γ/IL-4哮喘组siRNA-YKL-40组 0.63±0.071)2)3)0.65±0.071)2)3)0.24±0.051)2)3)0.37±0.061)2)3)阴性对照组 0.81±0.093)0.72±0.083)0.16±0.043)0.22±0.073)空白对照组 0.83±0.103)0.71±0.063)0.17±0.063)0.24±0.093)健康组siRNA-YKL-40组 0.42±0.051)2)0.35±0.071)2)0.33±0.051)2)0.87±0.071)2)阴性对照组 0.53±0.07 0.45±0.06 0.26±0.04 0.58±0.06空白对照组 0.52±0.06 0.44±0.04 0.27±0.03 0.61±0.08

图4 哮喘组中不同转染组细胞中YKL-40、IL-4和IFN-γ蛋白表达

图5 健康组中不同转染组细胞中YKL-40、IL-4和IFN-γ蛋白表达
3 讨论
哮喘作为最为常见的慢性呼吸系统疾病,近年来发病率呈上升趋势,病情迁延反复,严重影响人类健康。该病以气道慢性炎症及气道高反应性为特征,发病机制较为复杂,多种炎症因子和炎症细胞均参与哮喘发病过程,Th1/Th2平衡失调被认为在哮喘病程中发挥重要作用[8]。YKL-40是一种壳质酶的衍生物,在组织纤维化、促进炎症反应、组织重塑、细胞增殖及凋亡等多种生物学过程中发挥重要作用[9]。研究表明[10],哮喘患者急性发作时血浆YKL-40水平升高,且与哮喘严重程度及气道重构等密切相关。
本研究显示,通过腹腔注射致敏及雾化吸入诱导的方式可使小鼠出现哮喘表现,免疫组织化学染色显示,哮喘组小鼠气道上皮造破坏,支气管周围出现大量炎症细胞浸润,平滑肌细胞层出现增厚,提示成功复制小鼠哮喘模型。研究表明[11],支气管上皮细胞体量增加,异常增殖及向表皮层迁移聚集在哮喘病程中发挥重要作用。本研究显示,哮喘组中siRNAYKL-40组48~96 h时细胞吸光度A值均低于阴性对照组和空白对照组,哮喘组中siRNA-YKL-40组、阴性对照组和空白对照组48~96 h时细胞吸光度A值均高于健康组,说明哮喘小鼠气道平滑肌细胞出现异常增殖,而特异性抑制YKL-40表达,可抑制气道平滑肌细胞增殖。本研究还显示,哮喘组中siRNAYKL-40组siRNA-YKL-40组迁移细胞数低于阴性对照组和空白对照组,哮喘组迁移细胞数均高于健康组,说明哮喘小鼠气道平滑肌细胞异常迁移在哮喘发病中发挥重要作用,而抑制YKL-40基因则可减少细胞迁移细胞数,进一步提示YKL-40参与哮喘发病过程可能通过调节气道平滑肌细胞增殖及迁移而直接参与气道重构,与肖琳等[12]研究结论相似。
研究表明[13],慢性炎症反应及大量释放的炎症介质与气道重塑密切相关。有研究指出[14],YKL-40在Th2诱导的炎症反应、细胞因子释放及组织重构中发挥重要作用,YKL-40可促进Th2分化及增加Th2数量。而Th1/Th2平衡失调在哮喘发病中发挥重要作用[15]。研究表明[16],Th细胞所处局部环境中的细胞因子在Th1/Th2极化中发挥关键性作用,其中,Ⅰ型细胞因子,如IFN-γ可促进向Th1分化,而Ⅱ型细胞因子,如IL-4,则促进向Th2分化。本研究显示,哮喘组中siRNA-YKL-40组IL-4基因和蛋白相对表达量均低于阴性对照组和空白对照组,而IFN-γ基因和蛋白相对表达量和IFN-γ/IL-4均高于阴性对照组和空白对照组,与健康组比较,哮喘组中siRNA-YKL-40组、阴性对照组和空白对照组IL-4基因和蛋白相对表达量均升高,而IFN-γ基因和蛋白相对表达量和IFN-γ/IL-4均降低,说明哮喘小鼠气道壁平滑肌细胞中细胞因子IL-4和IFN-γ出现表达异常,破坏Th1/Th2平衡,从而诱导气道慢性炎症反应及气道重构,而特异性抑制YKL-40表达,则可减少IL-4表达,促进IFN-γ表达,使IFN-γ/IL-4比值接近正常,从而纠正Th1/Th2平衡,提示YKL-40可能通过调节IL-4/IFN-γ失衡状态而实现对炎症反应及气道重构的影响。本研究亦显示,在抑制正常气道壁平滑肌细胞中YKL-40表达后,IFN-γ/ IL-4平衡未被打破,笔者推测可能正常气道壁平滑肌细胞具有一定的自我调节及修复过程,在一定范围内可维持IFN-γ/IL-4平衡。
综上所述,特异性抑制YKL-40表达可抑制气道壁平滑肌细胞增殖及迁移,可能与调节IL-4/IFN-γ失衡状态而减少气道炎症反应有关,但具体调控机制尚待进一步研究明确。
[1]沙莉,邵明军,刘传合,等.2010年与2000年中国城市儿童支气管哮喘患病率比较[J].中华结核和呼吸杂志,2015,38(9):664-668.
[2]IDREESM,FITZGERALD J M.Vocal cord dysfunction in bronchial asthma:a review article[J].Journal of Asthma,2015, 52(4):327-335.
[3]AMIN K.The role of the T lymphocytes and remodeling in asthma[J].Inflammation,2016,39(4):1475-1482.
[4]SIDDIQUI S,REDHU N S,OJO O O,et al.Emerging airway smooth muscle targets to treat asthma[J].Pulm Pharmacol Ther, 2013,26(1):132-144.
[5]LIBREROS S,IRAGAVARAPU-CHARYULU V.YKL-40/CHI3L1 drives inflammation on the road of tumor progression[J].Journal of Leukocyte Biology,2015,98(6):931-936.
[6]USEMANN J,FREY U,MACK I,et al.CHI3L1 polymorphisms, cord blood YKL-40 levels and later asthma development[J].BMC Pulm Med,2016,16(1):81-86.
[7]YUAN Y,YANG B,YE Z,et al.Sceptridium ternatum extract exerts antiasthmatic effects by regulating Th1/Th2 balance and the expression levels of leukotriene receptors in a mouse asthma model[J].Journal of Ethnopharmacology,2013,149(3):701-706.
[8]ROGALA B,BOZEK A,GLUCK J,et al.Prevalence of IgE-mediated allergy and evaluation of Th1/Th2 cytokine profiles in patients with severe bronchial asthma[J].Postepy Dermatol Alergol,2015,32(4):274-280.
[9]MATHIASEN A B,HENNINGSEN K M,HARUTYUNYAN M J, et al.YKL-40:a new biomarker in cardiovascular disease[J]. Biomark Med,2010,4(4):591-600.
[10]李宗平,屈玲玲,崔丹萍,等.甲壳质酶蛋白在不同气道炎症表型哮喘患者的表达及其与哮喘的相关性[J].中华临床免疫和变态反应杂志,2015,9(4):302-306.
[11]KIM M J,HONG J Y,LEE K E,et al.Effect of cholesterol depletion on interleukin-8 production in human respiratory epithelial cells[J].Allergy Asthma&Immunology Research,2013, 5(6):402-408.
[12]肖琳,石昭泉,李兵,等.YKL-40调控支气管上皮分泌IL-8对支气管平滑肌细胞增殖和迁移的影响[J].中国免疫学杂志,2014, 30(12):1591-1595.
[13]LUCINI V,CIRACI R,DUGNANI S,et al.Antibiotics counteract the worsening of airway remodelling induced by infections in asthma[J].International Journal of Antimicrobial Agents,2014, 43(5):442-450.
[14]LEE CG,ELIAS JA.Role of breast regression protein-39/YKL-40 in asthma and allergic responses[J].Allergy Asthma&Immunology Research,2010,2(1):20-27.
[15]ROGALA B,BOZEK A,GLUCK J,et al.Prevalence of IgE-mediated allergy and evaluation of Th1/Th2 cytokine profiles in patients with severe bronchial asthma[J].Postepy Dermatol Alergol,2015,32(4):274-280.
[16]DAS M,TOMAR N,SREENIVAS V,et al.Effect of vitamin D supplementation on cathelicidin,IFN-γ,IL-4 and Th1/Th2 transcription factors in young healthy females[J].European Journal of Clinical Nutrition,2014,68(3):338-343.
Effect of silencingYKL-40by siRNA on proliferation and migration of airway smooth muscle cells in asthmatic mice*
Lian-kui Han,Chuan Xu,Hong Mei,Yong-pan Sun,Bo Liu
(Department of Thoracic Surgery,Guizhou Provincial People's Hospital, Guiyang,Guizhou 550002,China)
ObjectiveTo investigate the effects of silencing human cartilage glycoprotein-39(YKL-40)by small interfering ribonucleic acid (siRNA)on the proliferation and migration of airway smooth muscle cells in asthmatic mice.MethodsTwenty healthy female BALB/c mice were randomly divided into healthy group (n=10)and asthma group (n=10).Asthma models were established by intraperitoneal injection of antigens and inhalation of ovum (OVA).The mice in the healthy group were treated the same as the asthma group,except that the sensitizers were replaced by saline.Tracheal and bronchial tubes were used for cell culture.According to the different transfectants,the airway smooth muscle cells of the two groups were divided into siRNA-YKL-40 group,negative control group and blank control group.The proliferation of airway smooth muscle cells of mice in different transfected groups were detected by MTT assay.The migration abilities of airway smooth muscle cells of mice in different transfected groups were detected by Transwell assay.The expressions ofYKL-40,interleukin 4 (IL-4)and interferon-γ (IFN-γ)genes and proteins in airway smooth muscle cells in different transfected groups were detected by qRT-PCR and Western blot,respectively.ResultsIn the asthma group,the absorbance A values at 48,72 and 96 h of the siRNA-YKL-40 group were significantly lower than the negative control group and blank control group and the absorbance A values at 48,72 and 96 h of the siRNA-YKL-40 group,negative control group and blank control group in the asthma group were significantly higher than the healthy group, (P<0.05).In the asthma group,the number of migrated cells of the siRNA-YKL-40 group was (86.38±8.61),which was significantly lower than the negative control group and blank control group and the number of migrating cells of the asthma group was significantly higher than the healthy group(P<0.05).In the asthma group and the healthy group,the relative expression levels ofYKL-40gene and protein in the siRNA-YKL-40 group were lower than the negative control group and blank control group (P<0.05),in the asthma group,the relative expression levels ofIL-4 gene and protein in the siRNA-YKL-40 group were lower than the negative control group and blank control group,while the relative expression levels ofIFN-γgene and protein and the value of IFN-γ/IL-4 were significantly higher than the negative control group and blank control group (P<0.05).Compared with the healthy group,the relative expression levels ofIL-4gene and protein in the siRNA-YKL-40 group,negative control group and blank control group in the asthmatic group were significantly increased,while the relative expression levels ofIFN-γ gene and protein and the value of IFN-γ/IL-4 were significantly decreased (P<0.05).ConclusionsGene silencing targeting YKL-40 inhibits airway smooth muscle cell proliferation and migration.It might be related to the regulation of the imbalance of IL-4/IFN-γ to reduce airway inflammation.
bronchial asthma;human cartilage glycoprotein-39;RNA silencing;cell proliferation;cell migration
R562.25
A
10.3969/j.issn.1005-8982.2017.18.003
1005-8982(2017)18-0015-07
2017-01-11
贵州省科技计划(黔科合SY字,No:20123101)
许川,E-mail:3219475665@qq.com;Tel:15985156446

