胃肠转流术对链脲佐菌素所致大鼠胰腺损伤的影响
张琪,郑阳,杨光华,单雨静,赵永魁,张博,陈建立,张国志,王长友
(华北理工大学附属医院,唐山063000)
胃肠转流术对链脲佐菌素所致大鼠胰腺损伤的影响
张琪,郑阳,杨光华,单雨静,赵永魁,张博,陈建立,张国志,王长友
(华北理工大学附属医院,唐山063000)
目的 探讨胃肠转流术对链脲佐菌素(STZ)所致胰岛损伤大鼠的影响并探讨其机制。方法 选择SD大鼠30只,随机分为空白对照组、模型组、代谢手术组各10只。代谢手术组行改良Roux-en-Y胃肠转流术,空白对照组、模型组仅做单纯开腹、关腹处理。手术7 d后,模型组、代谢手术组均腹腔注射STZ建立糖尿病模型,空白对照组腹腔注入等量生理盐水。分别于造模前1天、造模后第7、14天时抽取各组大鼠空腹尾静脉血,检测血糖水平。于造模前1天、造模后2 h、造模后第7、14天时抽取空腹尾静脉血,采用ELISA法检测血浆C肽水平,以评价胰岛损伤情况。于造模前1天、造模后24 h、造模后第7天时抽取空腹尾静脉血,采用ELISA法检测血浆TNF-α水平。于造模第2天时取胰腺组织,采用Western blotting法检测凋亡相关蛋白B细胞淋巴瘤-2相关蛋白X(Bax)、B细胞淋巴瘤蛋白-2(Bcl2)、C/EBP环磷酸腺苷反应元件结合转录因子同源蛋白(CHOP)表达。结果 造模后第7、14天时,模型组血糖高于造模前及同时间点空白对照组,代谢手术组血糖低于模型组(P均<0.01)。造模后第7、14天时,模型组血浆C肽水平均低于造模前及同时点空白对照组,代谢手术组血浆C肽水平均低于模型组(P均<0.01)。造模后24 h及第7天时,模型组血浆TNF-α水平均高于造模前及同时间点空白对照组,代谢手术组血浆TNF-α水平均低于模型组(P均<0.01)。与代谢手术组相比,模型组Bcl2蛋白表达降低,CHOP、Bax蛋白表达增高(P均<0.01)。结论 胃肠转流术可减轻STZ导致的大鼠胰腺组织损伤,其机制可能与减轻胰岛细胞的炎症反应、抑制胰岛细胞凋亡有关。
糖尿病;代谢手术;胃肠转流术;链脲佐菌素;胰岛;凋亡;炎症
根据流行病学调查统计,中国糖尿病总人数已达9 000万,已经成为糖尿病患病率最高的国家[1]。目前,我国对于糖尿病的治疗方法仍然是依靠降糖药物及胰岛素注射等传统药物方式。糖尿病的外科手术由减肥手术演变而来[2],随后Pories等[3]第一次报道了代谢手术治疗糖尿病的效果。目前,代谢手术的应用主要包含限制性手术和胃肠转流术两种手术方式。前瞻性研究指出,在所有手术方式中,胃肠转流术的治疗效果最佳,因此,胃肠转流术已被作为代谢手术的金标准[4]。多个临床研究表明,采用代谢手术可使糖尿病患者达到临床缓解甚至临床完全“治愈”,但具体机制尚不清楚。本课题组在进行胰岛移植实验中偶然发现,若先行胃肠转流术再经腹腔注射链脲佐菌素(STZ)建立糖尿病模型时,大鼠胰岛的破坏及糖尿病的发生并没有预想中的出现,即使出现也很轻微[5]。因此我们推测,胃肠转流术可能对糖尿病大鼠胰岛的破坏和功能损伤具有一定的保护作用,但其是否可用于糖尿病的预防和治疗尚不明确。2016年3~12月,我们对SD大鼠采用改良Roux-en-Y胃肠转流术后再经腹腔注射STZ,观察胃肠转流术对STZ所致大鼠胰岛损伤的影响,探讨代谢手术预防和治疗糖尿病的作用机制。
1 材料与方法
1.1 材料及试剂 SPF级雄性SD大鼠30只,体质量250~300 g,购自北京维通利华实验动物技术有限公司。链脲佐菌素(STZ)购于美国Sigma-Aldrich公司;大鼠C肽酶联免疫吸附测定试剂盒及炎性因子TNF-α酶联免疫吸附测定试剂盒购于美国Rapidbio公司;B细胞淋巴瘤蛋白-2(Bcl2)、C/EBP环磷酸腺苷反应元件结合转录因子同源蛋白(CHOP)、B细胞淋巴瘤-2相关蛋白X(Bax)单抗购于美国Sigma公司;羊抗兔、羊抗鼠IgG/HRP 及Western 印迹相关试剂购于北京Solarbio科技有限公司。
1.2 分组及干预方法 应用随机数字表法将30只大鼠分为3组即空白对照组、模型组、代谢手术组,每组各10只。代谢手术组行改良Roux-en-Y胃肠转流术[6]。大鼠术前称重,按0.2 g/kg水合氯醛腹腔注射麻醉后固定于手术台,取上腹部正中切口进入腹腔,结扎幽门后,于Treitz韧带以远10 cm处切断空肠并结扎封闭两断端,将远端空肠与胃做侧侧吻合,近端空肠于胃-空肠吻合口以远15 cm处与远端空肠做侧侧吻合。术后当天禁食水,术后第1天喂食糖盐水,术后第2天给予肠外营养液,术后第3天恢复正常饲养。空白对照组、模型组仅做单纯开腹、关腹处理。
1.3 模型制备 手术7 d后,模型组、代谢手术组均按60 mg/kg腹腔注射STZ建立糖尿病模型。空白对照组腹腔注射等量生理盐水。
1.4 血糖检测 分别于造模前1天、造模后第7、14天时,抽取各组大鼠空腹尾静脉血,检测血糖水平。
1.5 血浆C肽水平检测 分别于造模前1天、造模后2 h、造模后第7、14天时,抽取各组大鼠空腹尾静脉血,采用ELISA法检测血浆C肽水平,以评价胰岛损伤情况。
1.6 血浆TNF-α水平检测 分别于造模前1天、造模后24 h、造模后第7天时,抽取各组大鼠空腹尾静脉血,采用ELISA法检测血浆TNF-α水平。
1.7 胰腺组织凋亡相关蛋白表达检测 采用Western blotting法检测胰腺组织凋亡相关蛋白Bcl2、CHOP、Bax表达。于造模第2天,各组随机选取2只大鼠处死,取胰腺组织,组织剪剪碎胰腺组织后上匀浆机充分研磨,RIPA裂解液充分裂解组织,离心收集蛋白。BCA法定量总蛋白,加入等体积2×蛋白上样缓冲液后100 ℃变性5 min,-80 ℃保存备用。进行SDS-PAGE蛋白电泳,行转膜、10%脱脂奶封闭,分别加入Bcl2、CHOP、Bax一抗(1∶1 000)孵育过夜,二抗(1∶100)37 ℃孵育2 h,荧光显色。Image J软件分析灰度值。蛋白表达量=(所测蛋白灰度值/内参灰度值)×100%。
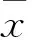
2 结果
2.1 各组血糖比较 造模后第7、14天时,模型组血糖高于造模前及同时间点空白对照组,代谢手术组血糖低于模型组(P均<0.01)。见表1。
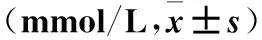
表1 各组不同时点血糖比较
注:与空白对照组同时点比较,*P<0.01;与代谢手术组同时点比较,﹟P<0.01。
2.2 各组血浆C肽水平比较 造模后第7、14天时,模型组血浆C肽水平均低于造模前及同时点空白对照组,代谢手术组血浆C肽水平均低于模型组(P均<0.01)。见表2。
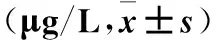
表2 各组不同时点血浆C肽水平比较
注:与空白对照组同时点比较,*P<0.01;与代谢手术组同时点比较,﹟P<0.01。
2.3 各组血浆TNF-α水平比较 造模后24 h及第7天时,模型组血浆TNF-α水平均高于造模前及同时间点空白对照组,代谢手术组血浆TNF-α水平均低于模型组(P均<0.01)。
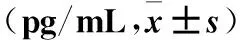
表3 各组不同时点血浆TNF-α水平比较
注:与空白对照组同时点比较,*P<0.01;与代谢手术组同时点比较,﹟P<0.01。
2.4 各组胰腺组织凋亡相关蛋白表达比较 与代谢手术组相比,模型组Bcl2蛋白表达降低,CHOP、Bax蛋白表达增高(P均<0.01)。代谢手术组与空白对照组各蛋白表达差异无统计学意义(P均>0.05)。见表4。
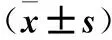
表4 各组胰腺组织Bcl2、CHOP、Bax蛋白表达比较
注:与空白对照组比较,*P<0.01;与代谢手术组比较,﹟P<0.01。
3 讨论
与过去20年相比,我国糖尿病发病率已经增加了近4倍,其中,2型糖尿病占93.7%[7]。外科干预治疗2型糖尿病是一种新型方案。目前研究显示,与传统内科治疗方法相比,代谢手术在缓解2型糖尿病、减少并发症发生、控制体质量方面具有更明显的优势[8, 9]。荟萃分析研究显示[10],在降低患者血糖水平、减少用药量、降低并发症发生率等方面,对
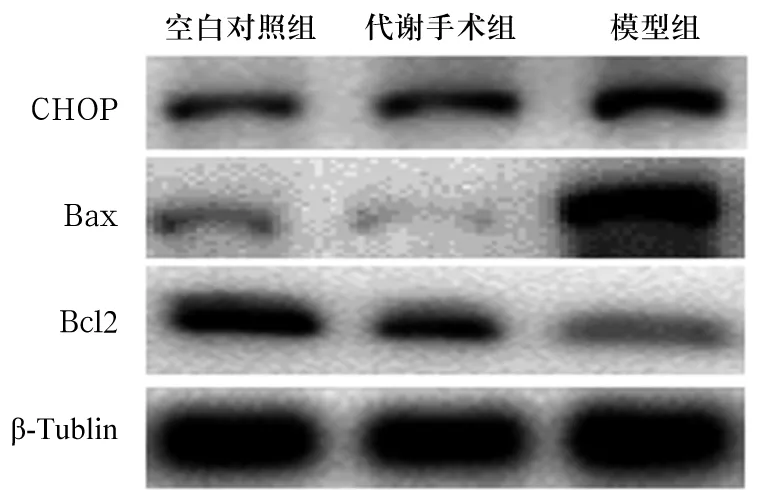
图1 各组Bcl2、CHOP、Bax蛋白表达比较(Western blotting法)
2型糖尿病患者最有效的手术方式为胃肠转流术。目前,胃肠转流术已成为代谢手术中最有效且常用的手术方式。代谢手术方式中的胃肠转流术在治疗糖尿病上的效果已经越来越得到学术界专家的认可,在临床上也得到了多次的验证,但是对于胃肠转流术治疗糖尿病的机制目前仍不明确。本课题组前期中发现,先行胃肠转流术再经腹腔注射STZ时,大鼠胰岛的破坏并不明显,糖尿病也并未出现,因此推测胃肠转流术可能对糖尿病大鼠胰岛的破坏和功能损伤具有一定的保护作用。
目前研究认为,代谢手术治疗糖尿病的主要机制是通过改变胃肠道的解剖结构,使近端消化道分泌的抑制胰岛β细胞功能、产生胰岛素抵抗的胰岛抑制性激素减少,远端消化道分泌的肠促胰岛激素增加,进而刺激胰岛β细胞对胰岛素的分泌和释放[11, 12]、增强胰岛素的敏感性[13]、促进胰岛β细胞的增殖[14]。空腹血浆C肽水平与胰岛功能呈正比关系。本研究发现,造模后第7、14天时,模型组血糖水平均高于造模前及同时点空白对照组和代谢手术组,模型组血浆C肽水平均低于造模前及同时点空白对照组和代谢手术组,提示代谢手术对于STZ所致的胰岛损伤具有保护作用,可以提高大鼠胰岛功能,保护胰岛细胞,进而发挥降低血糖作用[15]。
炎症因子和胰岛β细胞凋亡在胰岛素抵抗及2型糖尿病发病机理中的作用也逐渐受到学者们的关注[16~18]。胰岛素抵抗和2型糖尿病均呈现出一种慢性低度的炎症反应状态,表现为TNF-α等炎性因子水平升高,而TNF-α可通过使胰岛β细胞产生过多的自由基并诱导内质网应激,从而使之凋亡[19, 20]。研究证实,代谢手术后患者炎症因子水平明显降低,并且对胰岛素抵抗和2型糖尿病相关并发症的远期改善率有益[21]。本研究发现,造模后24 h及第7天时,模型组血浆TNF-α水平高于空白对照组,且代谢手术组血浆TNF-α水平低于模型组,提示糖尿病大鼠血浆TNF-α水平增高,出现炎症反应,而代谢手术可以减轻STZ所致的胰岛细胞炎症反应。
CHOP是内质网应激启动凋亡的重要信号分子,当出现内质网应激时CHOP可被大量激活,进而改变Bcl家族成员的表达,从而启动细胞凋亡[22]。本研究结果显示,模型组大鼠胰腺组织CHOP蛋白的表达较空白对照组和代谢手术组增高,提示糖尿病大鼠的胰腺组织存在CHOP介导的内质网应激、凋亡活性增强,而代谢手术可有效干预CHOP蛋白的表达,从而改善内质网应激、减少细胞凋亡,这可能是代谢手术保护胰岛损伤的作用机制之一。另外,代谢手术组大鼠胰腺组织Bcl2蛋白表达较模型组显著升高、Bax蛋白表达明显降低,提示代谢手术可能是通过下调Bcl2/Bax表达水平、抑制糖尿病大鼠胰岛细胞凋亡,进而发挥对胰腺组织的保护作用。
综上所述,胃肠转流术可减轻STZ导致的大鼠胰腺组织损伤,其机制可能与减轻胰岛细胞的炎症反应、抑制胰岛细胞凋亡有关。
[1] Drossman DA. The functional gastrointestinal disorders and the Rome III process[J]. Gastroenterology, 2006,130(5):1377-1390.
[2] Mason EE, Ito C. Gastric bypass in obesity[J]. Surg Clin North Am, 1967,47(6):1345-1351.
[3] Pories WJ, Swanson MS, MacDonald KG, et al. Who would have thought it? An operation proves to be the most effective therapy for adult-onset diabetes mellitus[J]. Ann Surg, 1995,222(3):339-350.
[4] Wong SK, Kong AP, Mui WL, et al. Laparoscopic bariatric surgery: a five-year review[J]. Hong Kong Med J, 2009,15(2):100-109.
[5] 郑阳. 胃转流术联合胰岛移植治疗糖尿病大鼠的实验研究[D]. 天津:天津医科大学, 2013.
[6] 胥平湘, 郑阳, 杨光华, 等. 改良式十二指肠空肠转流术动物模型的建立与评价[J]. 中国现代普通外科进展, 2015,18(10):830-832.
[7] Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010,362(12):1090-1101.
[8] Schauer PR, Bhatt DL, Kashyap SR. Bariatric surgery versus intensive medical therapy for diabetes[J]. N Engl J Med, 2014,371(7):682.
[9] Mingrone G, Panunzi S, De Gaetano A, et al. Bariatric surgery versus conventional medical therapy for type 2 diabetes[J]. N Engl J Med, 2012,366(17):1577-1585.
[10] Muller-Stich BP, Senft JD, Warschkow R, et al. Surgical versus medical treatment of type 2 diabetes mellitus in nonseverely obese patients: a systematic review and meta-analysis[J]. Ann Surg, 2015,261(3):421-429.
[11] Carswell KA, Belgaumkar AP, Amiel SA, et al. A systematic review and meta-analysis of the effect of gastric bypass surgery on plasma lipid levels[J]. Obes Surg, 2016,26(4):843-855.
[12] Kim SJ, Choi WS, Han JS, et al. A novel mechanism for the suppression of a voltage-gated potassium channel by glucose-dependent insulinotropic polypeptide: protein kinase A-dependent endocytosis[J]. J Biol Chem, 2005,280(31):28692-28700.
[13] Kwan EP, Gaisano HY. Glucagon-like peptide 1 regulates sequential and compound exocytosis in pancreatic islet beta-cells[J]. Diabetes, 2005,54(9):2734-2743.
[14] Kindel TL, Yoder SM, Seeley RJ, et al. Duodenal-jejunal exclusion improves glucose tolerance in the diabetic, Goto-Kakizaki rat by a GLP-1 receptor-mediated mechanism[J]. J Gastrointest Surg, 2009,13(10):1762-1772.
[15] Sims EK, Chaudhry Z, Watkins R, et al. Elevations in the fasting serum proinsulin-to-C-peptide ratio precede the onset of type 1 diabetes[J]. Diabetes Care, 2016,39(9):1519-1526.
[16] DePaula AL, Macedo AL, Mota BR, et al. Laparoscopic ileal interposition associated to a diverted sleeve gastrectomy is an effective operation for the treatment of type 2 diabetes mellitus patients with BMI 21-29[J]. Surg Endosc, 2009,23(6):1313-1320.
[17] Duncan BB, Schmidt MI, Pankow JS, et al. Low-grade systemic inflammation and the development of type 2 diabetes: the atherosclerosis risk in communities study[J]. Diabetes, 2003,52(7):1799-1805.
[18] Freeman DJ, Norrie J, Caslake MJ, et al. C-reactive protein is an independent predictor of risk for the development of diabetes in the West of Scotland Coronary Prevention Study[J]. Diabetes, 2002,51(5):1596-1600.
[19] Lu Z, Shen SX, Zhi DJ, et al. Protective effect of cotransfection of A20 and HO-1 gene against the apoptosis induced by TNF-alpha in rat islets in vitro[J]. Zhonghua Er Ke Za Zhi, 2013,51(6):420-425.
[20] Bhattacharjee A, Prasad SK, Pal S, et al. Possible involvement of iNOS and TNF-alpha in nutritional intervention against nicotine-induced pancreatic islet cell damage[J]. Biomed Pharmacother, 2016,84:1727-1738.
[21] Whitlock G, Lewington S, Sherliker P, et al. Body-mass index and cause-specific mortality in 900 000 adults: collaborative analyses of 57 prospective studies[J]. Lancet, 2009,373(9669):1083-1096.
[22] Lu HY, Chen XQ, Tang W, et al. GRP78 silencing enhances hyperoxia-induced alveolar epithelial cell apoptosis via CHOP pathway[J]. Mol Med Rep, 2017,16(2):1493-1501.
河北省医学科学研究重点课题计划项目(20150085);河北联合大学科学研究基金项目任务(Z201427)
王长友(E-mail: fhbj-2004@163.com)
10.3969/j.issn.1002-266X.2017.30.009
R587.1
A
1002-266X(2017)30-0033-04
2017-04-03)

