淀粉蛋白前β位分解酶1基因多态性与癫痫易感性的关系
王海东,江沛,何昕,宋兴发,
(1连云港市第一人民医院,江苏连云港222002;2济宁市第一人民医院;3中南大学湘雅二医院)
淀粉蛋白前β位分解酶1基因多态性与癫痫易感性的关系
王海东1,江沛2,3,何昕3,宋兴发1,3
(1连云港市第一人民医院,江苏连云港222002;2济宁市第一人民医院;3中南大学湘雅二医院)
目的 分析淀粉蛋白前β位分解酶1(BACE1)基因多态性与癫痫易感性的关系。方法 选取湖南地区238例癫痫患者为观察组(男129例,女109例)、体检健康者211例为对照组(男104例,女107例),均为汉族,采用PCR-连接酶检测反应(LDR)检测BACE1基因rs535860、rs525493、rs638405位点的多态性,分析其与癫痫发病的关系。结果 观察组BACE1基因rs535860基因型AT频率高于对照组(P=0.041),携带至少1个突变等位基因T(AT+TT)的个体癫痫发病风险是野生AA基因型的1.005倍(95%CI:0.382~2.616,P=0.048);两组BACE1基因rs525493、rs638405的基因型和等位基因分布差异无统计学意义(P均>0.05)。观察组男性癫痫患者BACE1基因s535860基因型AT频率高于对照组男性人群(P=0.004),携带至少1个突变等位基因T(AT+TT)的男性个体癫痫发病风险是野生AA基因型的2.585倍(95%CI:1.310~5.140,P=0.006 )。两组男性人群BACE1基因rs525493、rs638405及女性人群rs535860、rs525493、rs638405 的基因型和等位基因分布差异无统计学意义(P均> 0.05)。结论 BACE1基因rs535860突变杂合子AT基因型与癫痫的发病有关,在男性群体中更为显著。
癫痫;基因多态性;淀粉蛋白前β位分解酶1;性别差异;汉族;湖南省
癫痫发病机制十分复杂,可由多种因素引起,但遗传因素是其发病的重要原因[1,2]。β-淀粉样蛋白由β淀粉样前体蛋白水解而来,与阿尔兹海默病的发病密切相关。阿尔兹海默病与癫痫的发病存在相关性,早期显现智力衰退的癫痫患者会快速发展为痴呆[3]。淀粉蛋白前β位分解酶1(BACE1)是重要的β-淀粉样蛋白水解酶,其某些底物和突出损伤可能导致癫痫发作[4]。因此,探讨BACE1基因多态性与癫痫发病的关系,有助于癫痫发作机制及其治疗方法的探索。2013年6月~2015年12月,我们采取病例对照研究分析BACE1基因rs535860、rs525493、rs638405的多态性与汉族人群癫痫易感性的关联性。现报告如下。
1 资料与方法
1.1 临床资料 收集中南大学湘雅二医院小儿神经内科收治的癫痫患者238例(观察组),男129例、女109例,年龄(14.1±4.4)岁,均为汉族,首次发病年龄(4.3±2.9)岁,并排除皮质发育不良、脑部外伤、精神发育迟缓等神经精神病变。选择同期体检健康者211例(对照组),男104例、女107例,年龄(14.8±3.2)岁,均为汉族。两组性别、年龄、民族均具有可比性。本研究获医院伦理委员会批准,研究对象或监护人知情同意。
1.2 BACE1基因基因多态性检测方法 采用PCR-连接酶检测反应(LDR),仪器主要有PCR仪(MJ PTC-200/Gene Amp PCR)、测序仪PRISM 3730(ABI)、生物电泳图像分析系统(上海复日科技有限公司)、Agrose LE(上海捷倍思基因技术有限公司),其他试剂均为国产分析纯。按照SQ Blood DNA Kit Ⅱ说明书(D0714-250,美国OMEGA公司)提取全血DNA,测得DNA样品OD260/OD280在1.7~1.9。采用Primer3.0设计引物,探针和引物均由上海翼和应用生物技术公司设计并合成。rs535860上游引物为5′-AGGGAAACAAGCTTGGTCTC-3′,下游引物为5′-CAGAAGTACTGGCATCACAC-3′;rs525493上游引物为5′-GTCTCTTCCTGAAAGATTGC-3′,下游引物为5′-TTGGCCTTCAGATATAAGGG-3′;rs638405上游引物为5′-TCTCTGGTATACACCCATCC-3′ ,下游引物为5′-TCCTTGCAGTCCATTTTCAG-3′。PCR反应体系(20 μL):0.5 pmol/L的上下游引物各2 μL,1×PCR缓冲液2 μL,灭菌水12.2 μL,2 mmol/L的TaqDNA聚合酶0.2 μL,2 nmol/L 的dNTP 2 μL,基因组DNA(50 ng/μL)1 μL,3 mmol/L Mg2+0.6 μL。PCR反应条件:95 ℃预变性2 min;94 ℃变性30 s,50 ℃退火100 s,65 ℃延伸30 s,共40个循环;65 ℃延伸10 min。PCR产物用3.0%琼脂糖凝胶于TBE中电泳,观察PCR反应产物,进行PCR产物的LDR。LDR反应体系(10 μL):1×缓冲液1 μL,2 pmol/μL探针混合液1 μL,2 U Taq DNA连接酶0.05 μL,4 μL纯化的PCR产物,4 μL ddH2O。LDR反应条件:95 ℃预变性2 min;94 ℃变性15 s,50 ℃退火25 s,共40个循环。最终产物应用GeneMapper 4.1软件进行基因分型。利用NCBI网站在线对所获rs535860、rs525493、rs638405基因型序列进行对比分析。
1.3 统计学方法 应用SPSS17.0统计软件。各研究对象与Hardy-Weinberg平衡的符合程度用Pearsonχ2检验,基因型、等位基因频率比较行χ2检验。采用Logistic回归分析法校正年龄和性别因素后,对数据进行统计分析,以OR和95%CI表示BACE1基因多态性与癫痫易感性的关系。P<0.05为差异有统计学意义。
2 结果
2.1 Hardy-Weinberg平衡分析结果 各基因型分布符合Hardy-Weinberg遗传平衡定律(P>0.05),两组研究对象具有群体代表性。
2.2 BACE1基因多态性与癫痫易感性的关系 观察组BACE1基因rs535860基因型AT频率高于对照组(P=0.041),携带至少1个突变等位基因T(AT+TT)的个体癫痫发病风险是野生AA基因型的1.005倍(95%CI:0.382~2.616,P=0.048);两组BACE1基因rs525493、rs638405的基因型和等位基因分布差异均无统计学意义(P均>0.05)。见表1。
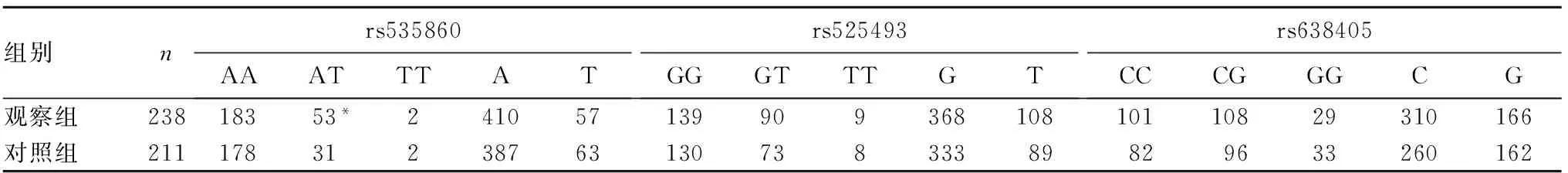
表1 两组BACE1基因rs535860、rs525493、rs638405 位点基因型和等位基因分布比较(例)
注:与对照组比较,*P<0.05。
2.3 BACE1 基因多态性与不同性别癫痫易感性的关系 观察组男性癫痫患者BACE1基因s535860基因型AT频率高于对照组男性人群(P=0.004),携带至少1个突变等位基因T(AT+TT)的男性个体癫痫发病风险是野生AA基因型的2.585倍(95%CI:1.310~5.140,P=0.006)。两组男性人群BACE1基因rs525493、rs638405及女性人群rs535860、rs525493、rs638405 的基因型和等位基因分布差异无统计学意义(P均>0.05)。见表2、3。
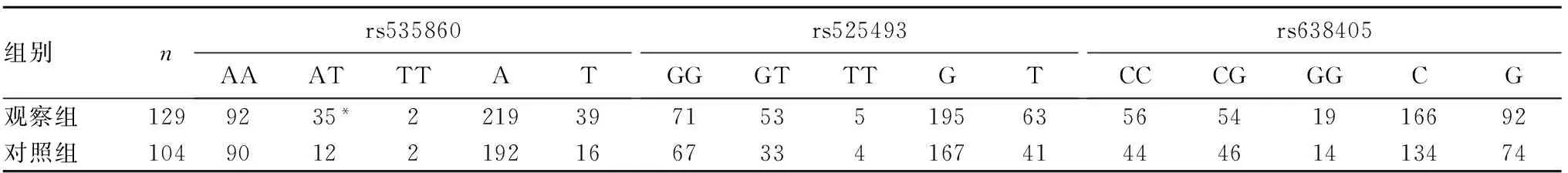
表2 两组男性人群BACE1基因rs535860、rs525493、rs638405 位点基因型和等位基因分布比较(例)
注:与对照组比较,*P<0.05。
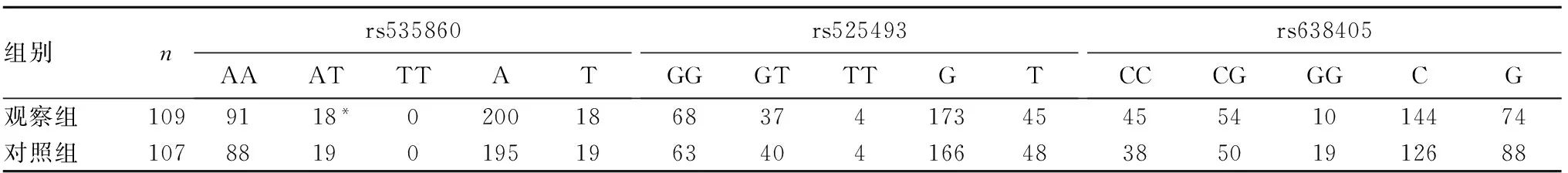
表3 两组女性人群BACE1基因rs535860、rs525493、rs638405 位点基因型和等位基因分布比较(例)
注:与对照组比较,*P<0.05。
3 讨论
阿尔茨海默病是一种起病隐匿的进行性发展的神经系统退行性疾病,临床上以记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆表现为特征。癫痫也是一种由临床表现确定的神经系统紊乱的疾病,与阿尔兹海默病有某些相同之处,包括神经元死亡、神经变化以及感染等。动物及人体研究表明,阿尔兹海默病与癫痫之间存在密切关系。有研究[5]表明,阿尔兹海默病患者有癫痫病史的概率较大。BACE1基因在阿尔兹海默病的发病过程中起非常重要的作用,如果其过度表达,神经轴突的纤维化将会加重,而这个过程对阿尔兹海默病起重要作用[6]。基于阿尔兹海默病和癫痫之间的密切联系以及BACE1在阿尔兹海默病发病过程中起着重要作用。本研究分析了BACE1 基因多态性与癫痫病之间的关系,结果表明rs535860(A>T)的多态性与癫痫易感性显著相关。
BACE1基因多态性与癫痫的关系可以从生理基础研究做出解释。BACE1是β淀粉样前体蛋白水解为β淀粉样蛋白的酶系中的重要成员,在β淀粉样前体蛋白生成中起重要作用。β淀粉样蛋白可以在分子、突触、神经元、生物电流等多个水平影响神经元活性。Jorge等[7]研究推测,高水平的β淀粉样蛋白会导致神经元活性降低,进而触发神经异常的补偿性活性增强,从而引起癫痫样症状。
BACE1基因动态性与癫痫关系的具体机制需要进一步分析,但现有研究表明其可能通过作用于相关其他底物和离子通道而影响癫痫的发作。Sez6 基因、神经调解蛋白1基因等[8,9]几个同家族基因都是BACE1的底物,均为在人体和小鼠体内都存在的基因。在BACE1被阻断后,Sez6 会出现明显的功能紊乱。有研究证实,Sez6 基因的表达与癫痫发作相关,所以BACE1基因多态性可能通过作用于与类似Sez6 基因的底物,从而影响癫痫的发病。癫痫的发病基础是神经不规则的放电,离子通道活性对神经元放电有重要作用。钠离子通道和钾离子通道是两种研究最广泛的离子通道,钠离子通道的α和 β亚基突变都与癫痫有关。有研究[10~12]证明,BACE1缺失小鼠的神经元较正常小鼠的钠离子通道数有所减少。钾离子通道中的KCNQ2 和KCNQ3亚家族是神经元M电流通道中主要成分,可以通过抑制或激活神经元调节M电流通道的平衡,而M电流通道的平衡与癫痫综合症状密切相关[13~15]。由于BACE1可以对离子通道产生影响闭合电流平衡等作用[16],所以其也可能通过作用于离子通道影响癫痫的发作。
本研究中男性患者BACE1基因rs535860(A>T)位点的基因型和等位基因分布与健康男性对照者差异有统计学意义,即男性患者多于女性患者,这与癫痫流行病学的研究结果一致[17]。Peters 等[18]在一项用KCNQ2显性失活转基因小鼠所作的研究中发现,实验中大部分雄性突变小鼠显示癫痫症状,但是在雌性突变小鼠个体中没有发现类似表现。本研究结果也表明,BACE1对离子通道的影响可能在不同性别中有差异,进而造成不同性别癫痫易感性的不同。
本研究分析了BACE1基因的3个位点多态性与癫痫发病的关系,发现rs535860(A>T)位点与癫痫发作有相关性,尤其与男性癫痫患者关系密切。本研究存在样本来源有限的缺陷,需要进一步扩大样本量验证,但仍能为癫痫发病机制的阐述提供依据。
[1] 邱文娟,胡小伟,张正春.癫痫发病机制及治疗的研究进展[J]. 中华临床医师杂志(电子版), 2014,8(10):1920-1924.
[2] Ngugi AK, Bottomley C, Kleinschmidt I, et al. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach [J]. Epilepsia, 2010,51(5):883-890.
[3] Zhang C.Natural compounds that modulate BACE1-processing of amyloid-beta precursor protein inAlzheimer′s disease[J]. DiscovMed, 2012,14(76):189-197.
[4] Yu ZL, Jiang JM, Wu DH, et al. Febrile seizures are associated with mutation of seizure-related (Sez) 6, a brain-specific gene[J]. J Neurosci Res, 2007,85(1):166-172.
[5] Filser S, Ovsepian SV, Masana M, et al. Pharmacological inhibition of BACE1 impairs synaptic plasticity and cognitive functions[J]. Biol Psychiatry, 2015,77(8):729-739.
[6] Kuhn PH, Koroniak K, Hogl S, et al. Secretome protein enrichment identifies physiological BACE1 protease substrates in neurons [J]. EMBO J, 2012,31(14):3157-3168.
[7] Jorge J, Palop, Lennart M. Epilepsy and cognitive impairments in alzheimer disease [J]. Arch neurol, 2009,66(4):435-442.
[8] Mei L, Nave KA Neuregulin-ERBB signaling in the nervous system and neuropsychiatric diseases [J]. Neuron, 2014,83 (1):27-49.
[9] Dislich B, Wohlrab F, Bachhuber T, et al. Label-free quantitative proteomics of mouse cerebrospinal fluid detects β-site APP cleaving enzyme (BACE1) protease substrates in vivo [J]. Mol Cell Proteomics, 2015,14 (4):2550-2563.
[10] Wong HK, Sakurai T, Oyama F, et al. Beta subunits of voltage-gated sodium channels are novel substrates of beta-site amyloid precursor protein-cleaving enzyme (BACE1) and gamma-secretase [J]. J Biol Chem, 2005,280(24):23009-23017.
[11] Gersbacher MT, Kim DY, Bhattacharyya R, et al. Identification of BACE1 cleavage sites in human voltage-gated sodium channel beta 2 subunit [J]. Mol Neurodegener, 2010,5:61.
[12] Kim DY, Gersbacher MT, Inquimbert P, et al. Reduced sodium channel Na(v)1.1 levels in BACE1-null mice [J]. J Biol Chem, 2011, 286(10):8106-8116.
[13] Wang JJ, Li Y. KCNQ potassium channels in sensory system and neural circuits [J]. Acta Pharmacol Sin, 2016,37(1):25-33.
[14] Currò D. The Modulation of potassium channels in the smooth muscle as a therapeutic strategy for disorders of the gastrointestinal tract [J]. Adv Protein Chem Struct Biol, 2016,104 (1): 263-305.
[15] Maljevic S, Wuttke TV, Seebohm G, et al. KV7 channelopathies [J]. Pflugers Arch, 2010,460(2):277-288.
[16] Symonds JD, Zuberi SM, Johnson MR, et al. Advances in epilepsy gene discovery and implications for epilepsy diagnosis and treatment [J]. Curr Opin Neurol, 2017, 30 (2):193-199.
[17] Kotsopoulos IA, van Merode T, Kessels FG, et al. Systematic review and meta-analysis of incidence studies of epilepsy and unprovoked seizures[J]. Epilepsia, 2002,43(11):1402-1409.
[18] Peters HC, Hu H, Pongs O, et al. Conditional transgenic suppression of M channels in mouse brain reveals functions in neuronal excitability, resonance and behavior [J]. Nat Neurosci, 2005,8(1):51-60.
Relationship between BACE1 gene polymorphisms and epilepsy susceptibility
WANGHaidong1,JIANGPei,HEXin,SONGXingfa
(1TheFirstPeople′sHospitalofLianyungang,Lianyungang222002,China)
Objective To analyze the relationship between the β-secretase 1 (BACE1) gene polymorphisms and epilepsy susceptibility. Methods BACE1 gene rs535860, rs525493 and rs638405 polymorphisms were detected by the PCR-ligase detection reaction (LDR) in 238 children with epilepsy (observation group, 129 males and 109 females) and 211 healthy controls (control group, 104 males and 107 females) of Han population in Hunan Province, and their correlations with epilepsy susceptibility was analyzed.Results The frequency of genotype AT for BACE1 rs535860 (A>T) was significantly higher in the observation group than in the control group (P=0.041). The incidence rate of patients that carried the T allele (AT+TT) was 1.005 times higher than that carried AA wild genotype (95%CI0.382-2.616,P=0.048). However, no statistically significant differences were found in the genotype and allele distributions of rs525493 (G>T) and rs638405 (C>G) between the two groups (allP>0.05). The genotype AT frequency of BACE1 gene s535860 in male patients with epilepsy of the observation group was higher than that in the control group (P=0.004). The risk of epilepsy in male individuals carrying at least one mutant allele T (AT+TT) was 2.585 times higher than that of males with wild AA genotype (95%CI: 1.310-5.140,P=0.006).There was no significant difference in genotype and allele distribution of BACE1 gene rs525493, rs638405 of males as well as BACE1 gene rs535860, rs525493 and rs638405 of females between these two groups (allP>0.05).Conclusion The mutant heterozygote AT genotype of BACE1 gene rs535860 is associated with the onset of epilepsy and is more significant in males.
epilepsy; gene polymorphism; β-secretase 1; gender difference; Han nationality; Hunan area
国家自然科学基金资助项目(81602846)。
王海东(1986-),男,硕士研究生,主管药师,主要研究方向为医院药学和神经药理学。E-mail: wanghaidong7924046@163.com
宋兴发(1968-),男,副主任药师,主要研究方向为医院药学和神经药理学。E-mail: sxf_198@163.com
10.3969/j.issn.1002-266X.2017.30.007
R742
A
1002-266X(2017)30-0026-04
2016-11-28)

