动态压力负荷对大鼠生长板软骨干细胞外基质及PTHrP mRNA的影响
吴晓东,张玉玲,白广超,李宽新
(新疆生产建设兵团医院,乌鲁木齐830000)
动态压力负荷对大鼠生长板软骨干细胞外基质及PTHrP mRNA的影响
吴晓东,张玉玲,白广超,李宽新
(新疆生产建设兵团医院,乌鲁木齐830000)
目的 探讨动态压力刺激对大鼠生长板软骨干细胞外基质及甲状旁腺激素相关蛋白(PTHrP)mRNA表达水平的影响。方法 采用免疫磁珠法分离培养大鼠生长板软骨干细胞,将细胞分为0、30、60、90 mmHg组,采用动态压力细胞培养装置向各组分别施加0、0~30、0~60、0~90 mmHg的动态压力刺激。作用1、6、24 h后,采用半定量RT-PCR方法检测软骨干细胞外基质[包括Ⅱ型胶原、葡聚多糖(aggrecan)、Ⅹ型胶原]及PTHrP mRNA表达。结果 30、60、90 mmHg组Ⅱ型胶原均有明显表达且在6 h时达到最高,30、60、90 mmHg组各时间点的表达量均大于0 mmHg组(P均<0.05);30、60、90 mmHg组aggrecan mRNA均有明显表达且在6 h时达到最高,在每个时间点30、60、90 mmHg组的表达量均大于0 mmHg组(P<0.05);0、30、60、90 mmHg组Ⅹ型胶原mRNA均有较低表达,且各组之间比较差异无统计学意义(P均>0.05);30、60、90 mmHg组PTHrP mRNA均有较高表达,在每个时间点30、60、90 mmHg组的表达量均大于0 mmHg组(P均<0.05),PTHrP mRNA表达量随着受力时间的延长而增加。结论 动态压力负荷可上调大鼠生长板软骨干细胞PTHrP mRNA表达,促进其细胞外基质的形成及增殖。
动态压力;生长板;软骨干细胞;细胞外基质;甲状旁腺激素相关蛋白
生长板是位于骨骺和干骺端之间的透明软骨区,具有纵向和横向生长的功能,其厚度及骨的长度由干骺端软骨中各层细胞的增殖与分化情况决定。葡聚多糖(aggrecan)和Ⅱ型胶原是构成细胞外基质的主要成分,而细胞外基质包绕生长板软骨中的软骨干细胞形成柱状结构,其肥大层软骨细胞特异性表达Ⅹ型胶原[1]。骨骼的生长发育主要靠生长板内软骨成骨,人体在运动时会对生长板产生生物力学刺激。在生长发育期,这些刺激可以影响生长板软骨干细胞的功能活动,对骨的发育与成熟十分重要[2]。生物力学刺激作用到生长板时,可以引起一系列信号转导,导致细胞内某些物质表达增加或减少[3,4]。甲状旁腺激素相关蛋白(PTHrP)的主要生理作用为调节钙磷代谢,其对软骨干细胞的分化亦发挥重要的作用。2015年8月~2016年6月,我们通过体外分离、培养大鼠生长板软骨干细胞,使用动态压力细胞培养装置对其施加压力刺激,观察Ⅱ型胶原、aggrecan、Ⅹ型胶原及PTHrP mRNA表达变化,为探讨动态压力对软骨干细胞增殖及分化的影响提供理论依据。
1 材料与方法
1.1 材料 2周龄SD大鼠,雌雄不限,由石河子大学医学院实验动物中心提供。DMEM/F-12培养基(Hyclone公司),胎牛血清(Gibco公司),双抗(Hyclone公司),Ⅱ型胶原酶(Invitrogen公司),胰蛋白酶(Hyclone公司),免疫磁珠二抗(4ABio公司),TRIzol试剂盒(Promega公司),逆转录试剂盒及PCR试剂盒(Takara公司),DEPC、溴化乙锭、琼脂糖(Sigma公司),PCR Marker Ⅰ(上海浩然生物技术有限公司)。细胞培养箱(阿尔泰实验室设备有限公司),动态压力细胞培养装置(自行设计制备),光学显微镜(卡尔蔡司公司),PCR仪(Eppendoff 公司),凝胶成像分析系统(Bio RAD公司)。
1.2 大鼠生长板软骨干细胞的分离培养 将大鼠用颈椎脱臼法处死,超净台内分离四肢,剪下股骨远端及胫骨近端软骨,PBS漂洗。加入0.25%的胰蛋白酶消化后,再加入0.2%Ⅱ型胶原酶消化过夜;以200目筛网过滤,将得到的细胞进行离心漂洗;随后加入完全培养液重悬,调整细胞密度为1×105/mL。将细胞接种于25 cm2的培养瓶内,置5%CO2、37 ℃培养箱中培养。48 h后加入胰蛋白酶消化,制成单细胞悬液。依次加入CD200兔多克隆抗体、免疫磁珠二抗(羊抗兔),PBS漂洗,细胞悬浮于Buffer溶液中。向磁场中的分离柱内缓慢滴加细胞悬液,撤去磁场后用Buffer溶液快速冲洗分离柱,洗脱下来的阳性细胞即为生长板软骨干细胞。将细胞接种于培养瓶内,置5%CO2、37 ℃培养箱中培养,每3日换液1次;当细胞融合至培养瓶底80%左右时用胰蛋白酶消化,按1∶2进行传代培养。
1.3 细胞分组与处理 取培养第3代的生长板软骨干细胞,待细胞融合至培养瓶底60%左右时进行实验。根据所施加的压力将细胞分为0、30、60、90 mmHg组,将培养瓶放入动态压力细胞培养箱,连接压力控制系统。通过改变进口气体流量调节培养瓶内压力,分别给予0、0~30、0~60、0~90 mmHg的动态压力,加压频率设置为0.1 Hz,使用压力表观察瓶内压力变化,分别施压1、6、24 h。
1.4 细胞形态学观察 在大鼠生长板软骨干细胞培养换液前及换液后,于光学显微镜下观察细胞形态、大小、融合度。对第3代生长板软骨干细胞施加0、0~30、0~60、0~90 mmHg动态压力刺激后,于光学显微镜下观察细胞形态学变化。
1.5 细胞Ⅱ型胶原、aggrecan、Ⅹ型胶原、PTHrP mRNA检测 采用半定量RT-PCR方法。TRIzol法提取细胞总RNA,逆转录合成cDNA。以GAPDH为内参,Ⅱ型胶原上游引物为5′-CACCCAGAGTGGAAGAGCG-3′,下游引物为5′-TCAGTGGACAGTAGACGGAGGA-3′;aggrecan上游引物为5′-CTTCCGCTGGTCTGATGG-3′,下游引物为5′-TAGCCTGTGCTTGTAGGTGTTG-3′;Ⅹ型胶原上游引物为5′-CAGTGCTAACCAGGGGGTAA-3′,下游引物为5′-CTCCCTGAAGCTGAACCAAG-3′;PTHrP上游引物为5′-GACTTGCCCTTGTCATGCAGT-3′,下游引物为5′-GGAGCGTCCTGGTGTTCCT-3′。反应体系:cDNA 1 μL,上、下游引物各1 μL,2×PCR TaqMix 12.5 μL,双蒸水9.5 μL,共计25 μL。反应条件:95 ℃预变性3 min,94 ℃变性30 s,退火30 s,72 ℃延伸30 s。取PCR产物以2%琼脂糖凝胶进行电泳,利用凝胶成像分析系统测定各电泳条带吸光灰度值,计算各组Ⅱ型胶原、aggrecan、Ⅹ型胶原、PTHrP与GAPDH灰度值的比值。
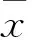
2 结果
2.1 各组生长板软骨干细胞形态学变化 显微镜下可见,体外培养的生长板软骨干细胞呈三角形或多角形,具有丰富的胞质,增殖速度较快,呈单层生长。原代细胞长满培养瓶底约需8 d,传代培养后生长状态良好。对第3代大鼠生长板软骨干细胞分别施加大小为0、0~30、0~60、0~90 mmHg,持续时间为1、6、24 h的动态压力刺激后,光学显微镜下观察各组细胞形态学,发现与未施加压力刺激时无明显变化。
2.2 各组不同时间Ⅱ型胶原、aggrecan、Ⅹ型胶原、PTHrP mRNA表达比较 动态压力刺激6 h后30、60、90 mmHg组Ⅱ型胶原、aggrecan mRNA表达达高峰,其中90 mmHg组高于30、60 mmHg组。各组不同时间点Ⅹ型胶原mRNA表达比较差异无统计学意义。0、30、60、90 mmHg组PTHrP mRNA表达随刺激时间延长而增加,刺激24 h时30、60、90 mmHg组高于0 mmHg组(P均<0.05);在1、6 h时,90 mmHg组高于0、30、60 mmHg组。见表1~4。
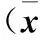
表1 各组不同时间Ⅱ型胶原mRNA相对表达量比较±s)
注:与同时点0 mmHg组比较,*P<0.05;与同组1 h时比较,#P<0.05。
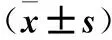
表2 各组不同时间aggrecan mRNA相对表达量比较
注:与同时点0 mmHg组比较,*P<0.05;与同组1 h时比较,#P<0.05。
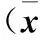
表3 各组不同时间Ⅹ型胶原mRNA相对表达量比较±s)
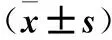
表4 各组不同时间PTHrP mRNA相对表达量比较
注:与同时点0 mmHg组比较,*P<0.05;与同组1 h时比较,#P<0.05。
3 讨论
骨骼的生长发育主要靠生长板内软骨成骨,人体在运动时会对生长板产生生物力学刺激,在生长发育期,这些刺激可影响生长板软骨干细胞的功能活动,引起一系列信号转导,最终导致细胞内某些物质表达量的增加或减少[5]。Ⅱ型胶原和aggrecan作为生长板软骨干细胞外基质的主要成分,是维持生长板软骨干细胞正常生理功能的关键物质,而Ⅹ型胶原是肥大层软骨干细胞特异性表达合成的胶原[6]。细胞表型分化及功能状态可通过细胞外基质的基因表达情况来反映,研究表明,压力刺激可影响aggrecan、Ⅱ型和Ⅹ型胶原表达[7]。Bries等[8]对生长板施以静态压力,发现实验组Ⅱ型和Ⅹ型胶原表达较对照组降低;Kaviani等[9]对生长板施加应力干预,发现实验组生长板软骨干细胞的增殖活性及细胞基质的合成较对照组升高;Sergerie等[10]对生长板分别给予静态压力和动态压力刺激,发现静态压力组Ⅱ型胶原、aggrecan表达减少,动态压力组Ⅱ型胶原、aggrecan表达增加。本研究中,对培养至第3代的大鼠生长板软骨干细胞分别施加大小为0、30、60、90 mmHg的压力刺激,发现持续1、6、24 h时0、0~30、0~60、0~90 mmHg组细胞在形态上并无明显差异,表明动态压力刺激对大鼠生长板软骨干细胞的形态变化影响较小。
Ⅱ型胶原和aggrecan作为生长板软骨干细胞外基质的主要成分,是生长板软骨干细胞得以正常生存、分化和发育的关键物质[11],适当的压力刺激有利于生长板机械及功能结构的形成。生长板软骨干细胞在分化过程中Ⅹ型胶原的表达会发生变化[12],故Ⅹ型胶原可作为监测软骨内骨化过程的可靠指标。本研究发现,动态压力刺激6 h后30、60、90 mmHg组Ⅱ型胶原、aggrecan mRNA表达均达高峰,且90 mmHg组高于30、60 mmHg组,提示动态压力刺激可明显增加外基质中aggrecan及Ⅱ型胶原mRNA的表达;但本研究中30、60、90 mmHg组Ⅹ型胶原mRNA表达量与0 mmHg组比较差异并无统计学意义,提示其在生长板软骨干细胞的分化过程中起到的作用可能不明显。
PTHrP的主要作用为调节钙磷代谢,在细胞生长分化过程中具有重要作用[13]。PTHrP在骨骼中主要是由生长板周围软骨膜中的生长板干细胞合成,以自分泌和旁分泌的形式调控自身及周围软骨细胞的钙磷代谢,在时间和空间上协调生长板软骨干细胞的分化[14]。研究发现,当动态压力刺激作用到生长板上时,某种信号转导机制会被激活,引起PTHrP表达量增加,进而促进细胞外基质形成及细胞增殖[15]。本研究发现,刺激24 h时30、60、90 mmHg组PTHrP mRNA表达高于0 mmHg组,在1、6 h时90 mmHg组PTHrP mRNA表达高于0、30、60 mmHg组,提示动态压力刺激可明显增加外基质中PTHrP mRNA的表达。
综上所述,对生长板软骨干细胞施加动态压力刺激后,PTHrP、Ⅱ型胶原和aggrecan mRNA表达均上调。表明适当的动态压力可以通过某种信号转导途径来上调PTHrP mRNA表达,进而促进生长板软骨干细胞外基质的形成及增殖,其具体调节通路仍需进一步研究。
[1] Koichi M, Yukiko K, Nobuhito N, et al. Osteogenic capillaries orchestrate growth plate-independent ossification of the malleus[J]. Development, 2015,142(22):3912-3920.
[2] Kato K, Bhattaram P, Penzo-Méndez A, et al. SOXC transcription factors induce cartilage growth plate formation in mouse embryos by promoting noncanonical WNT signaling[J]. J Bone Miner Res, 2015,30(9):1560-1571.
[3] Liu A, Li Y, Wang Y, et al. Exogenous parathyroid hormone-related peptide promotes fracture healing in lepr(-/-) mice[J]. Calcified Tissue Int, 2015,97(6):581-591.
[4] Park H, Lee DH, Hwang JH, et al. Nonsteroidal anti-inflammatory drugs cause inhibition of the growth plate in cultured rat metatarsal bones: retraction[J]. J Pediatr Orthop, 2016,36(2):218.
[5] Wei X, Hu M, Mishina Y, et al. Developmental regulation of the growth plate and cranial synchondrosis[J]. J Dent Res, 2016,95(11):1221-1229.
[6] Hill CE. An aide-memoire for the Salter-Harris classification of paediatric growth plate fractures[J]. Ann R Coll Surg Engl, 2011,97(6):479.
[7] 李殿威,周强,郭平,等.压应力对组织工程软骨细胞增殖的影响[J].南方医科大学学报,2010,30(11):2530-2532.
[8] Bries AD, Weiner DS, Jacquet R, et al. A study in vivo of the effects of a static compressive load on the proximal tibial physis in rabbits[J]. J Bone Joint Surg Am, 2012,94(94):1111-1110.
[9] Kaviani R, Londono I, Parent S, et al. Compressive mechanical modulation alters the viability of growth plate chondrocytes in vitro[J]. J Orthop Res, 2015,33(11):1587-1593.
[10] Sergerie K, Parent S, Beauchemin PF, et al. Growth plate explants respond differently to in vitro static and dynamic loadings[J]. J Orthop Res, 2011,29(4):473-480.
[11] Lauing KL, Cortes M, Domowicz MS, et al. Aggrecan is required for growth plate cytoarchitecture and differentiation[J]. Dev Biol, 2014,396(2):224-236.
[12] Li WC, Kao HK, Yang WE, et al. Femoral non-elongating rodding in osteogenesis imperfecta - The importance of purchasing epiphyseal plate[J]. Biomed J, 2015,38(2):143-147.
[13] 罗平平,王文军.Ihh-PTHrP信号轴对软骨内成骨作用机制的研究进展[J].中南医学科学杂志,2014.42(2):201-204.
[14] Hirai T, Kobayashi T, Nishimori S, et al. Bone is a major target of PTH/PTHrP receptor signaling in regulation of fetal blood calcium homeostasis[J]. Endocrinology, 2015,156(8):2774-2780.
[15] Guo J, Song L, Liu M, et al. Activation of a non-cAMP/PKA signaling pathway downstream of the PTH/PTHrP receptor is essential for a sustained hypophosphatemic response to PTH infusion in male mice[J]. Endocrinology, 2013,154(5):1680-1689.
新疆生产建设兵团卫生科技计划项目(wsj201406)。
李宽新(E-mail: likuanxin@sohu.com)
10.3969/j.issn.1002-266X.2017.30.011
Q954.65
A
1002-266X(2017)30-0040-03
2016-12-09)

