急性胰腺炎患者血清微管相关蛋白1轻链3水平变化及意义
吴海龙,孙建兵,王建祥
(武汉市普爱医院,武汉430030)
急性胰腺炎患者血清微管相关蛋白1轻链3水平变化及意义
吴海龙,孙建兵,王建祥
(武汉市普爱医院,武汉430030)
目的 观察急性胰腺炎(AP)患者血清微管相关蛋白1轻链3(MAP1-LC3)水平变化,探讨其临床意义。方法 选择轻型AP患者(MAP组)31例和重症AP患者(SAP组)31例,于发病24 h内抽取血清样本,另选择31例健康者作为对照组。检测血清淀粉酶(Ams)、MAP1-LC3水平,对AP患者的腹部CT进行评分。结果 与对照组比较,MAP组、SAP组血清Ams、MAP1-LC3水平及腹部CT评分均升高(P均<0.05),其中SAP组较MAP组上述指标升高(P均<0.05);血清MAP1-LC3水平与腹部CT评分呈正相关(r=0.977,P<0.01),与Ams呈正相关。结论 AP患者发病早期血清MAP1-LC3水平明显升高,并与AP的病情严重程度呈正相关关系;血清MAP1-LC3可能是早期预测AP严重程度的有效标记物。
急性胰腺炎;自噬;微管相关蛋白1轻链3
急性胰腺炎(AP)起病急、变化快、并发症多,病死率高达20%[1~4]。目前临床上对AP的处理主要是对症支持治疗,仍缺乏特异、有效的治疗措施。目前对AP发病的中心环节胰酶异常的激活机制尚不明确。研究认为,AP的病理基础为胰酶原在胰腺细胞内异常的激活,从而引起胰腺的自我消化,进一步引起局部及全身炎症反应[5~7]。自噬与AP的发生、发展密切相关,微管相关蛋白1轻链3(MAP1-LC3)是自噬体形成及胞质到空泡靶向囊泡必需的蛋白。本研究通过检测AP患者的血清MAP1-LC3水平,分析血清MAP1-LC3水平与AP严重程度的关系,探讨AP发病的机制。
1 资料与方法
1.1 临床资料 选择2016年1~12月我院收治的AP患者62例,男39例、女23例,年龄(68.2 ± 3.7)岁,均符合中华医学会外科分会胰腺外科学组AP诊治指南中的标准。分为轻型AP(MAP组)、重症AP(SAP组)各31例。患者均在发病24 h内入院,既往无严重的心、脑、肺、肾、肝等基础疾病,术前均未接受生物、免疫治疗并有完整的临床资料。另选择性别、年龄相匹配的健康志愿者31例作为对照组。
1.2 血清淀粉酶(Ams)、MAP1-LC3水平检测 采集AP患者发病24 h内及对照组空腹静脉血标本,离心取上清液,分装入EP管中,-80 ℃保存。使用全自动生化分析仪测定血清Ams水平;双抗夹心酶联免疫吸附(ELISA)法检测血清MAP1-LC3水平,试剂盒购自武汉优尔生(USCN)科技股份有限公司。
1.3 腹部CT检查方法 AP患者于入院24 h内行腹部增强CT检查,采用改良的CT严重指数评分(MCTSI)标准评分。胰腺炎症反应评分中,正常胰腺为0分,胰腺和(或)胰周炎性改变为2分,单发或多个积液区或胰周脂肪坏死为4分。胰腺坏死评分中,无胰腺坏死为0分,坏死范围≤30%为2分,坏死范围>30%为4分。以胰腺炎症反应评分+胰腺坏死评分计算CT评分。
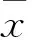
2 结果
2.1 三组血清Ams、MAP1-LC3水平比较 MAP组和SAP组血清Ams、MAP1-LC3水平均高于对照组,SAP组高于MAP组(P均<0.01)。
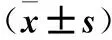
表1 三组血清Ams、MAP1-LC3水平比较
注:与对照组比较,*P<0.01;与MAP组比较,#P<0.01。
2.2 三组腹部CT评分比较 对照组、MAP组及SAP组腹部CT评分分别为(0.090±0.021)、(2.409±0.347)、(6.862±0.878)分,MAP组和SAP组腹部CT评分均高于对照组,SAP组高于MAP组(P均<0.01)。
2.3 血清MAP1-LC3与血清Ams、腹部CT评分的相关性 相关性分析显示,血清MAP1-LC3与腹部CT评分呈正相关(r=0.977,P<0.01),与血清Ams呈正相关(r=0.765,P<0.05)。
3 讨论
AP起病急、变化快、并发症多、病死率高,一直是临床治疗的难点,及时、准确、高效地对AP患者进行合理诊治尤为重要。多数研究认为,AP的病理基础是胰酶原在胰腺细胞内非正常的激活,引起胰腺自我消化,进一步引起局部及全身炎症反应。但胰腺细胞内的酶原具体是如何激活的,目前尚不完全清楚。AP时自噬的改变是近年的研究热点。AP早期阶段的特征性改变是胰腺细胞胞质内出现许多空泡[8],空泡中含有活化的胰酶。随着自噬相关研究的进展,证实AP早期出现的空泡结构就是自噬空泡[9,10]。自噬与AP的发生、发展密切相关,过度自噬不仅导致AP早期的胰酶异常激活,还可介导炎症的病理生理过程。过度自噬导致线粒破坏,引起线粒体活性氧簇产生增多,导致炎症小体激活。
自噬相关信号转导通路错综复杂。MAP1-LC3是自噬形成调控的主要因子之一,对自噬的发生和发展有着重要的调节作用。MAP1-LC3在自噬体的形成及膜来源中发挥作用[11,12]。有研究[13,14]通过对分离胰腺细胞、动物模型和人体组织的研究,发现AP时自噬量受损,胰腺腺泡内大量异常自噬空泡堆积;自噬的异常增多是导致酶原的激活的诱因,认为自噬导致胰腺腺泡细胞空泡的形成以及酶原的激活,最终诱发了AP的形成。MAP1-LC3是自噬调控的重要分子机制之一,MAP1-LC3的表达与自噬相互促进,血清MAP1-LC3水平增高可以间接反映AP患者自噬的过度激活。AP的发病与过度自噬密切相关,而MAP1-LC3是自噬的重要调控蛋白。本研究发现,SAP组血清Ams水平高于MAP组,MAP组、SAP组发病早期血清MAP1-LC3水平明显升高,且SAP组较MAP组血清MAP1-LC3水平增高;AP患者的血清MAP1-LC3水平和血清Ams腹部CT评分呈正相关,提示AP患者发病早期血清MAP1-LC3水平与AP的病情严重程度呈正相关,血清MAP1-LC3可能是早期预测AP严重程度的有效标记物。因此可以通过减少MAP1-LC3表达而抑制胰腺腺泡细胞自噬的发生,从而减少胰蛋白酶原的激活以及AP时胰腺组织水肿、出血及坏死的发生[15],MAP1-LC3可能作为药物治疗AP的特异性靶点之一。
综上所述,AP患者发病早期血清MAP1-LC3水平明显升高,并与AP的病情严重程度呈正相关,MAP1-LC3可能是早期预测AP严重程度的有效血清标记物。
[1] Tomas RG, Alberto GC, Javier GV. Etiology of acute pancreatitis[J]. Cent Eur J Med, 2014,9(4):530-542.
[2] Singh VK, Moran RA, Afghani E, et al. Treating acute pancreatitis: what′s new[J]. Expert Rev Gastroenterol Hepatol, 2015,9(7):901-911.
[3] Wu BU, Bakker OJ, Papachristou GI, et al. Blood urea nitrogen in the early assessment of acute pancreatitis: an international validation study[J]. Arch Intern Med, 2011,171(7):669-676.
[4] Mallédant Y, Malbrain ML, Reuter DA. What′s new in the management of severe acute pancreatitis[J]. Int Care Med, 2015,41(11):1957-1960.
[5] 中华医学会外科学分会胰腺外科学组.急性胰腺炎诊治指南(2014版)[J].全科医学临床与教育,2015,14(3):1-5.
[6] Mareninova OA, Hermann K, French SW, et al. Impaired autophagic flux mediates acinar cell vacuole formation and trypsinogen activation in rodent models of acute pancreatitis[J]. J Clin Invest, 2009,119(11):3340-3355.
[7] Gukovskaya AS, Gukovsky I. Autophagy and pancreatitis[J]. Am J Physiol Gastrointest Liver Physiol, 2012,303(9):993-1003.
[8] Van Acker GJ, Weiss E, Steer ML, et al. Cause-effect relationships between zymogen activation and other early events in secretagogue-induced acute pancreatitis[J]. Am J Physiol Gastrointest Liver Physiol, 2007,292(6):1738-1746.
[9] Lerch MM, Gorelick FS. Early trypsinogen activation in acute pancreatitis[J]. Med Clin North Am, 2000,84(3):549-563.
[10] Watanabe O, Baccino FM, Steer ML, et al. Supramaximal caerulein stimulation and ultrastructure of rat pancreatic acinar cell: early morphological changes during development of experimental pancreatitis[J]. Am J Physiol, 1984,246(4):457-467.
[11] Jacob TG, Sreekumar VI, Roy TS, et al. Electron-microscopic evidence of mitochondriae containing macroautophagy in experimental acutepancreatitis: implications for cell death[J]. Pancreatology, 2014,14(6):454-458.
[12] Xu B, Bai B, Sha S, et al. Interleukin-1β induces autophagy by affecting calcium homeostasis and trypsinogen activation in pancreatic acinar cells[J]. Int J Clin Exp Pathol, 2014,7(7):3620-3031.
[13] Zhu H, Huang L, Zhu S, et al. Regulation of autophagy by systemic admission of microRNA-141 to target HMGB1 in l-arginine-induced acute pancreatitis in vivo[J]. Pancreatology, 2016,16(3):337-346.
[14] Ohmuraya M, Yamamura K. Autophagy and acute pancreatitis: a novel autophagy theory for trypsinogen activation[J]. Autophagy, 2008,4(8):1060-1062.
[15] Hashimoto D, Ohmuraya M, Hirota M, et al. Involvement of autophagy in trypsinogen activation within the pancreatic acinar cells[J]. J Cell Biol, 2008,181(7):1065-1072.
10.3969/j.issn.1002-266X.2017.30.028
R657.5
B
1002-266X(2017)30-0088-02
2017-03-15)

