广州市汉族2型糖尿病患者解耦联蛋白1基因3 826 A/G多态性分析
肖新怀,陈澍,苏丽芳,梁小敏
(广州医科大学附属第二医院,广州510260)
广州市汉族2型糖尿病患者解耦联蛋白1基因3 826 A/G多态性分析
肖新怀,陈澍,苏丽芳,梁小敏
(广州医科大学附属第二医院,广州510260)
目的 探讨解耦联蛋白(UCP)1基因3 826 bp处(简称为UCP1-3 826)A/G多态性与广州市汉族人群2型糖尿病(T2DM)发病的关系。方法 选择新诊断的广州市汉族T2DM患者116例为T2DM组,同期健康体检的非糖尿病者78例为对照组。抽取两组空腹肘静脉血,用全血基因组DNA提取试剂盒提取外周血DNA,采用PCR法分析UCP1-3 826 A/G基因多态性。检测空腹血糖(FBG)、糖化血红蛋白(HbA1c)、空腹胰岛素(FINS)、血脂(TG、TC、HDL-C及LDL-C),计算胰岛素抵抗指数(HOMA-IR)。测量两组身高、体质量、腰围、臀围,计算BMI及腰臀比(WHR)。结果 两组的UCP1-3 826基因型频率和等位基因频率均符合Hardy-Weinberg遗传平衡。T2DM组GG基因型、G等位基因频率均高于对照组(P均<0.05)。两组AA、AG基因型和A等位基因频率差异均无统计学意义(P均>0.05)。T2DM患者中,UCP1-3 826基因型为GG基因型患者的TG、LDL-C、FBG、FINS、HOMA-IR均高于AA、AG基因型患者(P均<0.05),AG基因型患者的LDL-C、FBG、FINS、HOMA-IR均高于AA基因型患者(P均<0.05)。结论 广州市汉族T2DM患者存在UCP1-3 826 A/G基因多态性变异,GG基因型及G等位基因频率比例均明显增高,可能与广州市汉族人群T2DM的发病密切相关。
解耦联蛋白1;基因多态性;基因型;2型糖尿病;糖脂代谢;广州市;汉族
解耦联蛋白(UCP)属于线粒体内膜阴离子转运蛋白家族,可通过“质子漏”机制,将质子转运至线粒体基质,从而降低膜内外电化学梯度,使氧化呼吸链解耦联,影响ATP和活性氧的生成,将能量以热能形式释放,从而降低代谢效能[1,2]。目前已发现的UCP有5种,分别为UCP1~UCP5。近年研究发现,UCP1与2型糖尿病(T2DM)有关。多项研究表明,在白种人、高加索人及马来西亚人等人种中,UCP1基因3 826 bp处(简称为UCP1-3 826)存在A→G的变异,且该基因多态性与T2DM的发病密切相关[3~6]。由于T2DM易感基因变异存在种族和地域差异,目前对UCP1-3 826 A/G基因多态性在中国汉族T2DM患者中的变异情况尚不明确。因此,我们检测了广州市116例汉族T2DM患者UCP1-3 826 A/G基因的变异情况,探讨UCP1-3 826 A/G基因多态性与广州市汉族T2DM患者发病的关系。
1 资料与方法
1.1 临床资料 收集2015年3月~2016年8月于我院新诊断的广州市T2DM患者116例为T2DM组,男67例、女49例,年龄(53.86±10.92)岁,均为汉族,患者间无血缘关系。T2DM诊断参照《中国2型糖尿病防治指南(2013年版)》[7]:空腹血糖(FBG)≥ 7.0 mmol/L 和(或)口服糖耐量试验(OGTT)餐后2 h血糖 ≥ 11.1 mmol/L。排除标准:1型糖尿病;继发性糖尿病;遗传缺陷导致的糖尿病;家族性高脂血症;严重肝肾损害;心肺功能不全。选择同期于我院进行健康体检的非糖尿病(NDM)者78例为对照组,男45 例、女33例,年龄(51.98±11.34)岁,均为汉族,患者间无血缘关系,排除糖尿病及其他内分泌代谢疾病,且一级亲属中无T2DM或其他内分泌代谢疾病。两组性别、年龄差异无统计学意义。所有受试者均需签署知情同意书。
1.2 UCP1-3 826 A/G基因多态性分析 抽取两组空腹肘静脉血,用全血基因组DNA提取试剂盒(购于北京索莱宝科技有限公司)提取外周血DNA,以100 ng DNA 为模板,总反应体积为50 μL,在DNA热循环仪中进行 PCR反应。引物由上海生工生物工程技术有限公司合成。经2%琼脂糖凝胶电泳,限制性内切酶MluⅠ酶切扩增产物。GG纯合子基因型电泳带为363 bp,AA纯合子基因型电泳带为291、72 bp,GA杂合子基因型电泳带为363、291、72 bp。
1.3 糖脂代谢因素相关指标检测
1.3.1 体脂含量及分布 测量两组身高、体质量、腰围、臀围,计算BMI及腰臀比(WHR)。以WHR反映体脂分布情况。
1.3.2 血脂、血糖测定 清晨抽取两组空腹肘静脉血,采用葡萄糖氧化酶法检测FBG,ELISA法检测TG、TC及糖化血红蛋白(HbA1c),采用硫酸葡聚糖-锰沉淀法检测HDL-C及LDL-C,采用放射免疫法测定空腹胰岛素(FINS)。稳态模式评估法计算胰岛素抵抗指数(HOMA-IR):HOMA-IR=FINS×FPG/22.5。
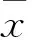
2 结果
2.1 两组UCP1-3 826 A/G多态性基因型分布情况 两组的基因型频率和等位基因频率均符合Hardy-Weinberg遗传平衡。对照组基因型为AA、AG、GG者分别为38、26、14例,等位基因频率为A、G者分别为102、54例。T2DM组基因型为AA、AG、GG者分别为45、39、32例,等位基因频率为A、G者分别为129、103例。T2DM组GG基因型、G等位基因频率均高于对照组(P均<0.05)。两组AA基因型、AG基因型和A等位基因频率差异均无统计学意义(P均>0.05)。
2.2 不同UCP1-3 826 A/G基因型的T2DM患者糖脂代谢指标比较 T2DM患者中,GG基因型患者TG、LDL-C、FBG、FINS、HOMA-IR均高于AA、AG基因型(P均<0.05),AG基因型患者LDL-C、FBG、FINS、HOMA-IR均高于AA基因型(P均<0.05)。见表1。
表1 不同UCP1-3 826 A/G基因型的T2DM患者糖脂代谢指标比较
注:与AA基因型比较,*P<0.05;与AG基因型比较,﹟P<0.05。
3 讨论
UCP1是惟一可以在脂肪组织中表达的UCP,主要存在于棕色脂肪组织线粒体膜上,参与脂肪组织的产热调节和能量代谢,以维持机体的能量代谢平衡[8~10]。UCP1在胰腺中有部分表达。UCP1氧化磷酸化解偶联可以导致ATP合成减少,使胰岛β细胞内ATP与ADP比值下降,ATP敏感型K+通道开放减少,细胞内Ca2+浓度下降,从而抑制胰岛素的胞吐作用,使得胰岛素的分泌减少,从而导致胰岛细胞功能障碍[11]。因此,UCP1可能与胰岛细胞功能障碍及T2DM的发生发展密切相关。
UCP 基因多态性可以导致UCP 表达水平的变化,从而进一步影响氧化应激、脂肪代谢及胰岛细胞功能等。研究发现,UCP1基因启动子区3 826 bp处存在A→G的变异。多项研究表明,UCP1-3 826 A/G多态性与BMI、脂代谢、肥胖、FBG、HbA1c、FINS、IR及T2DM的发病密切相关[3~6]。Brondani等[12]研究发现,UCP1-3 826 bp处为GG基因型的糖尿病肾病患者,其角膜组织中UCP1的表达量是AA基因型的2倍,表明UCP1-3 826 A/G基因中GG基因型是糖尿病肾病的易感基因。然而,不同种族和地域之间,由于生活方式、饮食习惯差异,易感基因变异也存在差异,细微的基因差异可能导致不同种族之间糖尿病发病易感程度的差别[13,14]。本研究以广州市汉族人群为研究对象,发现T2DM组UCP1-3 826 A/G基因中GG基因型和G等位基因频率均高于对照组,表明T2DM患者GG基因型及G等位基因频率比例均增高,UCP1-3 826 A/G多态性变异程度高于NDM者,广州市汉族人群T2DM的发病可能与UCP1-3 826 A/G基因多态性密切相关。
多项研究表明,UCP1-3 826 A/G多态性可能与肥胖的发生发展密切相关。肥胖的发生发展可以加重胰岛素抵抗,进而导致T2DM的发生发展。本研究发现,T2DM患者中GG基因型患者TG、LDL-C、FBG、FINS、HOMA-IR均高于AA、AG基因型,AG基因型患者LDL-C、FBG、FINS、HOMA-IR均高于AA基因型,表明UCP1-3 826 A/G多态性与广州市T2DM患者脂代谢及T2DM发病密切相关,可能通过导致肥胖、胰岛细胞功能障碍参与T2DM的发生发展。
综上所述,广州市汉族T2DM患者存在UCP1-3 826 A/G基因多态性变异,UCP1-3 826 A/G基因中GG基因型及G等位基因频率比例均明显增高,可能与广州市汉族人群T2DM的发病密切相关。
[1] Wu X, Gale PA. Small-molecule uncoupling protein mimics: synthetic anion receptors as fatty acid-activated proton transporters[J]. J Am Chem Soc, 2016,138(50):16508-16514.
[2] 孙艳荪,苏本利.解偶联蛋白2基因多态性与糖尿病微血管病变相关性的研究[J].中国糖尿病杂志,2011,19(5):333-334.
[3] Sramkova D, Krejbichova S, Vcelak J, et al. The UCP1 gene polymorphism A-3826G in relation to DM2 and body composition in Czech population[J]. Exp Clin Endocrinol Diabetes, 2007,115(5):303-307.
[4] Brondani LA, Duarte GC, Canani LH, et al. The presence of at least three alleles of the ADRB3 Trp64Arg (C/T) and UCP1-3826A/G polymorphisms is associated with protection to overweight/obesity and with higher high-density lipoprotein cholesterol levels in Caucasian-Brazilian patients with type 2 diabetes[J]. Metab Syndr Relat Disord, 2014,12(1):16-24.
[5] Nicoletti CF, de Oliveira AP, Brochado MJ, et al. UCP1-3826 A>G polymorphism affects weight, fat mass, and risk of type 2 diabetes mellitus in grade Ⅲ obese patients[J]. Nutrition, 2016,32(1):83-87.
[6] Lee KH, Chai VY, Kanachamy SS, et al. Association of UCP1-3826A/G and UCP3-55C/T gene polymorphisms with obesity and its related traits among multi-ethnic Malaysians[J]. Ethn Dis, 2015,25(1):65-71.
[7] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J]. 中国糖尿病杂志,2014,22(8):2-42.
[8] Ramage LE, Akyol M, Fletcher AM, et al. Glucocorticoids acutely increase brown adipose tissue activity in humans, revealing species-specific differences in UCP-1 regulation[J]. Cell Metab, 2016,24(1):130-141.
[9] 欧泽金.中国汉族人群CRTC3和UCP1基因多态性与肥胖及脂类代谢紊乱的关联研究[D]. 广州:南方医科大学, 2013.
[10] 陈燕子,付晓丽,戚敏杰,等.UCP1基因启动子甲基化与成人肥胖的关系[J].卫生研究,2017,46(1):1-6.
[11] Galetti S, Sarre A, Perreten H, et al. Fatty acids do not activate UCP2 in pancreatic beta cells: comparison with UCP1[J]. Pflugers Arch, 2009,457(4):931-940.
[12] Brondani LA, de Souza BM, Duarte GC, et al. The UCP1-3826A/G polymorphism is associated with diabetic retinopathy and increased UCP1 and MnSOD2 gene expression in human retina[J]. Invest Ophthalmol Vis Sci, 2012,53(12):7449-7457.
[13] Torkamandi S, Bastami M, Ghaedi H, et al. MAP3K1 may be a promising susceptibility gene for type 2 diabetes mellitus in an iranian population[J]. Int J Mol Cell Med, 2016,5(3):134-140.
[14] 高帆,韩睿,宋滇平.东亚人群2型糖尿病易感基因的研究进展[J].中华临床医师杂志(电子版),2015,9(6):1002-1006.
10.3969/j.issn.1002-266X.2017.30.018
R587.1
B
1002-266X(2017)30-0058-03
2017-03-17)

