二甲双胍对2型糖尿病合并非酒精性脂肪肝大鼠肝脏功能及炎症反应的影响
沈静雪,张亚杰,蔡凤,范德美,刘矩荣,田坚
(1沈阳医学院附属中心医院,沈阳110024;2中国医科大学附属盛京医院)
二甲双胍对2型糖尿病合并非酒精性脂肪肝大鼠肝脏功能及炎症反应的影响
沈静雪1,张亚杰2,蔡凤1,范德美1,刘矩荣1,田坚1
(1沈阳医学院附属中心医院,沈阳110024;2中国医科大学附属盛京医院)
目的 探讨二甲双胍对2型糖尿病(T2DM)合并非酒精性脂肪性肝病(NAFLD)大鼠肝功能及炎症反应的影响。方法 取40只大鼠,随机分为A组(T2DM+NAFLD+二甲双胍组)、B组(T2DM+NAFLD组)、C组(T2DM组)、D组(空白对照组)各10只。A、B组均予以高糖高脂饲料喂养4周制备NAFLD模型,C组予以基础饲料喂养4周,D组仅以基础饲料喂养8周。A、B、C组一次性腹腔注射STZ制备T2DM模型。造模4周后,A组予二甲双胍150 mg/(kg·d)灌胃4周,B、C、D组均予以等量生理盐水灌胃4周。各组干预结束后,麻醉大鼠,腹主动脉穿刺取血,检测血脂(TC、TG、HDL-C、LDL-C)、肝功能(ALT、AST、GGT)及血清TNF-α、IL-6水平。取肝脏组织,计算肝指数。采用HE染色法观察肝脏组织病理学变化。采用免疫组化法及Western blotting法检测肝脏组织TNF-α、IL-6蛋白表达。结果 ①B、C组TC、TG、LDL-C、GGT、ALT、AST均高于D组,HDL-C低于D组(P均<0.05或0.01)。A组TC、TG、LDL-C、GGT、ALT、AST均低于B组,HDL-C高于B组(P均<0.05或0.01)。②B、C组血清TNF-α、IL-6均高于D组,A组血清TNF-α、IL-6水平均低于B组(P均<0.05或0.01)。③B、C组肝指数均高于D组,A组肝指数低于B组(P均<0.01)。④D组肝组织结构完整,肝小叶结构正常。B、C组肝脏组织呈脂肪样变,部分可见小叶内炎性细胞浸润。A组肝脏脂肪变性程度及炎性细胞浸润较B组明显减轻。⑤B、C组肝脏组织中TNF-α、IL-6蛋白表达均高于D组(P均<0.01),A组肝脏组织中TNF-α、IL-6蛋白表达均低于B组(P均<0.05)。结论 二甲双胍可明显改善T2DM合并NAFLD大鼠的肝脏功能,抑制NAFLD的发生发展;其机制可能为通过降低炎性因子的表达、改善慢性炎症状态,从而发挥肝脏保护作用。
2型糖尿病;二甲双胍;非酒精性脂肪肝;炎症反应;肝脏功能;肿瘤坏死因子α;白细胞介素6
随着生活方式的改变与健康意识的滞后,2型糖尿病(T2DM)、非酒精性脂肪性肝病(NAFLD)等慢性病已成为全球最常见的疾病。目前,中国人群中单独患有T2DM或NAFLD的患病率为10%以上,而二者共同存在的患病率则为42.6%[1],提示二者之间存在密切的关系。随着对T2DM、NAFLD发病机制的深入研究,发现炎症反应在二者共同机制中起着重要的作用。二甲双胍是治疗T2DM的一线用药,通过降低肝糖原的异生、抑制肝糖原的输出,增加骨骼、肌肉等外周组织对葡萄糖的摄取及利用,发挥降糖作用。此外,它还参与脂质代谢,调节脂肪激素及炎性因子在肝脏中的表达。2016年1~10月,我们观察了二甲双胍对合并NAFLD的T2DM大鼠肝功能、炎症反应的影响,探讨二甲双胍对T2DM合并NAFLD的治疗作用。
1 材料与方法
1.1 动物与材料 SPF级雄性大鼠40只,5~6周龄,体质量(200±20)g,购自中国医科大学动物实验中心。链脲佐菌素(STZ,美国Sigma公司)。二甲双胍(中美上海施贵宝制药有限公司)。肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、采用ELISA试剂盒测定(北京中杉金桥有限公司)。
1.2 动物分组与模型制备 40只SPF级雄性大鼠适应性喂养1周后,随机分为A组(T2DM+NAFLD+二甲双胍组)、B组(T2DM+NAFLD组)、C组(T2DM组)、D组(空白对照组),每组10只。A、B组均予以高糖高脂饲料(10%猪油、20%蔗糖、2.5%胆固醇、1%胆酸盐、66.5%基础饲料)喂养4周,制备NAFLD模型。C组予以基础饲料喂养4周。A、B、C组均禁食水12~16 h,一次性腹腔注射0.5%STZ 30 mg/kg制备T2DM模型,1周后尾静脉取血,以血糖≥16.7 mmol/L且稳定2周为T2DM造模成功。D组仅以基础饲料喂养8周。
1.3 干预方法 A组于NAFLD+T2DM造模4周后,予以二甲双胍150 mg/(kg·d)溶于生理盐水灌胃4周。B组于NAFLD+T2DM造模4周后、C组于T2DM造模4周后、D组于基础饲料喂养8周后,均予以等量生理盐水灌胃4周。
1.4 血脂、肝功能指标及血清TNF-α、IL-6检测 各组干预结束后,禁食8 h,以10%水合氯醛(3 mL/kg)腹腔注射法麻醉大鼠,腹主动脉穿刺取血3 mL,检测血脂(TC、TG、HDL-C、LDL-C)、肝功能(ALT、AST、GGT)及血清TNF-α、IL-6水平。
1.5 肝指数测算 取材前测量大鼠体质量,取血后取出肝脏组织,称重后用4%多聚甲醛或液氮固定。肝指数=湿肝质量/体质量×100%。
1.6 肝脏组织病理学观察 将肝脏固定后制备石蜡切片,采用HE染色法观察肝脏组织病理学变化。
1.7 肝脏组织TNF-α、IL-6蛋白表达检测 采用免疫组化法及Western blotting法。①免疫组化法:肝组织石蜡切片,按试剂盒说明书染色。②Western blotting法:取肝组织约50 mg置于EP管内,加入500 μL的RIPA裂解液(其中含1%体积的PMSF),匀浆机匀浆,离心后提取蛋白。BCA法蛋白浓度,上样量约60 μg。配制8%的聚丙酰胺凝胶,煮样后电泳、转膜、封闭(5%脱脂奶粉);分别加入一抗TNF-α、IL-6于4 ℃过夜,洗膜1 h加入二抗,室温孵育2 h后电化学发光。应用Quantity One软件计算灰度值,以目的蛋白与GAPDH灰度比值表示目的蛋白表达量。
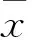
2 结果
2.1 各组血脂、肝功能指标比较 B、C组TC、TG、LDL-C、GGT、ALT、AST均高于D组,HDL-C低于D组(P<0.05或0.01)。A组TC、TG、LDL-C、GGT、ALT、AST均低于B组,HDL-C高于B组(P均<0.05或0.01)。B组TC、TG、LDL-C、GGT、ALT、AST均高于C组,HDL-C低于C组(P均<0.05或0.01)。见表1。
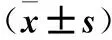
表1 各组血脂、肝功能指标比较
注:与D组比较,*P<0.01,﹟P<0.01;与B组比较,△P<0.01;与C组比较,▲P<0.01。
2.2 各组血清TNF-α、IL-6水平比较 B、C组血清TNF-α、IL-6均高于D组,A组血清TNF-α、IL-6水平均低于B组,B组血清TNF-α、IL-6水平均高于C组(P均<0.05或0.01)。见表2。
2.3 各组肝指数比较 A、B、C、D组肝指数分别为3.90%±0.35%、7.13%±0.47%、8.66%±0.72%、2.39%±0.41%,B、C组肝指数均高于D组,A组肝指数低于B组(P均<0.01)。
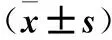
表2 各组血清TNF-α、IL-6水平比较
注:与D组比较,*P<0.05,﹟P<0.01;与B组比较,△P<0.01;与C组比较,▲P<0.01。
2.4 各组肝脏组织病理学变化 D组肝组织结构完整,肝小叶结构正常,肝细胞排列成肝索,在中央静脉周围呈放射状分布,细胞呈多边形。B、C组肝细胞体积不同程度增大,脂肪变以大泡性为主,细胞核被挤向一边,部分可见小叶内炎性细胞浸润。A组肝脏脂肪变性程度及炎性细胞浸润较B组明显减轻。
2.5 各组肝脏组织TNF-α、IL-6蛋白表达比较 ①免疫组化染色:D组大鼠肝脏组织中TNF-α、IL-6几乎无表达;A、B、C组大鼠肝脏组织中TNF-α、IL-6均呈阳性表达,主要定位于细胞质中,颜色呈棕黄色。B组肝脏组织中TNF-α、IL-6表达均较A、C组颜色较深,且阳性细胞数量较多。②Western blotting结果:B、C组肝脏组织中TNF-α、IL-6蛋白表达均高于D组(P均<0.01),A组肝脏组织中TNF-α、IL-6蛋白表达均低于B组(P均<0.05)。见表3、图1。
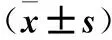
表3 各组肝脏组织TNF-α、IL-6蛋白表达比较
注:与D组比较,*P<0.01;与B组比较,△P<0.01。
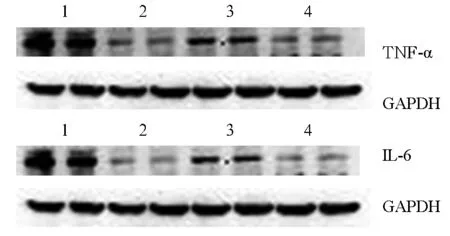
注:1为B组;2为A组;3为C组;4为D组。
图1 各组肝脏组织TNF-α、IL-6蛋白表达情况(Western blotting法)
3 讨论
临床观察发现,2型糖尿病患者常伴发NAFLD,50%~70%的T2DM患者伴有NAFLD, NAFLD人群是T2DM的高风险人群,40%~50%的NAFLD患者伴有不同程度的糖耐量异常,NAFLD患者6年内约20%可发展为糖尿病,提示二者之间有着密切的联系[2,3]。研究[4,5]发现,NAFLD可增加T2DM及其并发症的发生风险。在NAFLD患者中,由于胰岛素抵抗,TG在肝脏的积聚可导致胰岛素抑制肝糖输出的作用减弱,进一步产生高胰岛素血症和血糖升高,导致糖尿病的发生。此外,合并NAFLD的T2DM患者在心脑血管疾病、周围血管疾病、糖尿病肾病、糖尿病视网膜病变的患病率均较无NAFLD的T2DM患者升高;同样地,T2DM也是NAFLD发生的独立危险因素,并且能增加NAFLD 患者死亡的风险[6]。本研究发现,B、C组TC、TG、LDL-C、GGT、ALT、AST均高于D组,HDL-C低于D组,B、C组肝指数均高于D组,B、C组肝脏组织呈脂肪样变,提示T2DM、NAFLD均可使肝组织出现肝脏组织病变,可导致肝脏功能受损;B组上述指标的严重程度重于C组,提示当T2DM合并NAFLD时,有更严重的糖脂代谢紊乱、肝功能受损、肝脏脂肪变,存在着更显著的肝脏病变。
目前认为,炎症反应是T2DM与NAFLD共同的发病机制,从而导致临床上两种疾病相互依存。因此,针对慢性炎症反应进行研究,对于探讨T2DM与NAFLD的发病机制具有重要意义。在T2DM和NAFLD的易感人群中,随着营养过剩、体力活动减少等环境因素的作用,先天性免疫系统被激活,巨噬细胞、脂肪细胞等细胞分泌多种炎症因子,如TNF-α、IL-6等。这些炎症因子通过直接或间接影响胰岛素信号传导通路,从而引起胰岛素抵抗。研究发现, 炎症介导胰岛素抵抗的细胞内信号传导通路主要包括NF-κB、NF-κB抑制蛋白、IKK途径(IKK/NF-κB通路)、C-氨基末端激酶(JNK)通路、细胞因子信号转导抑制物(SOCS)通路、蛋白激酶C(PKC)信号通路等,均可通过多种途径刺激多种炎症因子如TNF-α、IL-6等的表达而导致胰岛素抵抗[7~10]。胰岛素抵抗贯穿于T2DM病程的始终,可减弱胰岛素对脂代谢的调节,促使脂肪沉积于肝脏。作为机体发生慢性炎症的早期炎症标志物,TNF-α、IL-6可通过以下作用促进T2DM患者的NAFLD:①通过脂解作用,使游离脂肪酸水平升高;②改变脂因子的生成,使致炎因子增多,而抗炎因子生成减少;③影响胰岛素信号传导系统,促使胰岛素抵抗形成;④造成线粒体功能障碍,诱发氧化应激[11,12]。本研究发现,与D组比较,B组、C组的血清TNF-α、IL-6水平明显增高,肝脏组织TNF-α、IL-6蛋白表达均明显增高,提示T2DM合并NAFLD时存在着慢性炎症反应,与文献报道一致[7,10]。
二甲双胍作为传统的胰岛素增敏剂,在临床上广泛应用。它能促进胰岛素与受体的结合,并通过降低肝糖原的异生、抑制肝糖原的输出,增加骨骼、肌肉等外周组织对葡萄糖的摄取及利用,发挥降糖作用。此外,它还参与脂质代谢,调节脂肪激素及炎性因子在肝脏中的表达。近年研究表明,二甲双胍具有显著的降低血脂、肝脏脂肪及改善肝功能的效果[13]。应用二甲双胍治疗NAFLD的临床报道也显示,患者口服该药物后AST、ALT下降[14]。近年研究发现,二甲双胍具有抗炎作用,其机制可能与下列作用有关[15~17]:①抑制炎症因子的形成:降低血浆纤溶酶原激活物抑制物-1、CRP的水平,减少氧化应激,改善内皮功能,从而延缓动脉粥样硬化的进程。②激活腺苷酸活化蛋白激酶(AMPK)途径:AMPK的激活可通过抑制NF-κβ的抑制蛋白激酶(IKKα和IKKβ)的活性及抑制Iκβα的磷酸化降解作用,减轻脂多糖诱导的NF-κβ活性,抑制转录因子CCAAT/增强子结合蛋白(C/EBP),调节TNF-α、IL-1β、IL-6、诱导型一氧化碳合酶(iNOS)、IL-8、IL-12、粒巨噬细胞集落刺激因子(GM-CSF)的核转位而发挥抗炎作用。③改善胰岛素抵抗:胰岛素抵抗参与了糖尿病的慢性炎症过程,二甲双胍除通过降低体质量间接改善胰岛素抵抗外,本身有直接的胰岛素增敏作用。④抗氧化作用:氧化应激可使单核细胞产生的活性氧簇(ROS)增多,促进NF-κβ活性增强。本研究发现,A组肝指数低于B组,肝脏脂肪变性程度和炎性细胞浸润较B组明显减轻,血清及肝脏组织中TNF-α、IL-6蛋白表达均低于B组,提示A组的糖脂代谢、血清TNF-α、IL-6水平及肝脏组织TNF-α、IL-6蛋白表达均显著改善。这表明二甲双胍可能通过抑制炎症因子TNF-α、IL-6,改善高糖高脂大鼠的脂代谢,从而减轻肝脏脂质的浸润,改善肝脏的脂肪变性及病理损伤。
总之,二甲双胍可明显改善T2DM合并NAFLD大鼠的肝脏功能,抑制NAFLD的发生发展,其机制可能为通过降低炎性因子的表达、改善慢性炎症状态。这表明二甲双胍除具有降糖作用外,还具有减轻肝脏的脂质沉积、降低炎症反应的作用,具有一定的肝脏保护作用。
[1] Williamson RM, Price, JF, Glancy S, et al. Prevalence of and risk factors for hepatic steatosis and nonalcoholic fatty liver disease in people with type 2 diabetes: the edinburgh type 2diabetes study[J]. Diabetes Care, 2011, 34(5):1139-1144.
[2] Howard C, Masuoka, Naga C ,et al. Nonalcoholic fatty liver disease: an emerging threat to obese and diabetic individuals[J]. Ann NY Acad Sci, 2013,1281:106-122.
[3] Fan JC, Li F, Cai XB, et al. Effects of nonalcoholic fatty liver disease on the development of metabolic disordes[J]. Gas Hepatol , 2007,22,(1):1086-1091.
[4] Targher G, Bertolini L, Padovani R, et al. Prevalence of nonalcoholic fatty liver disease and its association with cardiovascular disease among type 2 diabetic patients[J]. Diabetes Care, 2007,30(5):1212-1218.
[5] Targher G, Bertolini L, Rodella S, et al. Non-alcoholic fatty liver disease is independently associated with an increased prevalence of chronic kidney disease and proliferative/laser-treated retinopathy in type 2 diabetic patients[J]. Diabetologia, 2008,51(3):444-450.
[6] Stepanova M, Rafiq N, Younossi ZM. Components of metabolic syndrome are independent predictors of mortality in patients with chronic liver disease: a population-based study[J]. Gut,2010,59(10):1410-1415.
[7] King GL. The role of inflammatory cytokines in diabetes and its complications[J]. J Periodontol, 2008,79(suppl8):1527-1532.
[8] 金华,陈名道,杨颖.NF-κB信号转导通路与胰岛素抵抗[J].上海交通大学学报(医学版),2009,29(4):461-464.
[9] Osullivan LA, Liongue C, Lewis RS, et al. Cytokine receptor signaling through the Jak-Stat-Socs pathway in disease[J].Mol Imm,2007,44(10):2497-2504.
[10] Tilg H, Moschen AR. Inflammatory mechanisms in the regulation of insulin resistance[J]. Mol Med, 2008,14(3-4):222-229.
[11] Nathalie CL, Gil FS, Claudia RL, et al. Serum biomarkers in type 2 diabetic patients with non-alcoholic steatohepatitis and advanced fibrosis[J]. Hepatol Res, 2012:1-8
[12] Fabiola R, Claudia PM, Joel F, et al. Pro- and anti-inflammatory cytokins in steatosis and steatohepatitis[J]. Obes Surg, 2010,20:906-912.
[13] 高志强,陆付耳,董慧,等.二甲双胍干预高脂饲料所致大鼠脂肪肝的研究[J].中华肝脏病杂志,2005,13(2):101-104.
[14] Marchesini G, Brizi M,Bianchi G, et al. Metformin in non-alcoholic steatohepatitis[J]. Lancet, 2001,358(9285):893-894.
[15] Isoda K, Young JL, Zirlika, et al. Metformin inhibits proinflammatory responses and nuclear factor- kappa B in human vascular wall cells[J]. Arterioscler Thromb Vasc Biol, 2006,26(3):6112-6117.
[16] 丛维娜,叶菲.腺苷酸活化蛋白激酶与胰岛素抵抗[J].中国糖尿病杂志,2007,15(3):186-187.
[17] Ceriello A, Johns D, Widel M, et al. Comparis on of effect of pioglitaz one with metformin or sulfonylurea ( monorherapy and combination therapy ) on postload glycemia and composite insulin sensitivity index during an oral glucose tolerance test in patients with type 2diabetes[J]. Diabetes Care, 2005,28(2):266-272.
辽宁省沈阳市科技计划项目(F14-158-9-29)。
10.3969/j.issn.1002-266X.2017.30.010
R575.2;R587.1
A
1002-266X(2017)30-0036-04
2017-01-11)

