银杏叶提取物对慢性间歇性低氧大鼠胰岛β细胞氧化应激的影响及机制探讨
李无双,周燕,周璇
(1桂林医学院,广西桂林541001;2桂林医学院附属医院)
银杏叶提取物对慢性间歇性低氧大鼠胰岛β细胞氧化应激的影响及机制探讨
李无双1,周燕2,周璇1
(1桂林医学院,广西桂林541001;2桂林医学院附属医院)
目的 探讨银杏叶提取物(EGB)对慢性间歇性低氧(CIH)大鼠胰岛β细胞氧化应激反应的影响及其机制。方法 取10只SD大鼠置于低压氧舱内模拟间歇性低氧条件制备CIH模型,另取10只大鼠在常氧条件下饲养。于造模12周结束后,提取CIH模型大鼠及常氧饲养大鼠的原代胰岛β细胞,将常氧饲养大鼠的原代胰岛β细胞作为常氧对照组,将CIH模型大鼠的原代胰岛β细胞分为CIH模型组、抗核因子2相关因子(Nrf2)抗体组、Nrf2激活剂组、EGB低剂量组、EGB中剂量组、EGB高剂量组。常氧对照组、CIH模型组用普通DMEM培养基培养,抗Nrf2抗体组加入终浓度为20 μg/mL的Nrf2抗体,Nrf2激活剂组加入终浓度为20 μmol/L 的Nrf2激活剂莱菔硫烷,EGB低、中、高剂量组分别加入EGB 5、10、20 mg/mL。各组均干预24 h后,取各组细胞,检测细胞中氧自由基(ROS)含量、细胞上清液中丙二醛(MDA)及谷胱甘肽过氧化物酶(GSH-Px)水平。采用Western blotting法检测Nrf2-抗氧化反应元件(ARE)信号通路相关蛋白Nrf2及下游抗氧化酶靶蛋白血红素加氧酶-1(HO-1)、醌氧化还原酶(NQO1)、γ-谷氨酰半胱氨酸合成酶(γ-GCS)的表达。结果 与常氧对照组对比,CIH模型组MDA及ROS均升高,GSH-Px降低(P均<0.01)。与CIH模型组比较,抗Nrf2抗体组MDA及ROS均升高,GSH-Px降低(P<0.05或0.01);Nrf2激活剂组、EGB中剂量组、EGB高剂量组MDA及ROS均降低,GSH-Px均升高(P<0.05或0.01)。EGB高剂量组MDA及ROS均低于EGB低剂量组,GSH-Px高于EGB低剂量组(P<0.01或0.05)。与常氧对照组对比,CIH模型组Nrf2升高,HO-1、NQO1、γ-GCS均降低(P均<0.01)。与CIH模型组比较,抗Nrf2抗体组HO-1、NQO1均降低(P均<0.01);Nrf2激活剂组、EGB中剂量组、EGB高剂量组Nrf2、HO-1、NQO1、 γ-GCS均升高(P<0.05或P<0.01)。EGB高剂量组Nrf2、HO-1、NQO1、 γ-GCS均高于EGB中剂量组(P<0.05或0.01)。结论 EGB可减轻CIH导致的胰岛β细胞氧化应激反应水平,其机制可能与激活Nrf2-ARE信号通路有关。
慢性间歇性低氧;胰岛β细胞;银杏叶提取物;氧化应激;核因子2相关因子;阻塞性睡眠呼吸暂停综合征
慢性间歇性低氧(CIH)及由此导致的氧化应激反应是阻塞性睡眠呼吸暂停综合征(OSAS)最主要的病理生理特征。研究发现,CIH所致的氧化应激反应在机体损伤过程中起关键作用[1]。本课题组前期研究表明,OSAS可导致高胰岛素血症、胰岛素抵抗和胰岛功能受损,OSAS引起的氧化应激损伤是导致胰岛细胞毒性作用的重要原因,加重胰岛β细胞的损伤[2]。研究发现,CIH导致的氧化应激可以引起胰岛β细胞功能降低,并与氧化应激水平呈正相关[3]。对于OSAS的治疗,抗氧化剂可以成为一个有效的辅助疗法[4]。银杏叶提取物(EGB)是从银杏叶中提取的活性物质,主要成分为黄酮苷及银杏内酯,具有强抗氧化作用和清除自由基活性[5,6]。核因子E2相关因子(Nrf2)信号通路是迄今为止发现的最重要的内源性抗氧化应激通路,参与细胞氧化应激等多种防御机制,在机体氧化应激反应早期起重要保护作用。研究[7]发现,应用抗氧化剂可以延缓胰岛β细胞凋亡的进程。2014年9月~ 2016年7月,我们通过建立CIH模型来模拟OSAS的病理过程[8],探讨EGB经Nrf2信号通路对CIH大鼠模型胰岛β细胞氧化应激的作用,为治疗OSAS及其并发症提供实验依据。
1 材料与方法
1.1 动物、材料及仪器 健康8周龄雄性SD大鼠20只,SPF级,体质量(180±20)g,由桂林医学院实验动物中心提供。Nrf2、血红素加氧酶-1(HO-1)、醌氧化还原酶(NQO1)、γ-谷氨酰半胱氨酸合成酶(γ-GCS)单克隆抗体(美国Abcam公司);大鼠β-actin(北京中杉金桥生物技术有限公司);丙二醛(MDA)检测试剂盒(南京建成生物研究所有限公司);谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒(碧云天生物技术有限公司);氧自由基(ROS)测定试剂盒(碧云天生物技术有限公司);BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司);EGB761(金纳多,德国Schwabe制药集团)。间歇性低氧动物舱由南京新飞分析仪器有限公司提供(型号:JXOC-12型);紫外分光光度计(UV-2401PC,日本岛精公司);MLDEL680酶标仪(美国Bio-RAD公司);EPS 301型SDS-PAGE电泳仪(Amersham Pharmacia Biotech公司);JS-780全自动数码凝胶成像分析系统(培清科技公司)。
1.2 CIH模型制备方法 SD大鼠适应性喂养1周后,取10只用于制备CIH模型。置于低压氧舱内模拟间歇性低氧,向舱内循环通入氮气和氧气,每一次循环时间120 s(即30 s充入氮气,保持60 s,随之10 s充入氧气,保持20 s);调节气体流量,使每一循环舱内最低氧浓度达4%~6%,然后逐渐恢复至21%左右,每天8 h;其余时间置饲养笼,在室温、空气条件下正常饮食,造模时间为12周。其余10只SD大鼠在常氧条件下饲养,每日同时置于相同规格的有机玻璃舱内,输入空气,无缺氧。
1.3 大鼠原代胰岛β细胞提取 于造模12周结束后,提取CIH模型大鼠及常氧饲养大鼠的原代胰岛β细胞。在无菌操作下暴露大鼠胰胆管,于近肝门段和入十二指肠开口处结扎,将胶原酶Ⅴ经胆管逆行向大鼠胰腺注入,取出膨大的胰腺;参考Lambert分离方法提取原代胰岛β细胞,Ficoll密度梯度离心法纯化胰岛β细胞,得到纯度约为85%的胰岛β细胞。显微镜下见胰岛β细胞呈圆形或椭圆形,形态完整,有折光性,双硫腙(DTZ)染色后胰岛β细胞呈猩红色,表明胰岛β细胞提取成功。
1.4 细胞分组与干预处理 将提取成功的常氧饲养大鼠原代胰岛β细胞作为常氧对照组,将CIH模型大鼠的原代胰岛β细胞分为CIH模型组、抗Nrf2抗体组、Nrf2激活剂组、EGB低剂量组、EGB中剂量组、EGB高剂量组。常氧对照组用含15%胎牛血清的DMEM,CIH模型组使用普通培养基相同条件培养,抗Nrf2抗体组加入终浓度为20 μg/mL的Nrf2抗体,Nrf2激活剂组加入终浓度为20 μmol/L 的Nrf2激活剂莱菔硫烷(SFP),EGB低、中、高剂量组分别加入EGB 5、10、20 mg/mL。于5%CO2、37 ℃恒温培养箱培养,各组均干预24 h。
1.5 氧化应激相关指标检测 取各组细胞,采用Fenton反应及Gress显色法检测细胞中的ROS,硫代巴比妥酸法测定细胞上清液中的MDA,比色法检测细胞上清液中的GSH-Px,严格按试剂盒说明书进行操作。
1.6 Nrf2-抗氧化反应元件(ARE)信号通路蛋白及下游抗氧化酶靶蛋白检测 采用Western blotting法检测Nrf2-ARE信号通路相关蛋白Nrf2及下游抗氧化酶靶蛋白HO-1、NQO1、 γ-GCS的表达。用PBS将贴壁细胞吹打下来,与收集到的细胞培养液混匀,离心弃上清。冰上裂解细胞,转移至EP管,加1×Buffer煮8 min使蛋白变性。BCA蛋白浓度测定试剂盒测定总蛋白浓度,根据标本蛋白浓度计算上样量,使每孔蛋白上样量一致;行SDS-PAGE凝胶电泳,将蛋白转移至PVDF膜上;用5%的脱脂奶粉封闭后,分别加入抗Nrf2、HO-1、NQO1、 γ-GCS、β-actin抗体,过夜孵育;洗膜后加入二抗室温孵育2 h;TBST充分洗涤后,定影、显影,X线胶片曝光记录影像;凝胶成像分析系统分析胶片。各目的蛋白表达水平用目的蛋白条带光密度值与内参β-actin 条带光密度值之比表示。
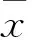
2 结果
2.1 各组氧化应激相关指标比较 与常氧对照组对比,CIH模型组MDA及ROS均升高,GSH-Px降低(P均<0.01)。与CIH模型组比较,抗Nrf2抗体组MDA及ROS均升高,GSH-Px降低(P<0.05或P<0.01);Nrf2激活剂组、EGB中剂量组、EGB高剂量组MDA及ROS均降低,GSH-Px升高(P<0.05或P<0.01)。EGB高剂量组MDA及ROS均低于EGB低剂量组,GSH-Px高于EGB低剂量组(P<0.05或P<0.01)。见表1。
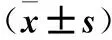
表1 各组ROS、MDA、GSH-Px水平比较
注:与常氧对照组比较,*P<0.01;与CIH模型组比较,﹟P<0.01,△P<0.05;与EGB低剂量组比较,▲P<0.01。
2.2 各组细胞中Nrf2、HO-1、NQO1、 γ-GCS蛋白表达比较 与常氧对照组对比,CIH模型组Nrf2升高,HO-1、NQO1、 γ-GCS均降低(P均<0.01)。与CIH模型组比较,抗Nrf2抗体组HO-1、NQO1均降低(P均<0.01);Nrf2激活剂组、EGB中剂量组、EGB高剂量组Nrf2、HO-1、NQO1、 γ-GCS均升高(P<0.05或P<0.01)。EGB高剂量组Nrf2、HO-1、NQO1、 γ-GCS均高于EGB中剂量组(P<0.05或P<0.01)。见表2、图1。
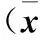
表2 各组细胞中Nrf2、HO-1、NQO1、 γ-GCS蛋白表达比较±s)
注:与常氧对照组比较,*P<0.01;与CIH模型组比较,﹟P<0.01,△P<0.05;与EGB低剂量组比较,▲P<0.01。
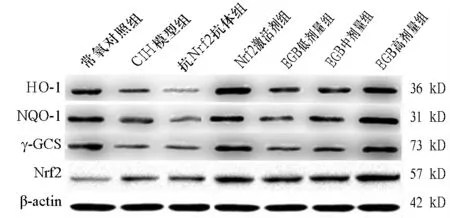
图1 各组细胞中Nrf2、HO-1、NQO1、γ-GCS蛋白表达情况(Western blotting法)
3 讨论
OSAS特征性的表现为睡眠状态时反复出现的低氧血症、高碳酸血症及睡眠结构紊乱,可引起组织器官缺血、缺氧,继而导致多器官系统功能不全或障碍[9]。OSAS是一种氧化应激性疾病,而氧化应激的发生与CIH有着直接的关联[10]。胰岛组织中抗氧化酶含量在所有组织中是最低的,对氧化应激也最为敏感;与机体其他细胞相比,胰岛β细胞更易受到氧化应激损伤产生凋亡。氧化应激可使胰岛β细胞对ROS反应性增高,体内产生的ROS进一步增多。研究[11]发现,OSAS与2型糖尿病(T2DM)关系密切,OSAS与糖耐量、胰岛素抵抗独立相关,是糖尿病患者血糖紊乱的独立危险因素;并且,OSAS患者中普遍存在胰岛素抵抗状态,与病情严重程度相关。而胰岛素抵抗与胰岛β细胞功能缺陷是T2DM发病机制的两个要素,OSAS导致胰岛β细胞功能受损的具体机制未见文献报道。
氧化应激可导致抗氧化类物质增多,打破体内氧化和抗氧化平衡,引起组织和细胞内ROS增多,造成ROS在细胞内的毒性作用,形成脂质过氧化及DNA损害。MDA由体内ROS氧化胞膜上不饱和脂肪酸而形成,可间接反映脂质过氧化水平。GSH-Px是体内广泛存在的重要的过氧化物分解酶,可阻断脂质过氧化链锁反应,保护细胞膜免受过氧化损害,是衡量机体抗氧化能力的重要指标。ROS、MDA、GSH-Px可反映机体氧化应激及抗氧化系统的程度。本研究发现,与常氧对照组对比,CIH模型组MDA及ROS均升高,GSH-Px降低。提示CIH模型大鼠胰岛β细胞中出现氧化活性物质的堆积、脂质过氧化及抗氧化系统水平减弱,出现氧化系统及抗氧化系统失衡,导致氧化应激反应的发生。这表明CIH模型大鼠胰岛β细胞中氧化应激水平升高,从而可导致胰岛β细胞的氧化损伤。
Nrf2信号通路由转录因子Nrf2、调控蛋白Keap1以及ARE组成。Nrf2是细胞氧化后应激反应中的关键因子,通过与ARE相互作用,调节下游靶基因及其产物,对于维持体内抗氧化物及过氧化物的平衡有重要作用,是机体各类细胞参与抗氧化损伤的关键转录因子[12]。本研究发现,与CIH模型组比较,抗Nrf2抗体组MDA及ROS均升高、GSH-Px降低,而Nrf2激活剂组MDA及ROS均降低、GSH-Px升高。这提示激活Nrf2信号通路能够改善CIH模型大鼠胰岛β细胞的氧化应激水平,表明发生CIH时胰岛β细胞氧化应激损伤的发生与Nrf2信号通路有关。
Nrf2-ARE信号通路的主要抗氧化蛋白和酶类可分为HO-1、NQO1及γ-GCS。其中,HO-1参与氧化反应,转录表达后为重要的抗氧化细胞保护蛋白[13];NQO1参与调节细胞内氧化还原状态;γ-GCS可增强机体的抗氧化应激能力。氧化应激发生时,过量的ROS能激活Nrf2-ARE信号通路,调控下游抗氧化酶的靶基因蛋白表达[14],减少ROS的产生,减轻氧化应激对机体的损伤。本研究发现,与常氧对照组对比,CIH模型组Nrf2升高,HO-1、NQO1、γ-GCS均降低,这表明CIH导致的氧化应激能激活抗氧化应激因子Nrf2的表达,且氧化应激消耗信号通路下游抗氧化蛋白HO-1、NQO1、γ-GCS。
EGB是从银杏叶中提取的活性物质,具有显著的抗氧化作用和清除自由基活性能力[5,6]。EGB可阻止脂质过氧化,清除超氧阴离子及清除氧自由基,上调谷胱甘肽水平。EGB在胰岛β细胞内也表现出类似其他组织的抗氧化活性作用,具有改善胰岛微环境、保护胰岛β细胞的作用,其机制与减少氧化应激的来源有关。本研究发现,与CIH模型组相比,EGB中剂量组、EGB高剂量组MDA及ROS均降低,GSH-Px升高,提示EGB可以增加抗氧化能力,减轻氧化应激反应,具有抗氧化作用;EGB高剂量组MDA及ROS均低于EGB低剂量组,GSH-Px高于EGB低剂量组,提示EGB改善CIH模型大鼠氧化应激水平的作用与剂量有关,剂量较高时其改善作用更明显;EGB中剂量组、EGB高剂量组Nrf2、HO-1、NQO1、 γ-GCS均升高,且EGB高剂量组Nrf2、HO-1、NQO1、γ-GCS均高于EGB中剂量组。这些均提示EGB降低CIH模型大鼠的氧化应激水平的作用与激活Nrf2信号通路、调节通路下游抗氧化蛋白的水平有关,且剂量较高时作用更明显,从而减轻胰岛β细胞的氧化应激损伤,对胰岛β细胞发挥保护作用。
综上所述,CIH时可导致胰岛β细胞氧化应激反应的发生,而EGB可减轻氧化应激水平,其机制可能与激活Nrf2-ARE信号通路有关,可作为治疗OSAS及其并发症的潜在靶点。
[1] Driessen C, Plomp RG, van der Spek PJ, et al. Is there an effect of obstructive sleep apnea syndrome on oxidative stress and inflammatory parameters in patients with craniofacial anomalies[J]. J Craniofac Surg, 2013,24(6):1908-1913.
[2] 周燕,唐灵,陈梅唏.老年阻塞性睡眠呼吸暂停低通气综合征患者血清脂联素、抵抗素的变化及其与胰岛素抵抗的相关性[J].中国老年学杂志,2010,30(24):3621-3623.
[3] 周燕,陈静,高一萍.吡格列酮对慢性间歇性低氧大鼠氧化应激水平及胰岛功能的干预作用[J].中国药学杂志,2015,50(5):38-42.
[4] Zirlik S, Hildner KM, Tarqosz A, et al. Melatonin and omentin:influence factors in the obstructive sleep apnoea syndrome[J]. J Physiol Pharmacol, 2013,64(3):353-360.
[5] Abd-Elhady RM,Elsheikh AM, Khalifa AE. Anti-amnestic properties of Ginkgo biloba extract on impaired memory function induced by aluminum in rats [J]. Int J Dev Neurosci, 2013, 31(7):598-607.
[6] 王晓霞,王颖超,赵明.银杏叶提取物对糖尿病外周血内皮祖细胞超氧化物歧化酶及凋亡的影响[J].医学研究生学报,2012,25(3):244-248.
[7] Mahadevan J, Parazzoli S, Oseid E, et al. Ebseten treatment prevents islet apoptosis,maintains intranuclear Pdx-1 and MafA levels,and preserves β-cell mass and function in ZDF rats[J]. Diabetes, 2013,62(10):3582-3588.
[8] Song F, Jia W, Yao Y, et al. Oxidative stress, antioxidant status and DNA damage in patients with impaired glucose regulation and newly diagnosed type 2 diabetes [J]. Clin Sci(Lond), 2007,112(12):599-606.
[9] Ingram DG, Matthews CK. Effect of adenotonsillectomy on c-reactive protein levels in children with obstructive sleep apnea: a meta-analysis[J]. Sleep Med, 2013,14(2):172-176.
[10] Prabhakar NR, Kumar GK, Nanduri J. Intermittent hypoxia-mediated plasticity of acute O2sensing requires altered red-ox regulation by HIF-1 and HIF-2[J]. Ann NY Acad Sci, 2009,1177(1):162- 168.
[11] Hermans MP, Ahn SA, Mahadeb YP, et al. Sleep aponea syndrome and 10-year cardiovascular risk in females with type2 diabetes: relationship with insulin secretion and insulin resistance[J]. Diabetes Metab Res Rev, 2013,29(3):227-234.
[12] Ma Q. Role of Nrf2 inoxidative stress and toxicity[J]. Annu Rev PHarmacol Toxicol, 2013,53(1):401-426.
[13] Güney O, Erdi F, Esen H, et al. N-acetylcysteine prevents vasospasm after subarachnoid hemorrhage[J]. World Neurosurg, 2010,73(1):42-49.
[14] Thimmulappa RK, Mai KH, Srisuma S, et al.Identification of Nrf2-regulated genes induced by the ehemopreventive agent sulforaphane by oligonucleotide microarray[J].Cancer Res, 2002,62(18):5196-5203.
Effects of ginkgo biloba extracts on oxidative stress of islet β-cells in chronic intermittent hypoxic rats
LIWushuang1,ZHOUYan,ZHOUXuan
( 1GuilinMedicalUniversity,Guilin541001,China)
Objective To investigate the effects of ginkgo biloba extracts (EGB) on oxidative stress of islet β-cells in rats with chronic intermittent hypoxia (CIH) and its mechanism.Methods Ten SD rats were placed in hypoxia chamber to simulate intermittent hypoxia to prepare CIH models, and the other 10 rats were fed under normoxic conditions. At the end of 12 weeks, the primary islet β-cells from CIH model rats and normoxic rats were extracted. The primary islet cells of the normoxic rats were used as the normoxic control group; the primary islet cells of CIH model rats were divided into the CIH model group, anti-Nrf2 antibody group, Nrf2 activator group, low-dose EGB group, medium-dose EGB group, and high-dose EGB group. Rats in the oxygen control group and CIH model group were cultured in DMEM medium; Nrf2 antibody was added to the Nrf2 antibody group; Nrf2 activator sulforaphane with final concentration of 20 μg/mL was added to the Nrf2 activator group; 5, 10, and 20 mg/mL EGB were added to the low-dose EGB group, medium-dose EGB group, and high-dose EGB group, respectively. The cells were taken from rats in each group after 24-hour intervention. The content of reactive oxygen species (ROS), the content of malondialdehyde (MDA) and glutathione peroxidase (GSH-Px) in the supernatant was measured. The expression levels of Nrf2-ARE signal pathway related protein Nrf2 and downstream antioxidant enzyme-target protein HO-1, NQO1 and γ-GCS were detected by Western blotting.Results Compared with the normoxic control group, MDA and ROS increased and GSH-Px decreased in the CIH model group (allP<0.01). Compared with the CIH model group, MDA and ROS increased and GSH-Px decreased in anti-Nrf2 antibody group (P<0.01 orP<0.05). In the Nrf2 activator group, medium-dose EGB group, and high-dose EGB group, MDA and ROS were reduced, and GSH-Px increased (P<0.01 orP<0.05). MDA and ROS were lower and GSH-Px was higher in the high-dose EGB group than in the low-dose EGB group (P<0.01 orP<0.05). Compared with the normoxic control group, the level of Nrf2 increased, and HO-1, NQO1 and γ-GCS decreased in the CIH model group (allP<0.01). Compared with the CIH model group, HO-1 and NQO1 decreased in the anti-Nrf2 antibody group (bothP<0.01). In the Nrf2 activator group, medium-dose EGB group, and high-dose EGB group, Nrf2, HO-1, NQO1, and γ-GCS increased (P<0.01 orP<0.05). The levels of Nrf2, HO-1, NQO1, and γ-GCS in the high-dose EGB group were higher than those of the medium-dose EGB group (P<0.01 orP<0.05).Conclusion EGB can reduce the level of oxidative stress in islet cells caused by CIH, and its mechanism may be related to the activation of Nrf2-ARE signaling pathway.
chronic intermittent hypoxia; islet β-cells; oxidative stress; ginkgo biloba extract; nuclear factor 2 related factor; obstructive sleep apnea syndrome
国家自然科学基金资助项目(81460019)。
李无双(1990-),女,硕士研究生,住院医师,主要研究方向为睡眠呼吸疾病。E-mail: 1009964826@qq.com
周燕(1972-),女,硕士研究生,主任医师,主要研究方向为睡眠呼吸疾病。E-mail: 180876118@qq.com
10.3969/j.issn.1002-266X.2017.30.002
R852.11;R322.5
A
1002-266X(2017)30-0005-05
2017-02-12)

