三种实验室检测方法在疟疾检测中的应用比较
施勇,龚甜,李健雄,肖芳,周珺,熊英
(江西省疾病预防控制中心,江西南昌330029)
三种实验室检测方法在疟疾检测中的应用比较
施勇,龚甜,李健雄,肖芳,周珺,熊英
(江西省疾病预防控制中心,江西南昌330029)
目的探讨三种实验室检测方法对疟疾检测的应用价值。方法分别采用传统镜检法、巢式聚合酶链反应(PCR)法及实时荧光(Real-Time)PCR法,对江西省2012年-2014年的61份疟疾疑似病例血样进行检测。结果巢式PCR法和Real-Time PCR法的结果一致,与镜检结果有17份样本不一致。结论巢式PCR法和Real-Time PCR法检测疟疾感染具高度敏感性和特异性,对疟疾鉴别诊断和明确诊断具有重要价值。
疟疾;巢式聚合酶链反应;镜检法
疟疾是经蚊媒传播的重要热带病,也是严重危害人类身体健康和生命安全及社会经济发展的重要寄生虫病[1],主要流行于热带和亚热带地区。在目前疟疾防治和监测工作中,镜检仍为发现疟疾病例的主要手段[2],但传统的镜检方法检出率低并费时、费力,且镜检人员的专业素质和经验会直接影响结果的判定,当原虫密度较低时,镜检容易出现漏检,对于国内少见的卵形疟和三日疟,容易错判。近年来国内外将巢式PCR和Real-Time PCR技术应用于疟疾的快速检测和分型[3],能准确判断疑似病例是否感染或携带疟原虫,以便及时发现和采取必要的防控措施。
本研究采用姬氏染色镜检、巢氏PCR及实时荧光(Real-Time)PCR法3种方法对江西省2012年-2014年各地市疾控中心上送的61份疟疾疑似病例血样进行检测,并对结果进行分析,比较其优缺点。
1 材料与方法
1.1 疟疾样本江西省2012年-2014年各地市疾控中心上送的61份疟疾疑似病例血样。
1.2 仪器和试剂核酸提取试剂盒(QIAamp DNA Mini Kit)购自德国Qiagen公司;PCR Master Mix (LOT.0000031171)购自美国Promega公司;光学显微镜购自日本Olympus公司,循环扩增仪购自美国Bio-rad公司,凝胶成像系统购自法国VILBER LOURMAT公司,荧光PCR仪为ABI7500。
1.3 显微镜检查以姬氏染色法染色厚薄血片,参照中华人民共和国卫生行业标准-疟疾诊断标准(WS259-2015)附录B《病原学检查》规范要求,进行厚薄血膜制作与吉氏染色,显微镜油镜下检查。
1.4 巢氏PCR检测用QIAamp DNA Mini Kit核酸提取试剂盒提取滤纸血中的疟原虫基因组DNA,按说明书操作,获得100μl DNA,-70℃保存。对核酸进行巢氏PCR扩增,引物由上海生工生物工程有限公司合成,序列见表1。反应体系(25μl):2×PCR Master Mix 12.5μl,上、下游引物(10μmol/ μl)各1μl,模板DNA 5μl(第1轮),用ddH2O补至25μl。反应条件:94℃3min;94℃30s,58℃30s,72℃1min 40s,共35个循环;72℃10min。取第一轮PCR产物1μl为模板DNA进行第二轮PCR,反应体系和反应条件同上。以2%琼脂糖凝胶电泳鉴定第二轮PCR产物,用凝胶成像系统观察结果。
1.5 实时荧光(Real-Time)PCR检测用上海之江的商品化试剂盒按照说明书进行检测,试剂盒分别为疟原虫核酸测定试剂盒(货号ED-0066-02),恶性疟核酸测定试剂盒(货号ED-0214-02),卵形疟核酸测定试剂盒(货号ED-0215-02),三日疟核酸测定试剂盒(货号ED-0216-02),间日疟核酸测定试剂盒(货号ED-0217-02),卵形疟原虫Wallikeri亚种核酸测定试剂盒(货号ED-0425-02)。
2 结果
比较、分析61份样品的检测结果,61份样品为2012年-2014年各地市疾控中心采集并镜检阳性样本,上送至省疾控中心,均为输入性疟疾病例,其镜检结果为44份恶性疟,13份间日疟,4份疟疾未分型。而巢式PCR法和Real-Time PCR法的结果一致,其结果为44份恶性疟,6份间日疟,1份卵形疟,1份三日疟,2份恶性疟和三日疟混合感染,其余7份阴性。PCR检测结果与镜检结果有44份一致,其中恶性疟39份,间日疟5份;有17份样本与镜检结果不一致(表2)。

表1 巢氏PCR检测疟原虫种类的引物及其扩增产物长度
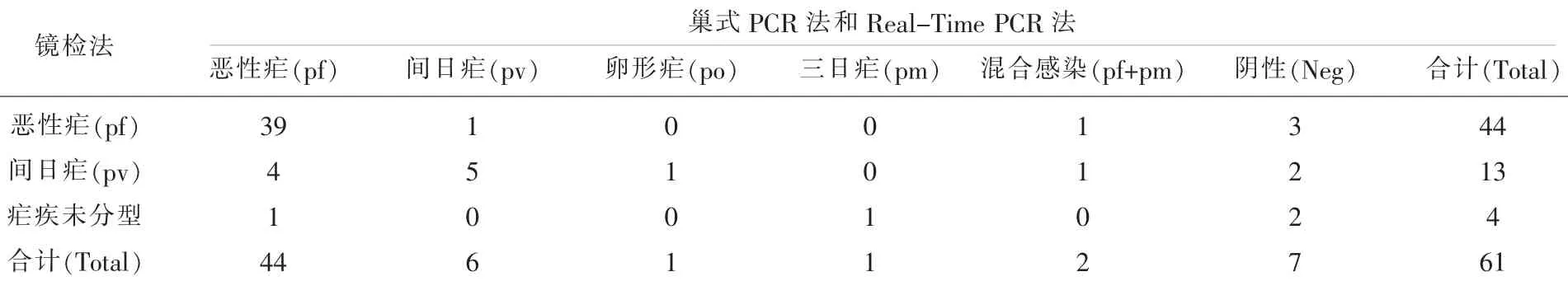
表2 61份样本镜检法与巢式PCR法和Real-Time PCR法结果比较
3 讨论
疟疾诊断标准(WS259-2015)中规定的三种实验室检查中,以形态学为基础的血涂片显微镜检查,是多数基层医疗单位主要或唯一的诊断手段,其敏感度可达到血样10~20个原虫/μl[4]。该方法简便、经济,适用于基层应用;缺点是结果判读受检验人员镜检技术、制片染色技术、显微镜质量和视力疲劳程度等因素影响,导致疟疾病例的确诊与鉴别诊断困难[5]。特别在疟原虫混合感染或药物治疗后,疟原虫形态遭到破坏,给原虫染色镜检增加非常大的难度[6],而以分子形式存在血液中的核酸不受破坏,仍可被检出。本研究中,经过巢式PCR法和Real-Time PCR法的复核检测,镜检有5份恶性疟和8份间日疟发生了误诊,对疟疾病例的治疗带来了一定的影响。
PCR检测是通过体外扩增,使得特异性靶DNA序列拷贝数在数小时内成百万倍的增加,大大提高了检测的敏感性。检测间日疟和恶性疟的敏感度血样分别为0.1个原虫/μl[7]和1.5个原虫/ μl[8],显著高于其他检查方法。而且PCR检测疟疾具有疟原虫种、株的鉴别能力,并能方便地检测出镜检漏诊的混合感染。近年来,许多学者用PCR技术检测疟原虫的实验室研究中,均显示了PCR在疟疾诊断中比镜检检测方法更具敏感性及特异性[9-11]。本研究中,巢式PCR法和Real-Time PCR法检出了镜检漏检的2例混合感染的病例,并对镜检未能分型的4份疟疾病例进行了分型,其中1份恶性疟,1份三日疟,2份阴性,由于不同型别的疟疾治疗药物有所不同,疟疾病例正确的分型对于治疗来说意义重大。
由于人群对疟疾抵抗力的增强,加上抗疟药的滥用,病人治疗不规范等,使传染源多为低密度带虫者。常规镜检法不易检出,常出现漏诊,使传染源不能及时发现和彻底根除。因此,PCR作为高度敏感、高度特异的疟疾诊断技术,更能适应疟疾监测、诊断和鉴别诊断的需要[12],并为下一步的治疗提供最正确的科学依据。随着PCR技术的日趋成熟和检测成本的降低,在疟疾防治、监测中,将具有广阔的应用价值和前景。
[1]卫生部疾控预防控制局.疟疾防治手册[M].第3版.北京:卫生部,2010.
[2]刘秋莲,赖云英,张水生.疟疾患者骨髓片与血片疟原虫阳性率比较[J].实验与检验医学,2013,31(10):503-504.
[3]Xia H,Shen YZ,Gao Q,et al.Field evaluation for malaria surveillance using a Plasmodium vivax PCR detection kit[J].Chin J Parasit Dis Contorl,2000,13(4):247-249.
[4]Bruce?Chwatt LJ.DNA probes for malaria diagnosis[J].Lancet,1984,323(8380):795.
[5]巫学兰.疟原虫镜检及鉴定方法探讨[J].实验与检验医学,2011,4(29):200-201.
[6]张勤,罗忠鑫,侯瑞生,等.疟疾四重巢式PCR检测方法的建立[J].中国国境卫生检疫杂志,2015,38(1):13-16,20.
[7]诸欣平,李明,董洁,等.套式PCR扩增特定SSrRNA基因片段诊断间日疟及混合感染的研究[J].中国寄生虫病防治杂志,1998,11(2):92-95.
[8]孙明林,陈培霞,薛采芳,等.套式PCR检测滤纸干血滴中恶性疟原虫的研究[J].中国寄生虫学与寄生虫病杂志,1996,14(3):197-200.
[9]林敏,高世同.PCR检测疟疾混合感染的现场应用研究[J].中国寄生虫病防治杂志,2004,17(3):162-163.
[10]夏惠,沈毓祖,高琪,等.间日疟原虫PCR检测试剂盒用于疟疾监测的现场评价[J].中国寄生虫病防治杂志,2000,13(4):247-249.
[11]吴英松,江晓玲,李明,等.聚合酶链反应检测疟疾的研究[J].热带医学杂志,2001,1(1):50-52.
[12]张勤,侯瑞生,薛云红,等.多重巢式聚合酶链反应在疟疾混合感染检测与分型中的应用[J].东南大学学报(医学版),2015,34(2):182-186.
R531.3,R446.11+1,R446.62
A
1674-1129(2017)04-0545-02
10.3969/j.issn.1674-1129.2017.04.032
2016-09-19;
2017-06-12)

