核苷(酸)类似物治疗慢性乙型肝炎患者HBV逆转录酶区变异的研究
李健,曾文兴,方颖慧,曾小平
(1、南昌大学基础医学院免疫学教研室,江西南昌330006;2、宜春市人民医院检验科,江西宜春336000)
核苷(酸)类似物治疗慢性乙型肝炎患者HBV逆转录酶区变异的研究
李健1、2,曾文兴2,方颖慧2,曾小平1
(1、南昌大学基础医学院免疫学教研室,江西南昌330006;2、宜春市人民医院检验科,江西宜春336000)
目的分析核苷(酸)类似物治疗的慢性乙型肝炎患者HBV逆转录酶区耐药相关变异位点、变异位点组合模式、HBV DNA水平和HBeAg等特征,为临床应用核苷(酸)类似物抗乙肝病毒治疗提供参考。方法纳入研究的141例慢性乙型肝炎患者,使用NAs治疗的107例为治疗组,未使用药物抗病毒治疗的34例为对照组。采用线性探针反向杂交法(PCRRLP)检测HBV逆转录酶区耐药相关变异位点,实时荧光定量PCR法检测乙型肝炎病毒DNA水平,酶联免疫吸附试验检测乙肝免疫标记物,并对耐药相关变异的特点和研究病例的临床资料进行统计学分析。结果核苷(酸)类似物治疗效果不佳组耐药相关变异检出率(82.5%)明显高于未治疗的对照组(5.9%)和抗病毒治疗有效组(有效组10例未检出耐药相关变异)(P<0.01)。97例核苷(酸)类似物抗病毒效果不佳的病例中80例检出140个耐药相关变异位点,包括rtM204I 45个、rtM204V 32个、rtA181V 28个、rtL180M 25个、rtN236T 10个;变异位点组合模式主要有:rtL180M+rtM204I、rtM204V、rtM204I+rtM204V、rtA181V+rtM204V、rtM204I、rtA181V+rtN236T等;51个对NAs应答不佳病例耐药变异检出率70.59%,46个病毒学突破病例耐药变异检出率95.65%,差异明显(P<0.01)。NAs单药治疗病例早于多药治疗病例检出耐药相关位点(P<0.01);NAs治疗时间越长,耐药变异检出率越高(P<0.01);病例HBV-DNA水平等级越高,耐药变异检出率也越高(P<0.01)。结论⑴NAs治疗慢性乙型肝炎可导致HBV逆转录酶区变异,NAs抗乙型肝炎病毒效果不佳与HBV逆转录酶区变异密切相关;⑵不同NAs药物导致慢性乙肝患者HBV逆转录酶区变异位点、变异模式特点不同;⑶NAs治疗慢性乙型肝炎的用药种类与方式、治疗时长,患者HBV-DNA水平等对HBV逆转录酶区发生耐药变异均可能产生重要影响。提示在NAs治疗前、治疗过程合适时间点检测NAs耐药相关变异位点和HBV DNA水平,可为临床慢性乙型肝炎的抗病毒治疗提供重要参考。
核苷(酸)类似物;慢性乙型肝炎;耐药;HBV逆转录酶区;基因变异
乙型肝炎病毒(Hepatitis B virus,HBV)是引起慢性乙型肝炎(Chronic hepatitis B,CHB)的病原体,在全球流行。世界卫生组织报道,全球约20亿人曾感染HBV,其中2.4亿人为慢性HBV感染者[1];全球有30%的肝硬化、45%的肝癌由乙肝病毒感染而引起;HBV感染导致的肝功能衰竭、肝硬化和肝细胞癌患者中每年有约65万人死亡[2-4]。在我国60%肝硬化和80%HCC患者由HBV感染引起[4,5]。我国10年前乙型肝炎血清流行病学调查表明,我国一般人群HBsAg携带率为7.18%[6-8],推算我国现有约有9300万慢性HBV感染者,约有2000万例CHB患者[9,10]。乙型肝炎病毒感染和治疗是我国也是全球严重的公共卫生问题之一,长期危害人民健康、阻碍经济发展、影响社会和谐。因此,加强乙型病毒性肝炎检测、预防、诊断、治疗和预后的相关研究,具有重要意义。
目前除干扰素外,应用于乙型肝炎抗病毒治疗的主要药物是核苷(酸)类似物(nucleoside analogues,NAs)。我国批准的核苷(酸)类似物包括拉米夫定(Lamivudine,LAM)、阿德福韦酯(Adefovir dipivoxil,ADV)、恩替卡韦(Entecavir,ETV)、替比夫定(Telbivudine,LdT)等[11]。LAM和LdT为L-核苷类药物;ETV为脱氧鸟苷类药物;ADV为五环磷酸盐类药物。NAs进入人体内可形成磷酸盐活性成分,作为HBV DNA聚合酶的竞争性抑制剂与人体内天然的脱氧三磷酸核苷(dNTP)竞争结合到HBV DNA聚合酶上,使HBV的DNA链合成终止,这是NAs抑制HBV复制的机制[12,13]。NAs口服给药、价格较低、抗病毒效果较好因而目前广泛应用于抗乙肝病毒。用药依从性好的HBeAg阳性CHB患者,LAM治疗一年内HBV DNA的转阴率可达30%~40%[14,15];ADV治疗一年内HBV DNA的转阴率可达10%~25%[16];ETV治疗一年内HBV DNA的转阴率可达67%[14];LdT治疗一年内HBV DNA的转阴率可达60%[16];对HBeAg阴性CHB患者,单用NAs治疗一年内HBV DNA的转阴率更好,可达50%~90%[17-19]。
HBV是变异率较高的病毒之一,发生在HBV逆转录酶区的基因变异,如果与HBV聚合酶有关就可导致HBV聚合酶与NAs结合力降低,使得NAs对变异的HBV抑制能力下降,野生株病毒因对药物敏感而被抑制,变异株对核苷(酸)类似物不敏感继续复制增殖甚至代替野生株从而导致NAs抗病毒效果不佳甚至导致耐药的产生[20]。
NAs不能完全清除体内病毒,目前用药患者数巨大且患者长期服用NAs,对NAs耐药问题在临床上越发严重,往往导致患者病情反复甚至加重[21]。本文中将病毒学突破和病毒学复发的病例统归为病毒学突破组;应答不佳和原发性无应答病例统归为应答不佳组;病毒学突破、病毒学复发、应答不佳和原发性无应答的病例统归为抗病毒效果不佳组;有病毒学应答病例归为抗病毒有效组;NA+NA为NAs联合或序贯用药[22]。
1 材料与方法
1.1 研究对象
1.1.1 纳入标准慢性乙型肝炎(chronic hepatitis B,CHB)患者诊断符合《慢性乙型肝炎防治指南(2015年版)》,即患者血清HBsAg阳性,HBeAg阳性或阴性,HBV DNA阳性;ALT持续或反复升高,或肝组织学检查有肝炎病变。未合并其它病毒性肝炎。使用核苷(酸)类似物治疗的病例(NAs治疗组)抗病毒治疗时间大于6个月;对照组慢性乙型肝炎患者未使用任何抗病毒药物进行治疗。
1.1.2 研究对象一般资料据纳入标准共选取2014年至2016年宜春市人民医院门诊或住院CHB患者共141例,病例平均年龄39.43±12.66,最大76岁,最小14岁。
NAs治疗CHB患者(以下称治疗组)107例,其中男87例、女20例,均使用一种或多种NAs进行抗病毒治疗,且未使用过其它抗病毒药物。其中,NAs治疗CHB患者效果不佳者97例(即出现病毒学无应答、应答不佳、病毒学反弹、病毒学突破的四种情况之一):单NAs治疗的共61例(单用过LAM治疗的31例,单用过ADV治疗的20例,单用过EDV治疗的15例,单用过LdT治疗的5例);曾经用过多种NAs治疗的36例(用过LAM、ADV、ETV治疗的11例;用过LAM、ADV治疗的患者14例;用过LAM、ETV治疗的10例;用过ADV、ETV治疗的1例)。NAs治疗慢性乙型肝炎患者有效者10例。
对照组慢性乙型肝炎患者34例,其中男28例、女6例;均未使用任何抗病毒药物进行治疗。
1.2 方法
1.2.1 HBV-DNA定量检测HBV-DNA荧光定量PCR检测试剂盒购自中山大学达安基因股份有限公司,用一对乙型肝炎病毒特异性引物和一条乙型肝炎病毒特异性荧光探针,配以PCR反应液、耐热DNA聚合酶(Taq酶)、核苷酸单体(dNTPs)等成分,用PCR体外扩增法定量检测乙型肝炎病毒DNA。本试剂盒的检出限度为1.0×102IU/ml,线性范围为1.0×102~1.0×108IU/ml。
1.2.2 HBV逆转录酶区耐药相关变异位点测定乙型肝炎病毒核酸检测试剂盒购自亚能基因股份有限公司,使用BIO-RAD基因扩增仪对提取的HBV-DNA进行PCR扩增,PCR扩增产物在FYY3医用核酸分子快速杂交仪上与设计的探针进行特异性杂交,杂交后洗膜、显色,根据膜条特定位置显色(蓝色)与否来判断HBV逆转录酶区相关耐药变异位点。
1.2.3 乙肝血清免疫标记物购自中山生物工程有限公司乙肝五项ELISA检测试剂盒,检测乙肝五项(HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc)。乙型肝炎病毒表面抗原(HBsAg)、乙型肝炎病毒e抗原(HBeAg)是采用ELISA双抗体夹心法检测;乙型肝炎病毒表面抗体(抗-HBs)是采用ELISA双抗原夹心一步法检测;乙型肝炎病毒e抗体(抗-HBe)和乙型肝炎病毒核心抗体(抗-HBc)是采用ELISA竞争抑制法原理检测。使用Anthos2010酶标仪测定样本和阴性、阳性和空白对照的吸光度值并判断结果。
1.3 统计学方法应用SPSS 19.0统计软件进行统计。两样本均数的比较采用t检验。两样本率的比较采用χ2检验,根据情况选择Pearson卡方检验、Yates卡方检验;两个样本率的比较选择四格表,两个样本构成比的比较选择2×C表。P<0.05为差异有统计学意义。
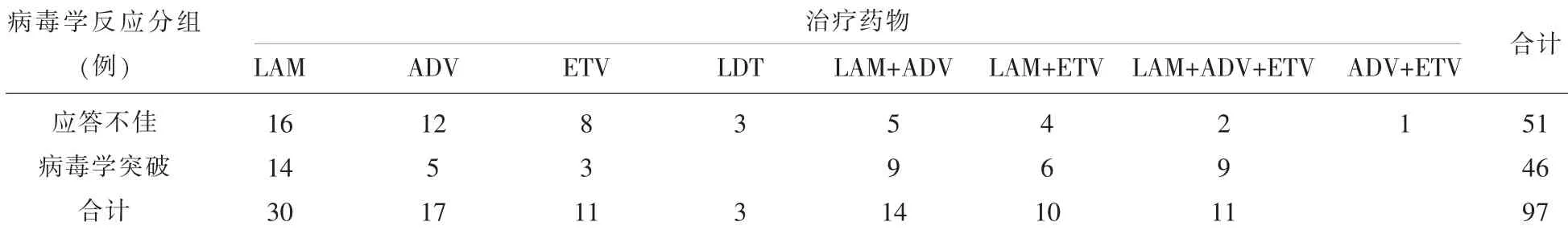
表1 97例不同NAs治疗CHB疗效不佳患者的病毒学反应
2 结果
2.1 资料情况对照组与NAs治疗组在性别、年龄比较均无显著性差异(P=0.877,P=0.093),具有可比性。
2.2 不同NAs治疗CHB效果不佳患者的病毒学反应分布情况NAs治疗CHB效果不佳的97个病例,其中51例出现对NAs应答不佳,46例出现病毒学突破,见表1。
2.3 不同NAs治疗CHB效果不佳者病毒学突破的比较
2.3.1 单LAM与单ADV治疗病例效果不佳者病毒学突破比较单LAM治疗发生病毒学突破在疗效不佳患者中占比46.67%,与单ADV治疗发生病毒学突破(在疗效不佳患者中占比29.41%)比较,无统计学差别(χ2=1.34,P>0.05),见表2。
2.3.2 单LAM与含LAM多药治疗病例效果不佳者病毒学突破比较单LAM治疗发生病毒学突破占疗效不佳患者46.67%,与LAM联合或序贯应用其它药物治疗组(占比68.57%)比较,差异无统计学意义(χ2=3.19,P>0.05),见表2。
2.3.3 单LAM与单ETV治疗病例应答不佳者病毒学突破比较单LAM治疗发生病毒学突破在疗效不佳患者中占比46.67%,与单ETV治疗发生病毒学突破(在疗效不佳患者中占比27.27%)比较,统计学无差别(χ2=1.28,P>0.05),见表2。
2.3.4 单NAs与多NAs治疗病例应答不佳者病毒学突破比较单NAs治疗发生病毒学突破在疗效不佳患者中占比36.07%,与多NAs联合或序贯应用其它药物治疗发生病毒学突破(在疗效不佳患者中占比66.67%),差异有统计学意义(χ2=12.41,P<0.01),见表2。
2.4 HBV逆转录酶区耐药相关变异检测结果
2.4.1 对照组与NA治疗效果不佳组HBV逆转录酶区耐药变异检出情况对照组(未治疗组)34个病例中检出HBV逆转录酶区耐药相关变异2例,检出率5.9%。NAs治疗效果不佳组97例中检出HBV逆转录酶区耐药相关变异80例,检出率82.5%。NAs治疗效果不佳组HBV逆转录酶区耐药相关变异检出率明显高于未治疗组(χ2=63.078,P<0.01),即明显高于自然变异,见表3。
2.4.2 NAs抗病毒治疗有效组与效果不佳组HBV逆转录酶区耐药变异检出率比较治疗组中有10个病例使用NAs抗病毒治疗有效,未检出HBV逆转录酶区耐药相关变异;97例使用NAs抗病毒治疗效果不佳,80例检出HBV逆转录酶区耐药相关变异,检出率82.5%。抗病毒效果不佳组变异检出率明显高于抗病毒有效组(χ2=32.68,P<0.01),见表3。
2.4.3 NA治疗效果不佳患者应答不佳组与病毒学突破组病例HBV逆转录酶区耐药变异检出情况治疗组97个病例中检出HBV逆转录酶区耐药相关变异80例,其中对NAs应答不佳的51个病例中36例检出耐药变异,病毒学突破46个病例中44例检出耐药变异。两组耐药变异检出率差异显著(χ2=10.51,P<0.01),见表3。
2.5 耐药相关变异位点与分布对照组两病例检出变异位点两个:rtM204V和rtN236T。治疗组80个病例检出变异位点140个:rtL180M25个、rtM204V32个、rtM204I45个、rtA181V28个、rtN236T10个。变异位点详细分布见图1。
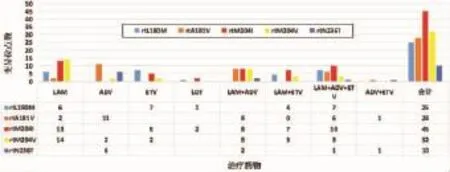
图1 耐药相关变异位点在不同NAs治疗下的分布

表2 不同NAs治疗CHB效果不佳者病毒学突破的比较

表3 不同分组耐药相关变异的比较
2.5.1 变异位点rtM204V rtM204V在单LAM治疗组占总变异位点数的40.0%,与rtM204V在其它单NAs治疗组占总变异位点数的11.1%比较有统计学意义(χ2=7.826,P=0.005);与rtM204V在含LAM其联合或序贯用药组变异位点数的20.9%比较有统计学意义(χ2=4.213,P=0.04),见表4。
2.5.2 变异位点rtM204I rtM204I占单LAM治疗组变异位点数的37.1%。与rtM204I在其它单NAs治疗组占总变异位点数的19.4%比较差异没有统计学意义(χ2=2.747,P=0.097;与rtM204I在含LAM联合或序贯用药组变异位点数的37.31%比较没有统计学意义(χ2=0.0003,P=0.987),见表5。
2.5.3 变异位点rtA181V rtA181V占单ADV治疗组变异位点数的57.9%。与rtA181V在其它单NAs治疗组占总变异位点数的4.0%比较有统计学意义(χ2=23.68,P=0.000);与rtA181在含ADV其联合或序贯用药组变异位点数的27.27%比较差异有统计学意义(χ2=5.509,P=0.025),见表6。
2.5.4 变异位点rtN236T rtN236T占单ADV治疗组变异位点数的31.58%,与rtA181V在其它单NAs治疗组变异位点数为0比较有统计学意义(χ2=14.087,P=0.002);与rtN236T在含ADV其联合或序贯用药组变异位点数的7.8%比较差异有统计学意义(χ2=5.210,P=0.023),见表7。
2.5.5 NAs单药与多药治疗CHB患者变异位点构成比较单NAs治疗组比较多NAs联合或序贯治疗组各变异位点构成比比较(χ2=2.49,P=6.646),差异无统计学意义,单药治疗和多药治疗各变异位点构成比总体没有差别,见表8。

表4 不同NAs治疗CHB疗效不佳患者HBV逆转录酶区rtM204V变异情况的比较

表5 不同NAs治疗CHB疗效不佳患者HBV逆转录酶区rtM204I变异情况的比较

表6 不同NAs治疗CHB疗效不佳患者HBV逆转录酶区rtA181V变异情况

表7 不同NAs治疗CHB疗效不佳患者HBV逆转录酶区rtN236T变异情况

表8 单药与多药治疗变异位点构成比较
2.6 主要耐药相关变异模式与分布检出11种变异位点组合模式,按检出频次由多到少排列分别为:16例rtL180M+rtM204I、12例rtM204V、9例rtM204I+rtM204V、8例rtA181V+rtM204V、7例rtM204I、7例rtA181V+rtN236T、6例rtA181V+ rtM204I、5例rtL180M、4例rtL180M+rtM204I+ rtA181V。3例rtM204V+rtM204I+rtN236T、3例rtA181V。变异模式详见图2。
2.7 NAs治疗CHB患者HBV逆转录酶区耐药变异相关因素分析
2.7.1 耐药变异与用药时长的关联性单NAs治疗检出耐药相关变异病例(单药治疗耐药变异+组)的用药时间长于未检出NAs耐药相关变异病例(单药治疗耐药变异-组)(P<0.01),提示,用药时间越长,耐药相关变异发生率越高;多药治疗检出耐药变异病例(多药治疗耐药变异+组)的用药时间长于单药治疗检出耐药变异病例(单药治疗耐药变异+组)(P<0.01),提示单药治疗比多药联合更易发生耐药变异。见表9。
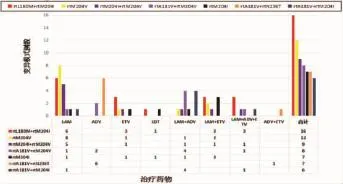
图2 主要的主要耐药相关变异模式的分布
2.7.2 耐药变异与用药方式的关联性本研究NAs治疗CHB疗效不佳患者中,单药治疗的病例耐药变异检出率为59.15%,而多药治疗病例耐药变异检出率为97.2%,两种用药方式疗效不佳的患者耐药变异病例检出率差异显著(χ2=17.157,P<0.01),见表10。
2.7.3 耐药变异与患者携带HBeAg的关联性HBeAg阴性组病例与HBeAg阳性组病例耐药变异检出率差异无统计学意义(χ2=3.233,P>0.05),见表10。
2.7.4 耐药变异与NAs治疗后病毒学反应NAs治疗CHB疗效不佳患者中,应答不佳组耐药变异检出率(70.59%)明显低于病毒学突破组(95.65%)(χ2=8.85,P<0.01),见表10。
2.7.5 耐药变异与HBV DNA水平的关联性NAs治疗组在检测耐药变异位点的同时,有81个病例检测了HBV-DNA水平,将HBV DNA划分为三个等级,分别统计每个等级区间耐药变异的检出例数并进行构成比的比较(χ2=9.455,P<0.01),差异具有统计学意义,即HBV DNA水平越高,耐药变异检出率越高,见表10。

表9 耐药变异与用药时长的关联性
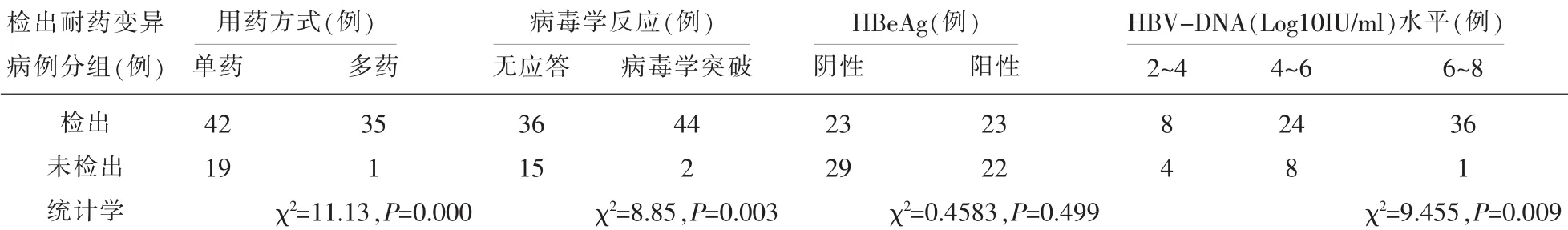
表10 各种因素下检出耐药变异的比较
3 讨论
3.1 乙肝病毒逆转录酶区的自然变异与耐药HBV是最容易变异性的病毒之一,基因变异如果发生在逆转录酶区且影响编码HBV DNA聚合酶就可以导致对核苷(酸)类似物的耐药[23]。本研究对照组未使用NAs治疗的34例中,有2例检出了耐药相关变异,检出率5.9%,2个变异位点为rtM204V和rtN236T;rtM204V是LAM耐药相关变异位点,rtN236T是ADV耐药相关位变异位点。这说明乙肝病毒自然变异可导致较高的NAs耐药,在使用NAs药物之前检测NAs药物相关变异位点可以指导临床选择NAs用药[24]。有专家提出需要实现有效的耐药管理,把耐药监测点置于用药之前也就是监测自然耐药变异。
3.2 乙肝病毒逆转录酶区主要变异位点和变异模式的分布LAM治疗病例主要的变异位点是rtM204I、rtM204V,也检出了rtL180M和rtA181V;rtM204V占LAM治疗病例的变异位点总数的40%,高于其他用药方式病例的检出率;rtM204I占LAM治疗病变异位点总数的37.1%,但与其他用药方式的检出率没有统计学差别,这两个位点都是最重要的LAM耐药相关的变异位点[25,26],本研究分析单LAM治疗组与其它单NAs治疗组、LAM+其它单NAs治疗组比较rtM204I的检出率没有差别,说明rtM204I可能是出现频率较高的交叉耐药位点;而单LAM治疗组rtM204V的检出率高于其它单NAs治疗组和LAM+其它单NAs治疗组下,说明rtM204V主要是LAM的耐药相关变异位点[27]。
ADV治疗病例主要的变异位点是rtA181V、rtN236T,两位点分别占单ADV治疗组变异位点数的57.9%、31.58%,本研究分析单ADV治疗组rtA181V、rtN236T的检出率显著高于其它单NAs治疗组和ADV+其它单NAs治疗组,说明rtA181V、rtN236T是ADV主要耐药相关位点[25,27],检出ADV耐药变异模式主要为rtA181V+rtN236T[26]。ETV治疗病例检出rtM204I、rtL180M,有报道表明要对ETV耐药,需要rtM204I+rtL180M位点变异,还需要合并rtT184G/S/A等位点同时变异[25],本研究中未检测rtT184G/S/A变异的位点,推测rtM204I、rtL180M应该是LAM与ETV耐药相关变异的交叉位点[28,29]。针对多NAs耐药变异的组合模式更为复杂,本研究中简单总结了耐药模式,多药治疗效果不佳组的主要变异模式rtL180M+ rtM204I、rtA181V+rtM204V、rtA181V+rtM204I,这与相关报道对LAM和ADV耐药检出rtL180M+ rtA181V+rtM204V变异模式有一致性[30]。
本研究中单药治疗病例与多药治疗病例在耐药变异位点的构成上没有统计学差别,可能与多药治疗组所用药物一般包含单药组用药有关;多药治疗如果是序贯治疗那么可能导致的耐药变异将包含所有用过药物的耐药相关变异位点[31],联合用药可以提高基因屏障[28],减少耐药变异的产生。另外本研究的样本量不够大、检测的变异位点有限,对单药治疗和多药治疗患者耐药相关变异位点的构成比也有一定的影响。
3.3 耐药变异的相关因素应用NAs药治疗慢性乙型肝炎时,药物的选择(如选用单药的种类、几种NAs药物联合或序贯用药的选择),用药剂量与方法,治疗时间长短,患者本身的HBV DNA水平和携带乙肝标记物情况等对乙肝病毒逆转录酶区发生耐药变异均可能产生重要影响。
本研究观察单NAs治疗检出变异组用药时间明显长于未检出变异组,说明运用NAs药物治疗CHB会对病毒产生选择性压力,治疗时间越长出现耐药变异的变异株被筛选出来的几率就越大[32,33];而单药治疗病例早于多药治疗病例检出耐药相关位点可推测单药治疗可能比多药治疗更容易导致耐药变异的产生,而多药联合可以提高基因屏障[28]。但本研究中多药物治疗耐药变异的检出率却明显高于单药治疗,看起来与基因屏障理论相矛盾,可能是因本研究中多药治疗中采用联合用药的病例少而采用序贯用药的病例多,序贯用药是在对前者药物产生耐药变异而失去抗病毒药效再改变药物种类,后种药物又可引起新的变异,前后变异叠加因而使得变异检出率反而更高。比较HBeAg阴性和阳性组耐药变异检出情况,两者没有统计学意义。而在HBV-DNA水平分等级比较耐药变异检出情况时发现,研究病例HBV-DNA水平等级越高,耐药变异检出率也越高。这与国内多位学者的研究结果一致[34,35],说明在使用NAs治疗CHB时,如果不能有效抑制病毒复制,病毒复制仍然处于较高的水平,NAs治疗反而有利于耐药变异的产生。
3.4 NAs治疗CHB效果NAs抗乙肝病毒治疗口服给药方法简单且价格经济,目前在临床广泛应用[36],但随之而来的就是对NAs耐药率的提高[37,38]。NAs抗病毒用药时间的延长,使得耐药变异增加最终导致耐药的发生[39,40]。用药方法是影响NAs治疗效果重要因素,单用LAM治疗后,往往有着很高的耐药突变率[41],且常出现与LAM耐药相关的突变位点rtM204I、rtM204V,rtL180M和rtA181V,如出rtL180M+rtM204I、rtA181V也可导致对ADV耐药[42],rtL180M也是LAM和ETV的交叉耐药位点。所以开始抗病毒治疗时就要选择合适的药物,新版防治指南建议初次使用ETV或者替诺福韦酯[22],另一方面联合用药可以提高基因屏障从而降低耐药变异的产生。再者在使用NAs抗乙肝病毒治疗时,迅速有效降低HBV-DNA水平很重要,如果短时间内药物能有效抑制病毒复制,那么依赖较高基因复制水平的变异就难以产生。本研究发现病毒学应答不佳和病毒学突破病例耐药变异检出率非常高,说明在治疗过程中,必须监测重要的耐药相关变异位点和HBV DNA水平等相关指标,一旦患者检出耐药相关变异位点且病毒学应答不佳或病毒学突破,则需要更换NAs进行挽救性治疗,如不及时进行挽救性治疗,可产生严重的后果包括肝功能失代偿、急性肝功能衰竭甚至死亡[43]。
4 结论
4.1 NAs治疗慢性乙型肝炎可导致HBV逆转录酶区变异,NAs抗乙型肝炎病毒效果不佳与HBV逆转录酶区变异密切相关,即HBV耐药变异是NAs抗病毒治疗效果不佳甚至失败的主要原因。
4.2 不同NAs药物导致慢性乙肝患者HBV逆转录酶区变异位点、变异模式特点不同:⑴LAM常见耐药相关变异位点为rtM204I、rtM204V、rtL180M,变异模式多为rtM204V、rtM204I+rtM204V、rtM204I+rtL180M。⑵ADV常见耐药相关变异位点为rtA181V、rtN236T,变异模式多为rtA181V+ rtN236T。
4.3 NAs治疗CHB用药种类与方式,治疗时长,患者HBV-DNA水平等对HBV逆转录酶区发生耐药变异均可能产生重要影响。一般单药治疗出现耐药变异早于多药治疗;治疗时间越长出现耐药变异的变异株被筛选出来的几率越大;患者HBVDNA水平等级越高,耐药变异检出率越高。
4.4 本研究的临床建议在使用NAs抗乙肝病毒治疗前,应检测常见的耐药相关变异位点,从而选择正确的药物,尽量减少耐药变异的产生,保护敏感的变异位点。在治疗中,选择合适的时间点监测重要的变异位点和HBV-DNA水平,特别是开始治疗后的早期评价病毒学反应,看药物的治疗效果,如果出现耐药变异或者早期治疗病毒学应答不佳应及时调整挽救性用药方案,避免病情的反复和恶化。长期使用NAs应该坚持监测变异位点和HBV-DNA水平[33]。总之耐药变异位点的检测和用药期间的监测,可以指导临床选择和调整NAs药物[34,35],具有非常重要的临床价值。
[1]Ott JJ,Stevens GA,Groeger J,et al.Global epidemiology of hepatitis B virus infection:new estimates of age-speci?c HBsAg seroprevalence and endemicity[J].Vaccine,2012,30(12):2212-2219.
[2]Lozano R,Naghavi M,Foreman K,et al.Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the Global Burden of Disease Study 2010 [J].Lancet,2012,380(9859):2095-2128.
[3]Hou J,Liu Z,Gu F.Epidemioiogy and Prevention of HepatitisB Virus Infection[J].Int J Med Sci,2005,2(1):50-57.
[4]Goldstein ST,Zhou F,Hadler SC,et al.A mathematical model to estimate global hepatitis B disease burden and vaccination impact [J].Int J Epidemiol,2005,34(6):1329-1339.
[5]Wang FS,Fan JG,Zhang Z,et al.The global burden of liver disease:The major impact of China[J].Hepatology,2014,60(6):2099-2108.
[6]Hang X,Bi S,Yang W,et al.Epidemiological serosurvey of Hepatitis B in China-declining HBV prevalence due to Hepatitis B vaccination[J].Vaccine,2009,27(47):6550-6557.
[7]Fung J,Seto W-K,Lai C-L,et al.Profiles of HBV DNA in a large population of Chinese patients with chronic hepatitis B:Implications for antiviral therapy[J].J Hepatol,2011,54(2):195-200.
[8]Liang X,Bi S,Yang W,et al.Epidemiological serosurvey of hepatitis B in China-declining HBV prevalence due to hepatitis B vaccination[J].Vaccine,2009,27(47):6550-6557.
[9]Liang X,Bi S,Yang W,et al.Evaluation of the impact of hepatitis B vaccination among children born during 1992-2005 in China[J]. J Infect Dis,2009,200(1):39-47.
[10]Lu FM,Zhang H.Management of hepatitis B in China[J].Chin Med J(Ensl),2009,122(1):3-4.
[11]乙型肝炎病毒耐药专家委员会.乙型肝炎病毒耐药专家共识:2009年更新[J].中华实验和临床感染病杂志(电子版),2009,3(1):69-79.
[12]杜冠华.病毒与抗病毒药物[J].食品与药品,2006,2006(3B):32-32.
[13]Fung J,Lai CL,Seto WK,et al.Nucleoside/nucleotide analogues in the treatment of chronic hepatitis B[J].J Antimicrobial Chemotherapy,2011,66(12):2715-2725.
[14]Chang TT,Gish RG,de Man R,et al.A comparison of entecavir and lamivudine for HBeAg-positive chronic hepatitis B[J].N Eng J Med,2006,354(10):1001-1010.
[15]Lai CL,Shouval D,Lok As,et al.Entecavir versus lamivudine for patients with HBeAg-negative chronic hepatitis B[J].N Engl J Med,2006,354(10):10l1-1020.
[16]Marcellin P,Chang TT,Lim SG,et al.Adefovir dipivoxil for the Treatment of hepatitis B e antigen-positive chronic hepatitis B[J].N Engl J Med,2003,348(9):808-816.
[17]Lai CL,Gane E,Liaw Y,et al.Telbivudine versus lamivudine in patients with chronic hepatitis B[J].N Engl J Med,2007,357(25):2576-2588.
[18]Marcellin P,Heathcote EJ,Buti M,et al.Tenofovir disoproxil fumarate versus adefovir dipivoxil for chronic hepatitis B[J].N Engl J Med,2008,359(23):2442-2455.
[19]Lau GK,Piratvisuth T,Luo KX,et al.Peginterferon A1fa-2b,lamivudine,and the combination for HBeAg-positive chronic hepatatis B[J].N Engl J Med,2005,352(26):2682-2695.
[20]Fung J,Seto WK,Lai CL,et al.Extrahepatic effects of nucleoside and nucleotide analogues in chronic hepatitis B treatment[J].J Gastroenterol Hepatol,2014,29(3):428-434.
[21]张玲,吴昊鹤.核苷类似物耐药后乙型肝炎治疗的研究进展[J].临床医学,2011,31(1):104-105.
[22]中华医学会肝病学分会.慢性乙型肝炎防治指南(2015年更新版)[J].中华传染病杂志,2015,33(11):219-240.
[23]娄红梅,钟细涛,李志国,等.乙型肝炎病毒基因自然变异耐药性的研究[J].中华肝脏病杂志,2011,19(11):868-869.
[24]娄红梅,刘洪海.乙型肝炎病毒基因自然变异耐药性与HBV DNA、HBeAg、ALT及AST相关因素分析[J].广东医学,2012,33 (9):1279-1281.
[25]古丽娣,张丹,曾惠玲,等.核苷(酸)类似物治疗引起乙肝病毒耐药相关基因位点突变的总结分析[J].现代检验医学杂志,2013,28(1):122-123.
[26]金怡,魏飞力,马丽娜,等.PCR产物直接测序法检测乙肝病毒耐药位点的临床研究[J].北京医学,2011,33(12):961-965.
[27]薛彩花,吴玮,安俊丽,等.987例乙型肝炎患者HBV-DNA P区多位点耐药突变分析及临床意义[J].胃肠病学和肝病学杂志,2014,23(10):1187-1190.
[28]王洁,金生.乙型肝炎病毒耐药变异及其检测研究进展[J].现代医药卫生,2014(24):3711-3713.
[29]曹灵芝,樊正勤,赵耘.慢性乙型肝炎患者基因耐药变异特征分析[J].中国实用医药,2016,11(14):53-55.
[30]郑金梅.HBV核苷(酸)类似物多药耐药的检测和分析[D].太原:山西医科大学,2013.
[31]郝建宏,胡忆玲,林爱清.慢性乙型肝炎患者HBV基因耐药突变分析[J].实用肝脏病杂志,2016,19(4):473-475.
[32]荣海燕,张朝霞.乙型肝炎病毒耐药突变与HBV-DNA量和HBeAg之间的相关性研究[J].实用医学杂志,2013,29(3):404-406.
[33]杨璞叶,刘山红,冯彪.阿德福韦酯联合拉米夫定治疗拉米夫定耐药患者疗效观察[J].医学争鸣,2008,29(2):155-157.
[34]李金明,谢南,熊德琴,等.基因芯片法检测乙肝病毒多位点变异的临床应用[J].实验与检验医学,2009,27(6):615-616.
[35]许瑞元,王尔莉,曹霜,等.乙型肝炎病毒耐药突变基因检测在临床中的应用[J].实验与检验医学,2014,32(2):179-180.
[36]廖艳霞,杨光.乙型肝炎病毒基因耐药变异的研究现状[J].广东医学,2011,32(16):2214-2216.
[37]张小曼,肖子鸿,张纯瑜,等.核苷(酸)类药物引起HBV基因突变的危险因素与模式分析[J].中华实验和临床感染病杂志(电子版),2015,9(5):92-96.
[38]赵建强,刘加法.山东省潍坊市慢性乙型肝炎患者HBV P区基因耐药突变检测及相关因素分析[J].病毒学报,2015(1):14-17.
[39]赵帅.LAM和ETV联合治疗慢性乙肝患者对乙肝病毒耐药基因多位点变异研究[D].石家庄:河北医科大学,2015.
[40]Chen CH,Lin CL,Hu TH,et al.Entecavir vs.lamivudine in chronichepatitis B patients with severe acute exacerbation and hepatic decompensation[J].J Hepatol,2014,60(6):1127-1134.
[41]Lampertico P,Vigano M,Manenti E,et al.Low resistance to adefovir combined with lamivudine:a 3-year study of 145 lamivudine-resistant hepatitis B patients[J].Gastroenterology,2007,133:1445-1451.
[42]Yao GB,Zhu M,Cui ZY,et al.A 7-year study of lamivudine therapy for hepatitis B virus e antigen-positive chronic hepatitis B patients in China[J].J Dig Dis,2009,10:131-137.
[43]Sun J,Hou JL,Xie Q,et al.Randomised clinical trial:efficacy of Peginterferon alfa-2a in HBeAg positive chronic hepatitis Bpatients with lamivudine resistance[J].Aliment Pharmacol Ther,2011,34(4):424-431.
Study on the Variation of HBV Reverse Transcriptase Gene Region in Patients with Chronic Hepatitis B Treated with Nucleoside Analogues
LI Jian1,2,ZENG Wenxing2,FANG Yinghui2,ZENG Xiaoping1.1.Department of Immunology,Basic Medical College of Nanchang University,Nanchang 330006,China;2.Clinical laboratory,The People's Hospital of Yichun City,Yichun Jiangxi 336000,China.
Objective To analyze the drug-resistant related mutation loci in HBV reverse transcriptase region,the combination mode of the mutation loci,the levels of HBV DNA and hepatitis Be antigen(HBeAg)in chronic HBV infected patients treated with NAs provides references for the anti-HBV therapy of NAs.Methods One hundred and forty-one patients with chronic HBV infection were selected in the study,of which the 107 cases with NAs treatment were set as the treatment group,and the rest 34 patients receiving no antiviral treatment were set as the control group.Drug-resistant related mutation loci in HBV reverse transcriptase region was determined by the reverse linear probe hybridization PCR(PCR-RLP).The level of HBV DNA was detected by real-time fluorescence quantitative PCR.And immune markers of HBV were examined by Enzyme-linked immunosorbent assay (ELISA).Finally,the characteristics of drug resistance-related mutations and the clinical data of the study cases were analyzed statistically.Results The detection rate of drug-resistant related mutation loci in the poor effective treatment group(82.5%)was significantly higher than that in the untreated control group(5.9%)and the effective group(0%)(P<0.01).There were 97 cases
NAs showing the poor antiviral effect in the treatment group,of which 80 ones possessed 140 drug-resistant mutation loci. The major mutation sites included 45 rtM204I,32 rtM204V,10 rtN236T,25 rtL180M and 28 rtA181V.Main combination modes of the mutation loci were rtL180M+rtM204I,rtM204V,rtM204I+rtM204V,rtA181V+rtM204V,rtM204I and rtA181V+rtN236T,etc. Mutation detection rate in the 51 cases with poor NAs response was 70.59%,with 95.65%in the 46 virological breakthrough cases (P<0.01).Mutation in those who received monotherapy was usually detected much earlier than that in multi-drug treated ones(P<0. 01).The longer treatment time of NAs,the higher rate of drug-resistance mutation sites were detected(P<0.01).The higher level ofHBV-DNA,the higher the detection rate of drug-resistance was detected(P<0.01).Conclusions 1.NAs treatment of chronic hepatitis B can lead to mutations in HBV reverse transcriptase region,and NAs anti-hepatitis B virus ineffective is closely related to mutations in HBV reverse transcriptase region.2.Different NAs drugs result in different characteristics of mutation loci and combination modes of the mutation loci in HBV reverse transcriptase region of chronic hepatitis B patients.3.Selection of NAs,treatment time,the level of HBV-DNA in patients may all have an important impact to drug-resistance related mutations in HBV reverse transcriptase region.It is suggested that NAs drug resistance-related mutations and level of HBV-DNA in patients should be detected before treatment or be monitored during treatment,which can provide important references for clinical antiviral therapy of chronic hepatitis B.
∶Nucleoside analogues;Chronic hepatitis B;Drug resistance;Gene mutation in HBV reverse transcriptase region;Gene mutation
R512.6+2,R446.62
A
1674-1129(2017)04-0466-09
10.3969/j.issn.1674-1129.2017.04.005
2017-03-16;
2017-05-30)
李健,1983年生,学士学位,主管检验师;南昌大学基础医学院免疫学教研室同等学历申请硕士学位研究生;研究方向:乙肝病毒基因耐药变异。
曾小平,1973年生,南昌大学基础医学院免疫学教研室副教授、硕士生导师。

