小鼠诺如病毒巢式PCR 检测方法的建立及应用
赵 娜,王丽媛,赵歆伊,曹福源,陈 松,张艳淑,姚 林,李 爽
(1.华北理工大学实验动物中心,河北 唐山063210;2.华北理工大学公共卫生学院,河北 唐山 063210;3.华北理工大学基础医学院,河北 唐山 063210)
小鼠诺如病毒(Murine norovirus,MNV)是一种引起免疫缺陷小鼠脑炎、脑膜炎、肝炎、肠和肺炎的与人类诺如病毒密切相关的传染性病原[1]。该病毒于2003 年从转导蛋白和转录激活因子1(STAT1)以及重组体激活基因2(RAG2)缺陷(RAG2-/-/STAT1-/-)小鼠中被首次发现[2],之后美国、加拿大、日本、韩国等国的实验小鼠体内均监测到该病毒[3-5],并发现MNV 是感染实验动物的重要病原体,几乎所有的实验小鼠对此病毒易感。目前MNV的诊断方法主要为分子生物学和血清学方法。RT-PCR 已广泛应用于诺如病毒的检测,成为诺如病毒诊断的金标准,但由于杯状病毒科基因组高度变异性,其敏感性及特异性受到一定影响。为了设计一种高敏感性和特异性的检测方法,突破目前MNV 检测局限,本研究通过代表性毒株序列比对,选取MNV 的保守区序列,建立MNV 巢式PCR 检测方法,为MNV 感染的分子生物学诊断提供了一种快速、敏感的检测方法。
1 材料与方法
1.1 病毒 感染小鼠诺如病毒、呼肠孤病毒III 型(Reovirus type III)、小鼠轮状病毒(Mouse rotavirus)、小鼠细小病毒(Minute virus of mice)、小鼠微小病毒(Mouse parvovirus),小鼠腺病毒(Mouse adenovirus)病料,均由华北理工大学实验动物中心实验室检测并保存。
1.2 主要试剂 ExTaqDNA 聚合酶、反转录酶(M-MLV)、Olig dT,购自宝生物工程(大连)有限公司;TRIZol Reagent RNA 提取试剂盒,购自Invitrogen公司;DNA Marker、凝胶回收试剂盒,购自北京康为世纪生物科技有限公司。
1.3 引物的设计与合成 根据已发表的MNV 基因组序列(KF113527、EF014462、HQ317203、EU004670、DQ223041、DQ223042、JX048594),选取MNV 保守区序列设计引物,利用Oligo 6.0 生物学软件设计合成了2 对引物,由北京诺赛生物工程有限公司合成。第1 轮扩增引物P1:5′-GAGGATGAGTGATGGCGC-3′(5058~5075 bp);P2:5′-TTGAGGGAAGGGATGGGT-3′(5836~5819 bp);第2 轮扩增引物P3:5′-GGTGGTTGTTGCCCTTGT-3′(5418~5435 bp);P4:5′-GGCTGTTTGTGCGGAGTG-3′(5635~5618 bp)。
1.4 病毒RNA 提取和cDNA 合成 按TRIZol Reagents 试剂盒操作说明书提取病毒总RNA,然后进行反转录。反转录体系20 μL,总RNA 2 μL,5×Reverse transcriptase Buffer 4 μL,dNTP(2.5 mmol/L)8 μL。RNA 抑制剂0.5 μL,随机引物(9 mer)50 pmol,M-MLV 1 μL,DEPC 水补足20 μL。反转录反应条件为30 ℃10 min,42 ℃1 h,99 ℃5 min,4 ℃10 min,即合成cDNA 第一链。
1.5 巢式PCR 反应的建立 巢式PCR 需进行2 次PCR 反应。PCR 反应体系为50 μL,包括10×ExTaqBuffer 5 μL,dNTP(2.5 mmol/L)4 μL,上游引物和下游引物(100 pmol/μL)各1 μL,ExTaq酶5 μL,病毒cDNA 第一链1 μL,ddH2O 补足50 μL。第1 次PCR 反应所用引物为MNV P1 和MNV P2,扩增程序如下:98 ℃预变性5 min,94 ℃变性45 s,46 ℃退火45 s,72 ℃延伸70 s,30 个循环,再72 ℃延伸10 min,4 ℃终止反应。巢式PCR 使用引物MNV P3 和Flay P4,扩增程序为:98 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,30个循环,再72 ℃延伸10 min,4 ℃终止反应。2 次PCR 后进行浓度为1%的琼脂糖凝胶电泳,结果在紫外光下进行分析。
1.6 序列分析 回收扩增产物,送测序公司进行测序。利用Clustal W 和Mega 6.0,将测序序列与诺如病毒代表毒株序列进行核苷酸同源性分析,验证产物的特异性。
1.7 巢式PCR 敏感性试验 使用分光光度计测量MNV 核酸浓度,并换算成拷贝数。用蒸馏水10 倍稀释核酸至1×100个拷贝/μL,从1×107个拷贝/μL 开始每个稀释度取1 μL 为模板,分别采用巢式PCR 和普通PCR 进行检测。
1.8 巢式PCR 特异性试验 分别提取阳性病料中呼肠孤病毒III 型、小鼠轮状病毒的RNA 和小鼠细小病毒、小鼠腺病毒的DNA,用1.5 中建立的巢式PCR体系进行扩增,以检验体系的特异性。
1.9 巢式PCR 对临床样品的检测 采集野生小鼠的盲肠及其内容物加入10 倍PBS(pH 值7.2)进行研磨制成匀浆,冻融3 次,8 000 r/min 离心10 min,取上清按TRIZol Reagents(Invitrogen)试剂盒操作说明书提取病毒总RNA,反转录后用已建立的巢式PCR 进行检测。
2 结果与分析
2.1 扩增产物的检测及鉴定 扩增产物的检测PCR 扩增产物经过10 g/L 琼脂糖凝胶电泳,第1轮扩增产物在779 bp、第2 轮扩增产物在218 bp处可见特异性DNA 扩增条带(图1),与预期大小相符。
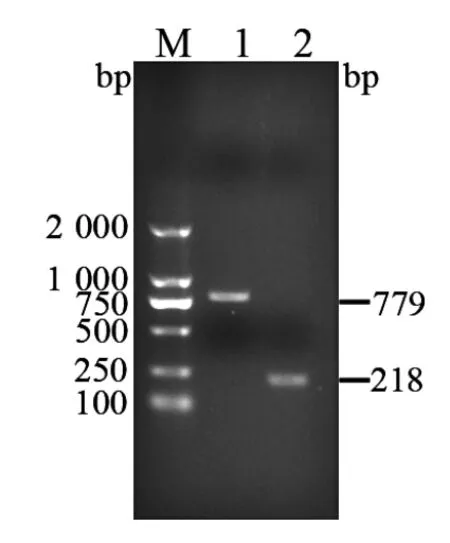
图1 巢式PCR 扩增结果
2.2 序列分析 将以MNV P3 和P4 为引物的PCR产物进行测序,结果表明6 个样品序列均为小鼠诺如病毒基因序列。将MNV 基因测序序列与Gen-Bank 公布的其他MNV 代表株相同位置基因进行序列比结果显示,与毒株BJ 10-2062(KM458057)相似性最高,同源性为98.8%。
2.3 巢式PCR 的敏感性 巢式PCR 的检测极限为500 个拷贝/μL,而传统PCR 的有效扩增最小量为5×105个拷贝/μL。巢式PCR 的敏感性为普通PCR的1 000 倍(图2)。
2.4 巢式PCR 的特异性 应用建立的巢式PCR 反应体系对MNV 和其他对照病原在相同条件下进行扩增以检验体系的特异性。结果显示,MNV 巢式PCR 扩增片段大小为779 bp 和218 bp,与预计相符,而其他对照病原均没有条带出现(图3)。

图2 巢式PCR 敏感性检测

图3 巢式PCR 特异性检测
2.5 巢式PCR 对临床样品的检测 提取30 份样品的核酸,用建立的巢式PCR 体系进行检测,其中17 份为阳性。阳性产物经测序后均为MNV 病毒片断序列,阳性率为56.67%。
3 讨论
自2003 年首次分离到小鼠诺如病毒以来,学者发现MNV 具有多种亚型,且核酸与人诺如病毒同样具有高度变异性。应用分子生物学技术对其进行检测,引物的广谱性对于检测的敏感、特异性非常关键[6]。基于小鼠诺如病毒与人类诺如病毒序列的分析,引物设计位点大多为具有一定保守性的非结构蛋白编码序列作为检测目的片段。随着MNV 全基因组序列的测定和分析,发现在MNV的5′端和ORF1-ORF2 连接位置分别存在32 bp和64 bp 的保守序列。之后,在ORF4 和3′非编码区也同样发现存在47 bp 和83 bp 的保守序列区,这些保守序列为PCR 诊断方法的建立奠定基础[7]。本试验所用设计的引物均是针对这一区域进行扩增,所采用的引物经前人研究验证对不同亚型的MNV 均具有较为理想的检出率。试验建立巢式PCR 方法相对于传统的方法灵敏度更高,特异性好,操作简单,而且该方法能检测出病毒载量很低或处于潜伏期的病毒。小鼠诺如病毒巢式PCR 方法的建立有助于发现和隔离病毒携带动物,为进一步研制MNV 巢式PCR 检测试剂盒奠定基础。
流行病学调查表明,MNV 在世界范围内广泛传播。2011 年有学者对欧洲实验小鼠MNV 感染情况进行检测,发现MNV 感染率高达58%~64%[8]。2012 年,日本报道野生啮齿类动物中MNV 感染率为14.9%,感染动物中85.4% 为姬鼠,其余为黑鼠[9]。在我国,袁文等于2010 年首次报道广东省实验小鼠携带有MNV,用RT-PCR 的方法检测206份小鼠盲肠内容物,其中MNV 阳性为77 份,阳性率37.38%。各品系小鼠易感性无显著差异[10]。本试验对30 份屏障环境内的小鼠样品进行检测,发现阳性率56.67%,该结果高于袁文等于2010 年报道的广东省实验小鼠MNV 37.38%阳性率,这与巢式PCR 敏感性高于常规RT-PCR 方法有关。目前我国对MNV 的流行病学调查研究较少,亟需进一步了解我国实验小鼠MNV 感染情况,加强病毒分子流行病学研究,为该病毒在实验动物饲养管理的防控及分子流行病学研究提供理论基础和依据。

