肿瘤抑制基因NDRG2调节结肠癌细胞糖酵解抑制结肠癌细胞增殖的研究
施景龙 林显敢 蓝球生 许鹤洋*
肿瘤抑制基因NDRG2调节结肠癌细胞糖酵解抑制结肠癌细胞增殖的研究
施景龙1林显敢2蓝球生3许鹤洋*3
目的探讨肿瘤抑制因子N⁃myc下游调节基因2(NDRG2)于结肠癌细胞葡萄糖代谢调节,并通过调控糖酵解抑制结肠癌细胞增殖的作用。方法稳定转染NDRG2于结肠癌细胞HCT116,乳酸检测试剂盒检测细胞(1×106)乳酸代谢的水平;葡萄糖试剂盒检测通过细胞(1× 106)消耗培养基葡萄糖的水平;Western blot检测HCT116细胞(1×106)糖酵解中丙酮酸激酶(PKM)、乳酸脱氢酶(LDHA)、己糖激酶(HK)表达水平,划痕实验检测肿瘤细胞增殖能力。结果转染NDRG2后,HCT116细胞生成乳酸量少于对照组38.2±3.4mmol/mL比62.1±4.8mmol/ mL,P<0.05),培养基剩余葡萄糖量则多于对照组(137±3.6 mmol/mL比88.2±2.2 mmol/mL,P<0.05)。Western blot检测NDRG2转染的HCT116细胞显示PKM、LDHA、HK表达显著低于对照组HCT116细胞。划痕实验证实,抑制结肠癌细胞糖酵解后能够抑制其增殖作用。结论NDRG2作为肿瘤抑制基因,通过抑制糖酵解关键酶生成,抑制肿瘤细胞糖酵解,进而抑制肿瘤细胞增殖。
NDRG2;糖酵解;结肠癌
肿瘤细胞增殖依赖于大量生物原料,新的研究显示肿瘤代谢异常是其新的特征之一[1]。研究发现肿瘤细胞能大量摄入葡萄糖,并通过糖酵解而非氧化磷酸化的方式肿瘤发展过程中多种信号通路相应激活,抑癌基因抑制,诱导葡萄糖转入糖酵解状态,以产生多种生物原料以供细胞有丝分裂[2]。NDRG2是已知的具有抑制肿瘤细胞生长、增殖、侵袭的肿瘤抑制基因[3],但对于其抑癌机制,尤其是对肿瘤代谢调控作用方面仍不清楚,本研究主要检测NDRG2在结肠癌细胞对糖代谢的调控及其对肿瘤细胞增殖性影响。
1 材料与方法
1.1 材料
已转染NDRG2于结肠癌细胞株HCT116,并中山大学孙逸仙纪念医院医研中心保种。胎牛血清、1640、胰蛋白酶购自Gibco公司,葡萄糖及乳酸检测试剂盒购自Sigma公司,丙酮酸激酶PKM2、乳酸脱氢酶LDHA、己糖激酶HK引物购自深圳华大公司,PCR试剂盒购自Takara公司。
1.2 细胞培养
复苏的HCT116细胞置于10%胎牛血清1640培养基中培养,置于37℃、5%CO2培养箱中。待细胞至80%融合,用胰蛋白酶消化并传代。
1.3 检测培养液葡萄糖浓度
将细胞种于六孔板(2×105个),含血清培养基培养6小时后弃上清,加入DMEM,24小时后收集培养液,依据检测试剂盒方法检测培养液中葡萄糖浓度,加入终止液2mL,混匀后使用分光光度计测吸光度值。
1.4 检测细胞培养液乳酸浓度
收集细胞培养液20mL,加入酶工作液1mL,加入显色剂0.2mL,混匀后于37℃培养箱反应10 min,加入终止液2mL,混匀后使用分光光度计测吸光度值。
1.5 Western blot法
使用Ripa裂解细胞,提取细胞总蛋白,定量。取蛋白样品,加入缓冲液,98℃水浴5 min后上样。SDS⁃PAGE电泳分离蛋白,将蛋白转至片聚乙烯PVDF膜,随后将膜置于5%脱脂奶粉的TBST溶液中封闭1 h,加入一抗,4℃过夜,次日加入二抗室温孵育1 h,通过ECL发光液检测蛋白条带。
1.6 细胞划痕实验
6孔板中加入5×105个,培养过夜贴闭并保证融合率100%,隔天使用枪头垂直划痕,PBS洗细胞3次,加入无血清培养基并放入培养箱中,分别于24 h和48 h后取出拍照。
1.7 统计学方法
结果均采用均数±标准差(x±s)表示,应用SPSS 15.0统计软件分析,采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
转染NDRG2入HCT116后,检测培养基乳酸发现NDRG2组明显低于转染空质粒即对照组。检测所得NDRG2细胞培养液乳酸浓度38.2±3.4 mmol/mL,对照组培养液乳酸浓度为62.1±4.8 mmol/mL。提示NDRG2组肿瘤细胞糖酵解较少(图1)。转染NDRG2入HCT116后,检测培养基中剩余葡萄糖高于对照组。检测所得NDRG2细胞培养液中葡萄糖浓度为137±3.6mmol/mL,而对照组培养基葡萄糖88.2±2.2 mmol/mL,提示NDRG2组消耗葡萄糖少于对照组(图2)。

图1 NDRG2组培养基剩余葡萄糖高于对照组,**P<0.05
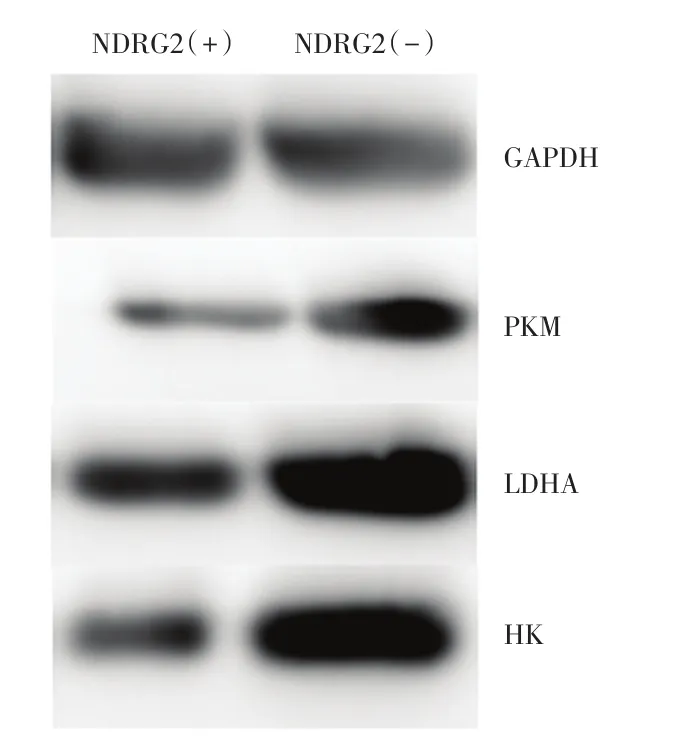
图2 NDRG2组培养基剩余葡萄糖高于对照组,**P<0.05
Western blot检测细胞中糖酵解关键酶表达,结果发现PKM、LDHA、HK均在NDRG2组存在不同程度下降。提示NDRG2有一定的抑制糖酵解的作用,也与上述的结果相对应(图3)。
通过特异性si⁃RNA,抑制上述糖酵解关键酶表达,划痕实验检测结果发现肿瘤细胞增殖性降低(图4)。
3 讨论
肿瘤细胞改变自身代谢以满足自身无止境增殖的状态,已成为肿瘤新的特征之一[1]。然而对于转变代谢状态的分子学机制仍不清楚。本研究我们发现NDRG2作为抑癌基因,参与了肿瘤细胞代谢调控,能够抑制葡萄糖酵解,并进一步抑制细胞增殖。
NDRG2广泛表达于全身组织细胞,但是有研究发现在结肠癌细胞中表达降低,随后进一步研究证明其为抑癌基因,具有抑制肿瘤细胞增殖和转移作用[4]。然而对于NDRG2的代谢学仍没有完全了解,本实验创新性将其与代谢方面结合起来,从代谢的角度发现NDRG2在结肠癌HCT116细胞中通过抑制糖酵解关键酶表达,抑制糖酵解酵解。从肿瘤学角度看,该过程有利于抑制肿瘤细胞增殖,因为肿瘤细胞依赖于糖代谢过程提供增殖所需生物原料[5]。而实验研究也证实,抑制糖酵解酶表达后结肠癌细胞增殖性也受到抑制。
相比于正常细胞,肿瘤细胞代谢更迅速和旺盛,需要更多能量和原料以快速增殖,并且葡萄糖主要通过酵解进行代谢(Warburg效应)[6,7]。因此通过FDG⁃PET/CT检测葡萄糖代谢水平,能够评估患者肿瘤是否出现转移[8],证实肿瘤细胞活跃的糖酵解及糖摄入。已有研究发现,糖酵解相关分子和关键酶能够促进糖酵解代谢,促进肿瘤细胞生长及侵袭,影响患者预后[9,10]。
本研究表明NDRG2于结肠癌细胞具有代谢调节,抑制糖酵解的作用,并通过抑制糖酵解抑制结肠癌细胞增殖。实验结果对于临床上结肠癌治疗和预防提供新的思路。
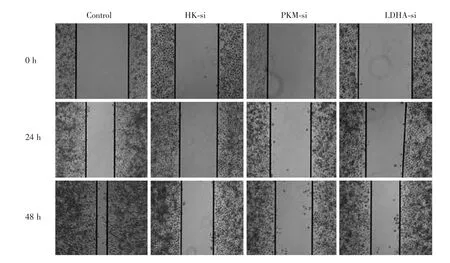
图4 划痕实验示抑制糖酵解蛋白酶后细胞增殖性降低
[1]Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[2]Courtnay R,Ngo DC,Malik N,et al.Cancermetabolism and the warburg effect:The role of hif⁃1 and pi3k[J].Molecular biology reports,2015,42(4):841-851.
[3]吴国强,李开宗,窦科峰,等.稳定转染NDRG2基因对人肝癌细胞HepG2的作用[J].中华实验外科杂志,2011,28(12):2127-2130.
[4]Xinyuan Xu,Jianying Li,Xiang Sun,et al.Tumor suppressor NDRG2 inhibits glycolysis and glutaminolysis in colorectal cancer cells by repressing c⁃Myc expression[J].Oncotarget,2015,6(28):26161-26176.
[5]Kim SY.Cancermetabolism:Strategic diversion from targeting cancer drivers to targeting cancer suppliers[J].Biomol Ther,2015,23(2):99-109.
[6]OstroukhovaM,Goplen N,Karim MZ,etal.The roleof low⁃level lactate production in airway inflammation in asthma[J].Am J Physiol LungCellMolPhysiol,2012,302(3):L300-L307.
[7]Gatenby RA,Gillies RJ.Why do cancers have high aerobic glycolysis[J]?NatRev Cancer,2004,4(11):891-899.
[8]Ru P,Williams TM,Chakravarti A,Guo D.Tumormetabolism of malignant gliomas[J].Cancers(Basel),2013,5(4):1469-1484.
[9]Wellberg EA,Johnson S,Finlay⁃Schultz J,et al.The glucose transporter GLUT1 is required for ErbB2⁃induced mammary tumorigenesis[J].BreastCancer Res,2016,18(1):131.
[10]Gao D,Vahdat LT,Wong S,et al.Microenvironmental regulation of epithelial mesenchymal transitions in cancer[J]. Cancer Res,2012,72(19):4883-4889.
Research in the function of NDRG 2 in inhibiting colon cancer cells proliferation through regulat⁃ing glycolysis
SHIJinglong1,LIN Xiangan2,Lan Qiusheng3,Xu Heyang3.
1Department ofGeneral Sur⁃gery,the First People’s Hospital ofNansha District,Guangzhou,511440,China;2DepartmentofOncolo⁃gy;3Department of Gastrointestinal Surgery,Sun Yat⁃sen Memorial Hospital,Sun Yat⁃sen University,Guangzhou 510120,China.Corresponding author:XUHeyang,xuheyang2012@126.com
Objective To investigate whether tumor suppressor N⁃Myc downstream regulated gene 2(NDRG2)participates in regulating glucosemetabolism in colon tumor cells.M ethods NDRG2 was stably transfected in colon cancer cells HCT116.Lactate production wasmeasured by lactate assay kits,and glucose consumption wasmeasured by glucose assay kit.Besides,western blot was used to examine the expression of PKM、LDHA、HK,as the key glycolytic enzymes.Scratch testwas used to test tumor cells proliferation.Results HCT116 which transfected with NDRG2 produced less lactate compared with control(38.2±3.4mmol/mL vs 62.1±4.8 mmol/mL,P<0.05),and remaining glucose was more than the control(137±3.6 mmol/mL vs 88.2±2.2 mmol/m l,P<0.05).Western blot showed the expression of PKM、LDHA、HK were less than that in control.Scratch test showed less proliferation of colon tumor cellswhen above protein were inhibited.Conclusion NDRG2 functions to inhibitsglycolysis of colon cancer cells as tumor suppressor gene by repressing the glycolytic enzymes expression,and then inhibits tumor cellsproliferation.
NDRG2;glycolysis;colon cancer
R735.3+5
A
10.3969/j.issn.1009⁃976X.2017.04.007
2017-05-29)
广州市南沙区科技计划项目(2016MS009);广东省科技计对外科技合作项目(2013B051000025,2015A050502021)
1511440广州广州市南沙区第一人民医院普外科;510120广州中山大学孙逸仙纪念医院2肿瘤科;3胃肠外科
*通信作者:许鹤洋,Email:xuheyang2012@126.com

