骨折风险评估工具(FRAX®)在评价绝经后女性骨密度的临床意义
蔡舒婷 孙雯 刘红*
1.海南医学院第一附属医院内分泌科,海南 海口 570102 2.广西医科大学第一附属医院老年病学内分泌代谢科,广西 南宁 530021
中国目前40岁以上的骨质疏松症(osteoporosis, OP)患者已有1.12亿[1],其中女性发病尤其突出。但人民群众甚至包括部分医护人员对骨质疏松尚缺乏充足认识[2,3],加之国内医疗条件的不均衡发展,仍有大量骨质疏松性骨折(osteoporotic fracture, OF)患者未能得到及时的诊治。因此,如何做到简便、有效地筛查高危人群,早期诊断、及时预测骨折风险并进行相应干预显得极为关键。
双能X线吸收法(dual energy X-ray absorptiometry, DXA)骨密度测定由于设备价格昂贵、资源有限,且存在一定放射性损伤的潜在危害,目前仍未能在我国各级医院中作为普查项目开展。同时有研究表明,部分骨密度(bone mineral density, BMD)未达到诊断骨质疏松标准的人群仍然发生了骨质疏松性骨折[4],说明单纯依靠BMD无法有效防止OF的发生。
WHO于2008年发布并推荐了一种应用临床危险因子综合评估个体发生OF绝对风险的计算机软件系统——骨折风险评估工具(Fracture Risk Assessment Tool, FRAX®)。该系统操作简便,目前已被美国、英国、瑞士、日本等国家广泛运用于骨折风险的评估和骨质疏松的防治[5-8]。一些文献也建议将FRAX®作为一项基本的初筛工具[9],而国内对应用FRAX®筛查骨质疏松高危人群的研究鲜有报道。本研究旨在探讨FRAX®中国模式在评价绝经后女性骨密度变化中的作用,评估其在BMD未知的情况下对绝经后女性骨质疏松高危人群的识别能力,为FRAX®在我国进一步的应用和推广提供理论依据。
1 材料和方法
选取2014年12月至2015年12月于广西医科大学第一附属医院门诊、病房以及体检的绝经后女性。纳入标准:①50岁及以上的自然生理绝经妇女;②意识清楚,能够与调查人员正常沟通且能回答问题,能独立或通过研究者帮助完成研究所需的问卷;③自愿参与本研究并签署知情同意书。排除标准:①有骨骼相关的肿瘤病史;②有卵巢切除史;③曾服用抗骨质疏松药物(双膦酸盐、雌激素、降钙素、氟制剂、选择性雌激素调节剂等);④长期接触外源性化合物者;⑤近期卧床3个月以上者。
采用美国HOLOGIC公司生产的Discovery A双能X线骨密度测定仪检测腰椎(L1~L4、整体)和左髋部的股骨颈(Neck)、大转子(Troch)、整体及Ward三角的骨密度(bone mineral density,BMD)。并对每位受试者进行骨折相关危险因素的问卷调查,面对面直接派发,填写完毕后当场回收,共计166份。
登陆网站http://www.sheffield.ac.uk/FRAX/tool.jsp,选择中国大陆模式,按要求录入相关信息,系统即自动生成每位受试者10年内主要骨质疏松性骨折概率(probability of a major osteoporotic fracture, PMOF)及10年内髋骨骨折概率(probability of hip fracture, PHF)。
以DXA结果为骨质疏松症的诊断金标准,定义T<-1.0为骨量异常(骨量低下和骨质疏松)组;T≥-1为骨量正常组。并按年龄、IOF 1min测试题回答结果及OSTA指数进行分组分析。
所有数据资料均录入SPSS 17.0软件进行数据分析,连续变量以均数±标准差(表示,绝对变量以例数、百分数表示。P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的基本特征
166例受试对象中骨量异常组132例(79.52%),骨量正常组34例(20.48%)。两组间基本特征的比较,骨量异常组患者的年龄较高、体重较轻、身高变矮较多、绝经年限较长(P<0.01);骨量异常组患者的体重指数低于骨量正常组(P<0.05)。两组间除了具有既往骨折史的人数差异具有统计学意义(P<0.05)外,其余有父母髋骨骨折史、目前抽烟行为、服用肾上腺皮质激素、类风湿关节炎、继发性骨质疏松和饮酒的人数差异均无统计学意义(P>0.05)(表1)。
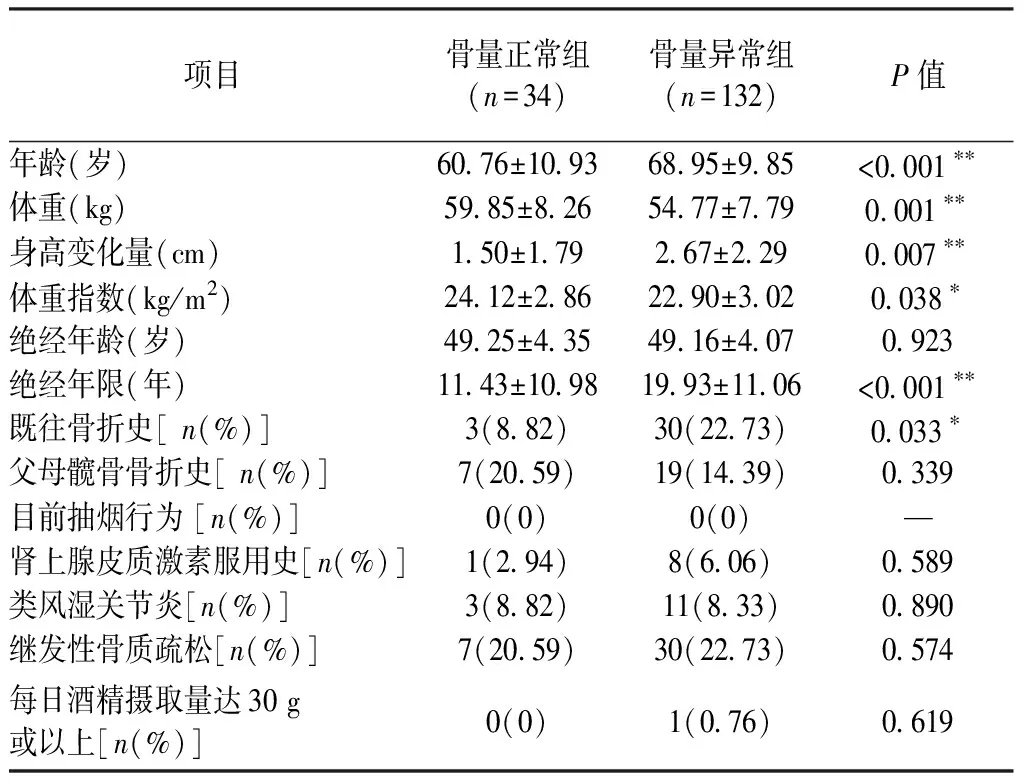
表1 受试对象基本特征比较Table 1 Basic characteristics of the study objects
注:**P<0.01,*P<0.05
2.2 FRAX®工具输出值统计
有或无骨密度的情况下,骨量异常组10年内骨质疏松性骨折概率均显著高于骨量正常组(P<0.01)(表2)。
2.3 FRAX®与DEXA骨密度测定值的相关性分析
相关分析显示166例受试者由FRAX®预测的骨质疏松性骨折概率与股骨颈骨密度T值之间呈显著负相关。其中未代入股骨颈BMD时的PMOF、PHF与股骨颈骨密度T值呈显著负相关(r=-0.326、-0.368,均P<0.01);代入股骨颈BMD后生成的PMOF、PHF与股骨颈骨密度T值亦呈显著负相关(r=-0.710、-0.733,均P<0.01)。另外,有和无骨密度情况下FRAX®预测的PMOF呈显著正相关(r=0.637,P<0.01),在预测PHF方面也同样具有显著的相关性(r=0.567,P<0.01)。
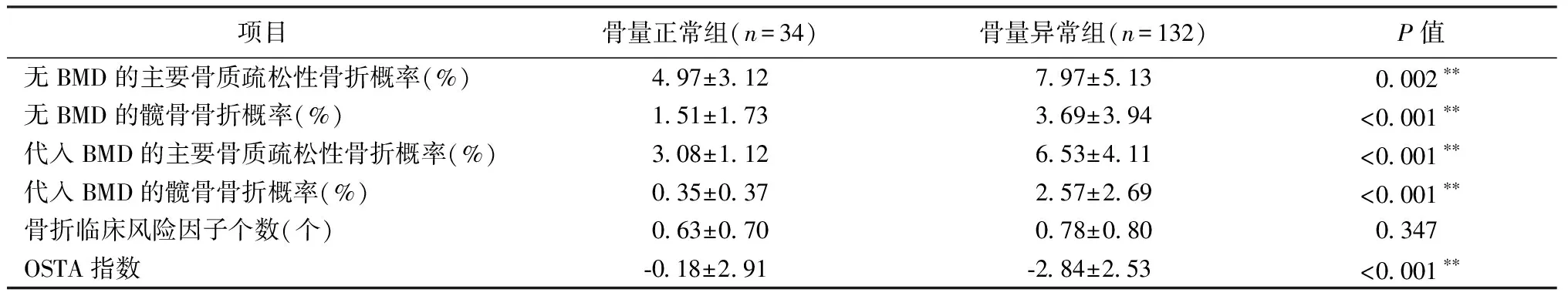
表2 受试对象FRAX®输出值比较Table 2 Comparison of the outputs of the FRAX® algorithms of the study objects
注:**P<0.01
2.4 不同分组下骨量异常发生率与FRAX®的比较
2.4.1不同年龄分组的受试者比较:不同年龄分组中,<60、60~69、70~79岁组及≥80岁组的骨量异常发生率分别为58.33%、87.18%、90.74%、84.00%。随着年龄的增长,10年内骨质疏松性骨折发生概率显著升高,组间差异具有统计学意义(P<0.01)(图1)。
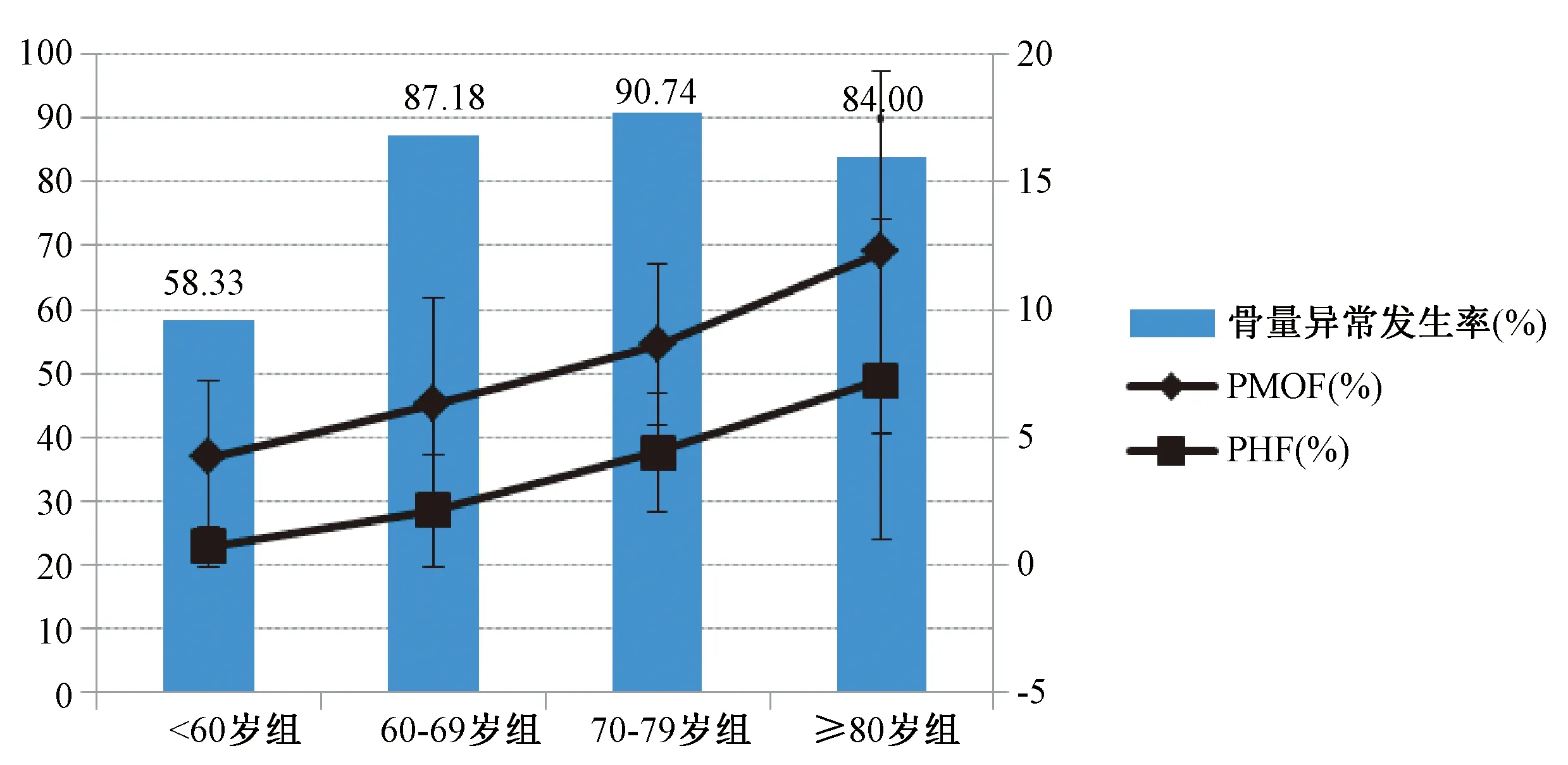
图1 不同年龄分组骨量异常发生率与骨折概率的比较Fig.1 Comparison of incidence of abnormal bone mass and 10-year fracture probabilities among different age groups
2.4.2不同IOF 1min测试题结果分组的受试者比较:IOF 1min测试阴性组及阳性组的骨量异常发生率分别为66.67%、84.75%,随着骨质疏松风险的增加,10年内骨质疏松性骨折发生概率显著升高,组间差异具有统计学意义(P<0.01)(图2)。

图2 IOF1min测试题分组骨量异常发生率与骨折概率的比较Fig.2 Comparison of incidence of abnormal bone mass and 10-year fracture probability among different IOF one-minute osteoporosis risk test groups
2.4.3不同OSTA指数分组的受试者比较:根据OSTA指数划分的低风险组、中风险组及高风险组的骨量异常发生率分别为59.62%、85.29%、93.48%,随着骨质疏松风险的增加,10年内骨质疏松性骨折发生概率显著升高,组间差异具有统计学意义(P<0.01)(图3)。
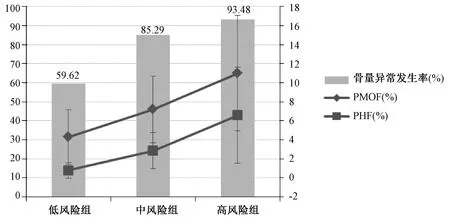
图3 不同OSTA指数分组骨量异常发生率与骨折概率的比较Fig.3 Comparison of incidence of abnormal bone mass and 10-year fracture probability among different OSTA groups
2.5 FRAX®对识别骨量异常的ROC曲线分析
FRAX®预测的10年内主要骨质疏松性骨折概率识别骨量异常的ROC曲线的曲线下面积为0.705(95%CI:0.605~0.804,P<0.001),cutoff值为3.75%,准确度为中等;10年内髋骨骨折概率识别骨量异常的ROC曲线的曲线下面积为0.743(95%CI:0.648~0.837,P<0.001),cutoff值为1.75%,准确度为中等。
3 讨论
女性骨质疏松患病率明显高于男性。绝经后骨量的迅速流失,尤以第一个3至7年内最为严重,每年丢失可达6%~8%,此后每年以2.2%~3.0%的速率下降[10],使得绝经后女性成为骨质疏松症的高发人群。此外研究发现,增龄、绝经年限的延长、低体重及既往骨折史等均是影响绝经后女性低骨量的重要危险因素[11, 12]。
本研究纳入的166名受试者总的骨量异常发生率为79.5%,与近来国内其他地区的一些研究数据十分相近[13,14]。结果中显示,骨量异常组年龄较高、体重较轻、BMI较低、绝经年限较长、身高变矮较多的特点与绝经后女性低骨量的危险因素是相符的。FRAX®综合以上的危险因素进行分析后所生成的数据显示,骨量异常组的10年内主要骨质疏松性骨折概率及10年内髋骨骨折概率均显著高于骨量正常组,为有效的评估指标,说明该系统能够有效地反映出测试个体的骨密度高低变化。
除了低骨密度,OF的发生还同时受到很多其他风险因子的影响。国外研究表明[15],不代入BMD的情况下髋骨骨折风险与股骨颈骨密度之间存在着一定的相关性(r=-0.25)。本研究针对FRAX®与BMD的相关性分析显示,有或无骨密度的情况下FRAX®生成的骨质疏松性骨折概率与股骨颈骨密度T值之间均呈显著负相关,即FRAX®预测个体的PHF或PMOF越高时,提示其骨密度值越低;并且有骨密度和无骨密度情况下FRAX®预测值两者间呈显著正相关,说明在缺乏骨密度测定时,FRAX®系统同样可以优先地筛选出低骨量的高危人群,有效评估骨折风险。
骨质疏松是一种退化性的疾病,而年龄是引起这种退化不可抗拒的因素。本研究随着绝经后女性年龄的增长,10年内骨质疏松性骨折的风险显著增加,骨量异常发生率亦逐渐升高,但在80岁以后有下降的趋势。国内外研究表明[16-18],OF的发病率在50岁以后随年龄的增加而呈指数比例增长。亦有研究指出[19],年龄增长所引起的骨折风险升高的速率要远远高于骨密度下降的速率。所以临床中若仅依靠骨密度测定作为判定标准,往往有可能低估高龄女性骨质疏松性骨折的风险,忽略了潜在需要治疗的患者。
目前临床工作中,OP的治疗方案通常是以OF为终点事件所制定的,目的在于减少OF的发生风险,因此,骨折风险评估是明确需要干预的个体的决定性因素。我国指南中推荐将IOF1min测试题和OSTA作为骨质疏松的初筛工具,并建议当1min测试题回答结果为阳性或OSTA指数≤-1时需进行骨密度测定,当OSTA指数≤-4时则需考虑对患者进行药物干预。本研究随着患者骨质疏松风险的增加,骨量异常发生率显著增加,PMOF或PHF亦随之显著改变(升高),说明在区分不同程度的骨质疏松风险方面FRAX®与上述两种工具存在一致性。部分研究也已证实[20,21],根据FRAX®评估的骨质疏松性骨折高危人群,采用药物干预具有早诊断、高疗效的特点。因此,临床工作中可以将FRAX®作为一项基本的初筛工具,首先评估个体是否需要进一步行骨密度测定或直接开始骨质疏松干预治疗,经济有效地协助医师们进行临床决策。
由于各国的国情不同,WHO并未给出统一推荐的标准[22],不同的国家和地区需要结合本国的人群特点及经济情况来确定适宜的临床干预阈值。我国目前尚无中国人群的治疗阈值,临床上需参考其他国家的资料。本研究中对FRAX®识别骨量异常的ROC曲线分析显示,PMOF和PHF的识别准确度都在中等水平,且后者的识别效能要优于前者。值得注意的是,本研究10年内主要部位骨质疏松性骨折概率的cutoff值为3.75%,与国内左薇等[23]的研究结果较为相似,均远远低于NOF标准20%,考虑可能由于FRAX®亚洲模式计算10年内主要部位骨质疏松性的骨折概率是基于瑞典人椎体与髋部骨折比例所得[24],而最近的一项研究表明,亚洲人椎体与髋骨骨折发生率的比值实际高于白种人[25],因此该模式的计算结果低估了亚洲人的10年内PMOF。
综上所述,FRAX®既可以反映机体骨密度变化,又能综合全面地评估个体骨折风险,有效识别绝经后女性骨质疏松的高危人群,在缺乏骨密度测定时也同样适用,因此可以将FRAX®作为一项基本的筛检工具进行推广。但目前的运算模式和干预标准仍有待国内大样本、前瞻性研究和药物经济学的进一步校正和完善。

