碲化镉量子点抑制人脐静脉内皮细胞存活并损伤线粒体
严明,张云,刘珂舟,孙永红
(1.杭州电子科技大学生命信息与仪器工程学院,浙江杭州310018;2.绍兴文理学院基础医学院,浙江绍兴312000;3.浙江大学生物医学工程与仪器科学学院浙江省心脑血管检测技术与药效评价重点实验室,浙江杭州310027)
碲化镉量子点抑制人脐静脉内皮细胞存活并损伤线粒体
严明1,张云2,刘珂舟1,孙永红3
(1.杭州电子科技大学生命信息与仪器工程学院,浙江杭州310018;2.绍兴文理学院基础医学院,浙江绍兴312000;3.浙江大学生物医学工程与仪器科学学院浙江省心脑血管检测技术与药效评价重点实验室,浙江杭州310027)
目的 观察碲化镉量子点(CdTe QD)对人脐静脉内皮细胞(HUVEC)线粒体自噬的诱导作用,探讨CdTe QD对血管内皮细胞的毒理特性。方法原代培养的HUVEC采用免疫荧光法鉴定后与CdTe QD(0.1~100 mg·L-1)共孵育24 h,MTT法检测细胞存活;Mitotracker标记、激光共聚焦显微术观察线粒体断裂情况;JC-1染色、流式细胞术检测CdTe QD对HUVEC线粒体膜电位的影响;Western蛋白印迹法检测线粒体自噬相关蛋白微管相关蛋白1轻链3Ⅰ/Ⅱ(LC3Ⅰ/Ⅱ)、膜突蛋白样BCL2作用蛋白1(Beclin1)、同源性磷酸酶张力蛋白诱导的激酶1(PINK1)和动力相关蛋白1(DRP1)水平的变化。结果 经鉴定,原代培养的HUVEC>95%为血管内皮细胞。MTT结果 显示,CdTe QD作用于HUVEC 24 h后,细胞存活率显著下降(P<0.05,P<0.01)。激光共聚焦显微术检测发现,CdTe QD导致HUVEC胞内线粒体大量断裂。流式细胞术检测染色结果 表明,CdTe QD 0.1,1和10 mg·L-1使HUVEC的线粒体膜电位下降,膜电位较高的HUVEC比例分别由正常对照组的(91.8±0.6)%下降至(90.2±1.1)%,(84.4±0.9)%和(78.1±1.3)%(P<0.05,P<0.01)。Western蛋白印迹结果 显示,CdTe QD 10 mg·L-1诱导自噬相关蛋白Beclin1,LC3Ⅱ/LC3Ⅰ比值PINK1和DRP1的水平升高(P<0.05,P<0.01),CdTe QD 1 mg·L-1还造成线粒体自噬相关蛋白PINK1和DRP1表达显著上升(P<0.05,P<0.01)。结论CdTe QD可诱导HUVEC线粒体损伤并激活线粒体自噬。
碲化镉量子点;脐静脉内皮细胞;线粒体;自噬;线粒体自噬
DOl:10.3867/j.issn.1000-3002.2017.06.012
量子点(quantum dots,QD)是一类在生物医学领域常用的半导体发光纳米材料,通常由1~2种或更多的Ⅱ~Ⅵ族或Ⅲ~Ⅴ族元素组成,是三维尺寸均10 nm的球形或类球形超微颗粒[1]。我们利用水热法合成了巯基丁二酸包被的碲化镉QD(CdTe QD)。其具有优于传统有机荧光染料的光电特性,如激发光谱宽而连续,发射光谱窄而对称;同时其发射光谱可通过改变尺寸进行调谐,从而具有实现单激发、多发射的多色荧光标记的可能。CdTe QD还具有良好的光稳定性和抗淬灭能力;此外,其表征结果 还显示其表面包被完整、镉泄漏低[2]。因此,该QD具有良好的生物医学标记应用前景。然而,目前已有研究表明,QD存在一定的生物毒性[3],这是QD应用于临床的最大障碍。特别是用于在体成像时,它可通过注射直接进入机体血液循环系统[4],对人体健康尤其是心血管系统健康构成潜在危害。
血管内皮细胞(vascular endothelial cells,VEC)是位于血液与血管壁内皮下组织之间的单层扁平细胞,是生理条件下与血液直接接触的唯一血管细胞。因此,当QD经注射进入血管后将可能与内皮细胞发生直接作用。正常生理状态下,VEC不仅对于血浆大分子具有屏障作用,还能分泌如一氧化氮等重要的细胞因子来调节血液系统、心血管系统甚至免疫系统等的生理功能;而当外源性有毒物质攻击VEC时,则可能造成VEC损伤(如线粒体等细胞器的功能紊乱)甚至死亡,并进而影响机体平衡、导致动脉粥样硬化等疾病的发生[5]。我们前期研究发现,水热法合成的CdTe QD会造成人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)内活性氧(reactive oxygen species,ROS)含量迅速上升[2]。细胞内ROS主要由线粒体产生,而线粒体对ROS的损伤作用又最为敏感。为维持细胞内稳态,这些受损的线粒体可通过细胞自噬机制选择性地清除,这一过程被称为线粒体自噬(mitophagy)[6]。但该CdTe QD是否会损伤HUVEC的线粒体功能并诱发线粒体自噬,目前尚无报道。本研究拟在前期研究基础上,采用体外培养HUVEC,研究CdTe QD对HUVEC线粒体功能的损伤及其对线粒体自噬的激发作用,以进一步探讨QD诱导HUVEC损伤及应激调控的可能机制。
1 材料与方法
1.1 试剂和仪器
M200培养基、低血清生长添加物(low serum growth supplement,LSGS)和线粒体膜电位染料(5,5′,6,6′-tetrachloro-1,1′,3,3′-tetraethyl-imidacarbocyanine iodide,JC-1)购自美国Thermo Fisher Scientific公司;胰酶细胞消化液购自上海碧云天生物技术有限公司;RIPA细胞裂解液、蛋白浓度测定试剂盒(BCA法)和超敏ECL化学发光试剂盒均购自联科生物科技有限公司;四甲基偶氮唑蓝(MTT)和碘化吡啶(propidium iodide,PI)购于美国Sigma公司;小鼠抗人VEC特异性分子VE-cadherin单克隆抗体购自美国eBioscience公司,兔抗人微管相关蛋白1轻链3Ⅰ/Ⅱ(microtubule-associated protein 1 light chain 3Ⅰ/Ⅱ,LC3Ⅰ/Ⅱ)单克隆抗体、兔抗人膜突蛋白样BCL2作用蛋白1(moesinlike BCL2-interacting protein1,Beclin1)单克隆抗体、兔抗人同源性磷酸酶张力蛋白诱导的激酶1〔phosphatase and tensin homologue(PTEN)-induced putative kinase 1,PINK1〕单克隆抗体,兔抗人动力相关蛋白1(dynamin related protein 1,DRP1)单克隆抗体和小鼠抗人β肌动蛋白单克隆抗体购自美国Cell Signaling Technology公司;辣根过氧化物(HRP)标记的山羊抗兔IgG二抗和FITC标记的山羊抗兔IgG二抗均购自杭州联科生物技术有限公司。
电子分析天平购自瑞士梅特勒-托利多公司,恒温二氧化碳细胞培养箱购自美国Thermo scientific公司,高速台式冷冻离心机购自德国Hermle公司,酶标仪购自美国Molecular Devices公司,流式细胞仪购自美国BD公司,激光共聚焦显微镜购自德国Zeiss公司,电泳仪、转膜仪及凝胶成像分析系统购自美国Bio-Rad公司。
1.2 HUVEC培养及分组处理
无菌条件下取健康新生儿脐带(20~30 cm),参考Jaffe等[7]的方法并加以改进,采用Ⅰ型胶原酶(1 g·L-1)消化法进行HUVEC的原代培养。消化结束将收集到的细胞400×g离心5 min,弃上清、加入含10%LSGS的M200培养基,接种于培养瓶中,37°C,5%CO2培养箱静置培养。24 h后首次换液,之后每隔48 h换液。至细胞长满培养瓶底面90%后用胰酶消化、传代。取3~5代HUVEC用于后续实验。
用电子分析天平称取10 mg CdTe QD干粉溶于1 mL PBS中,得到10 g·L-1母液。上述母液经0.22 μm滤膜过滤除菌后4°C储存备用。细胞染毒时将储存液用PBS稀释为1~1000 mg·L-1染毒工作液,作用于HUVEC。
将HUVEC随机分成细胞对照组和不同剂量CdTe QD作用组。细胞对照组细胞每孔加入1/10体积的PBS,不同剂量CdTe QD组分别加入1/10体积相应浓度的染毒工作液,使其终浓度为0.1~100 mg·L-1,孵育24 h后取细胞进行实验。
1.3 免疫荧光鉴定内皮细胞纯度
HUVEC接种至玻璃底培养皿中,生长至融合后用3.7%多聚甲醛固定30 min,然后加入0.5%Triton X-100和含5%BSA的PBS室温孵育各20 min;去除BSA后,加入用0.1%Triton X-100和5%BSA稀释的小鼠抗人VE-cadherin抗体(1∶100稀释),4°C孵育过夜;第2天用PBS清洗后,加入FITC标记的山羊抗兔IgG二抗(1∶100稀释),室温孵育2 h。最后加入10 μL propidium lodide(PI)5 mg·L-1孵育5 min,滴加10 μL抗荧光淬灭剂封片后,在激光共聚焦显微镜下观察HUVEC VE-cadherin的表达。
1.4 MTT法检测细胞存活率
取对数生长期的HUVEC接种于96孔培养板中,待细胞基本融合后按1.2处理细胞,待细胞与CdTe QD作用24 h后加入20 μL MTT溶液(5 g·L-1)继续孵育4 h,然后弃上清并加入150 μL DMSO溶解蓝紫色甲瓒结晶。用酶标仪在490 nm处检测吸光度值(A490nm)。细胞存活率(%)=(处理组A490nm-对照组A490nm)/(细胞对照组A490nm-空白对照组A490nm)×100%。每组3复孔,并至少重复3次。
1.5 Mitotracker染色检测线粒体形态
将HUVEC接种至玻璃底培养皿中,细胞90%融合后按1.2处理细胞24 h。处理结束后移除上清液,PBS洗2次后加入100 μL的Mitotracker染色液(100 nmol·L-1),避光孵育20 min,然后用激光共聚焦显微镜检测线粒体形态。
1.6流式细胞术检测线粒体膜电位
HUVEC接种于24孔板,按1.2分组并处理细胞24 h后,PBS清洗细胞。然后用0.125%胰酶+ 0.01%EDTA消化液消化、离心收集细胞(400×g,5 min)。将收集的细胞重悬于PBS,制成单细胞悬液,加入JC-1染料(终浓度5 mg·L-1)避光孵育30 min后上流式细胞仪检测。分群设定由对照组细胞加入线粒体解耦联剂CCCP(50 mg·L-1)再负载JC-1染料后获取,每组设3复孔,实验至少重复3次。以R1门内细胞数占检测细胞的百分比表示线粒体膜电位。
1.7 Western蛋白印迹法检测Beclin1,LC3Ⅰ/Ⅱ,PlNK1和DRP1蛋白表达
HUVEC接种于6孔板,按1.2随机分组处理细胞24 h。处理结束后,PBS清洗细胞、胰酶消化并离心收集细胞(400×g,10 min);弃上清,加入RIPA裂解液冰上裂解、高速离心获取细胞总蛋白。采用BCA法测定各组总蛋白量。每组各取50 μg蛋白经SDS-PAGE凝胶电泳、转膜、封闭、一抗孵育过夜(兔抗人Beclin1,LC3Ⅰ/Ⅱ,PINK1和DRP1单克隆抗体(1∶1000),小鼠抗人β肌动蛋白单克隆抗体(1∶1000),HRP标记的山羊抗兔IgG二抗(1∶2500)孵育1 h。然后按超敏ECL显色试剂盒说明书,加入显色液于凝胶成像系统中拍照。用Quantity One软件分析蛋白条带,以目标蛋白条带与β肌动蛋白条带积分吸光度比值表示目标蛋白的表达水平。
1.8 统计学分析
实验结果 数据以x±s表示,采用SPSS18.0软件进行统计学分析,各组间比较釆用单因素方差分析,组间两两比较用LSD法检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 HUVEC纯度鉴定
光镜下HUVEC形态(图1A)所示,生长至融合时,HUVEC呈典型的“铺路石”状单层生长的状态。激光共聚焦显微镜下观察VEC特异性分子VE-cadherin免疫荧光染色结果 (图1B)显示,所有细胞的细胞核均被PI染色,呈现红色荧光,其中>98%的细胞为VE-cadherin免疫荧光染色阳性,其细胞膜呈现绿色荧光,表明HUVEC纯度>98%。
2.2 CdTe QD对HUVEC存活的影响
CdTe QD显著抑制HUVEC的细胞存活(P<0.05,P<0.01),且随着CdTe QD浓度上升,抑制作用逐渐增强。CdTe QD 0.1~100 mg·L-1处理24 h后,HUVEC细胞存活率分别下降到细胞对照组的(94.5± 3.2)%,(88.9±1.6)%,(54.5±2.6)%,(31.7±2.6)%,(21.2±2.5)%和(20.6±1.5)%(图2)。
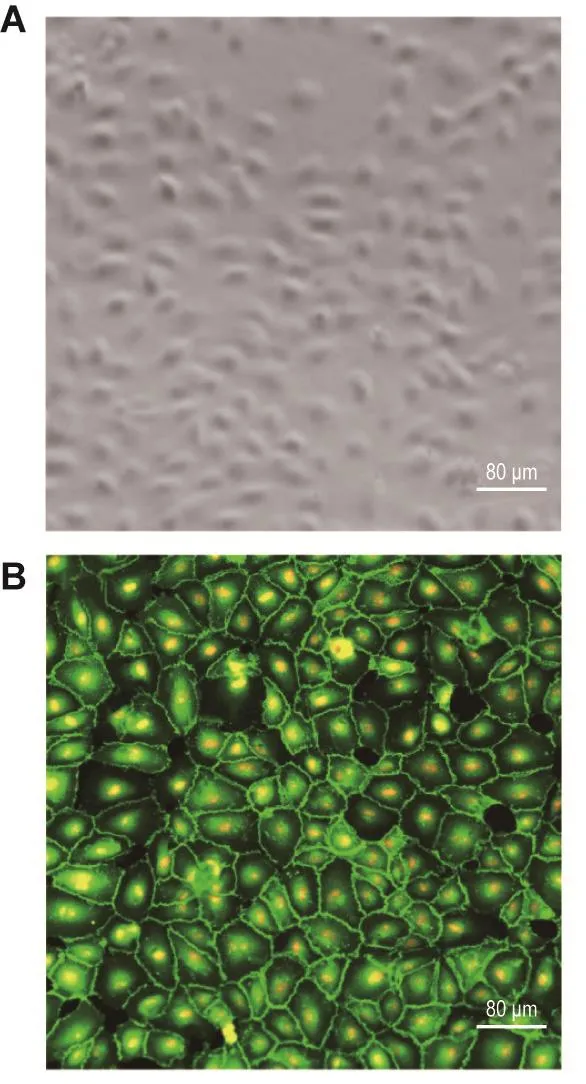
Fig.1 ldentification of human umbilical endothelial cells(HUVECs)by immunofluorescence staining.A:HUVECs under an optical microscope;B:HUVECs labeled with VE-cadherin antibody and PI.
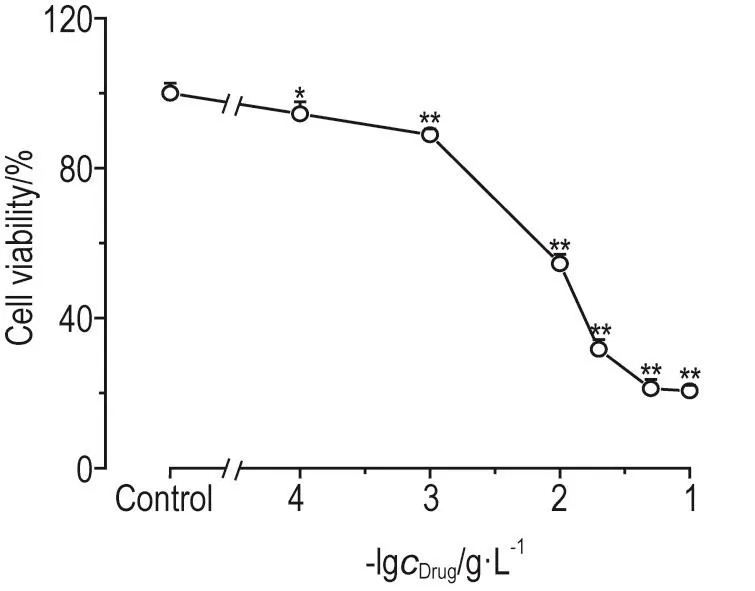
Fig.2 Effect of CdTe quantum dot(CdTe QD)on HUVEC survival.HUVECs were treated with CdTe QD(0.1-100 mg·L-1)for 24 h.x±s,n=3.*P<0.05,**P<0.01,compared with cell control(0)group.
2.3 CdTe QD对HUVEC线粒体形态的影响
细胞对照组的线粒体呈网状或长柱状结构;而经CdTe QD 0.1,1和10 mg·L-1处理后的细胞,线粒体发生断裂,线粒体呈短棒状或点状;随着CdTe QD浓度升高,线粒体断裂程度加深,表明CdTe QD导致HUVEC线粒体发生明显的断裂(图3)。
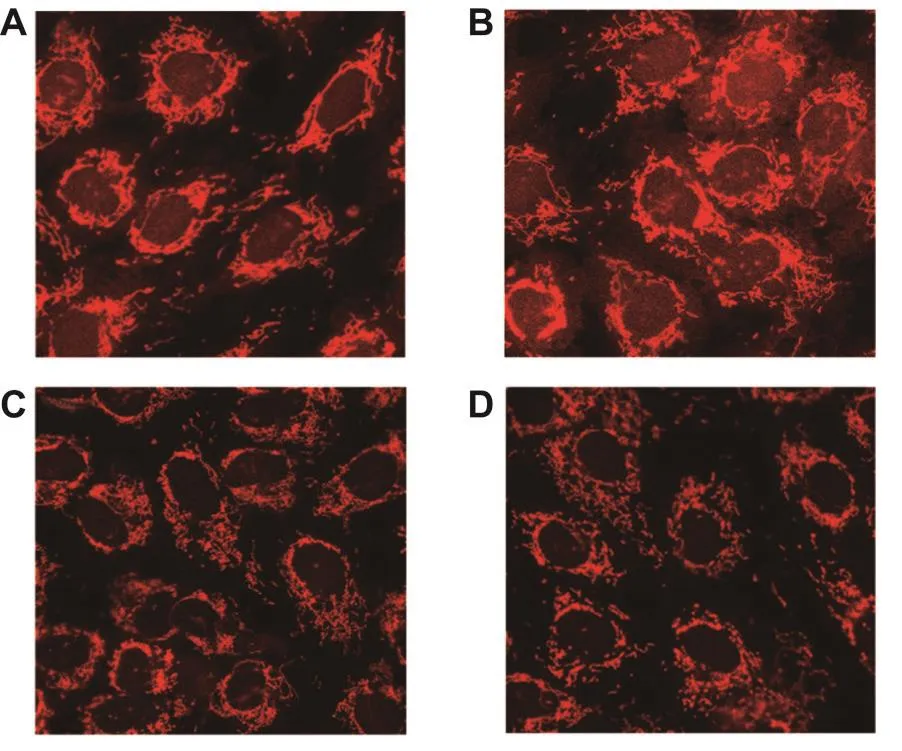
Fig.3 Effect of CdTe QD on morphology of mitochondria in HUVECs(200×).HUVECs were treated without(A)or with CdTe QD 0.1,1 and 10 mg·L-1(B,C,D)for 24 h,and the morphology of mitochondria was detected by Mitotracker staining.
2.4 CdTe QD对HUVEC线粒体膜电位的影响
如图4A和4B所示,正常HUVEC线粒体膜电位保持在较高水平,(91.8±0.6)%的细胞内JC-1以J-凝聚体(aggregates)的形式存在,而线粒体膜电位解偶联剂CCCP 50 mg·L-1使HUVEC线粒体膜电位完全崩解,膜电位较高的HUVEC细胞仅占所有细胞的(5.9±2.3)%。在CdTe QD作用下,HUVEC线粒体膜电位下降(P<0.01),CdTe QD 0.1,1和10 mg·L-1处理后,膜电位较高的HUVEC细胞百分比分别下降至(90.2±1.1)%,(84.4±0.9)%和(78.1±1.3)%,提示CdTe QD能诱导HUVEC线粒体损伤。
2.5 CdTe QD对HUVEC线粒体自噬相关蛋白表达的影响
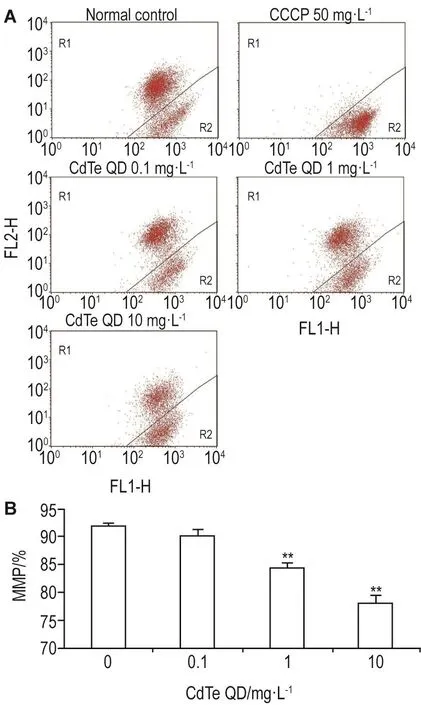
Fig.4 Effect of CdTe QD on mitochondrial membrane potential(MMP)of HUVECs by flow cytometry.See Fig.3 for the cell treatment.Cells were digested and labeled with JC-1.R1:J-aggregates;R2:J-monomers.B was the semi-quantitative result of A.x±s,n=3.**P<0.01,compared with cell control(0)group.
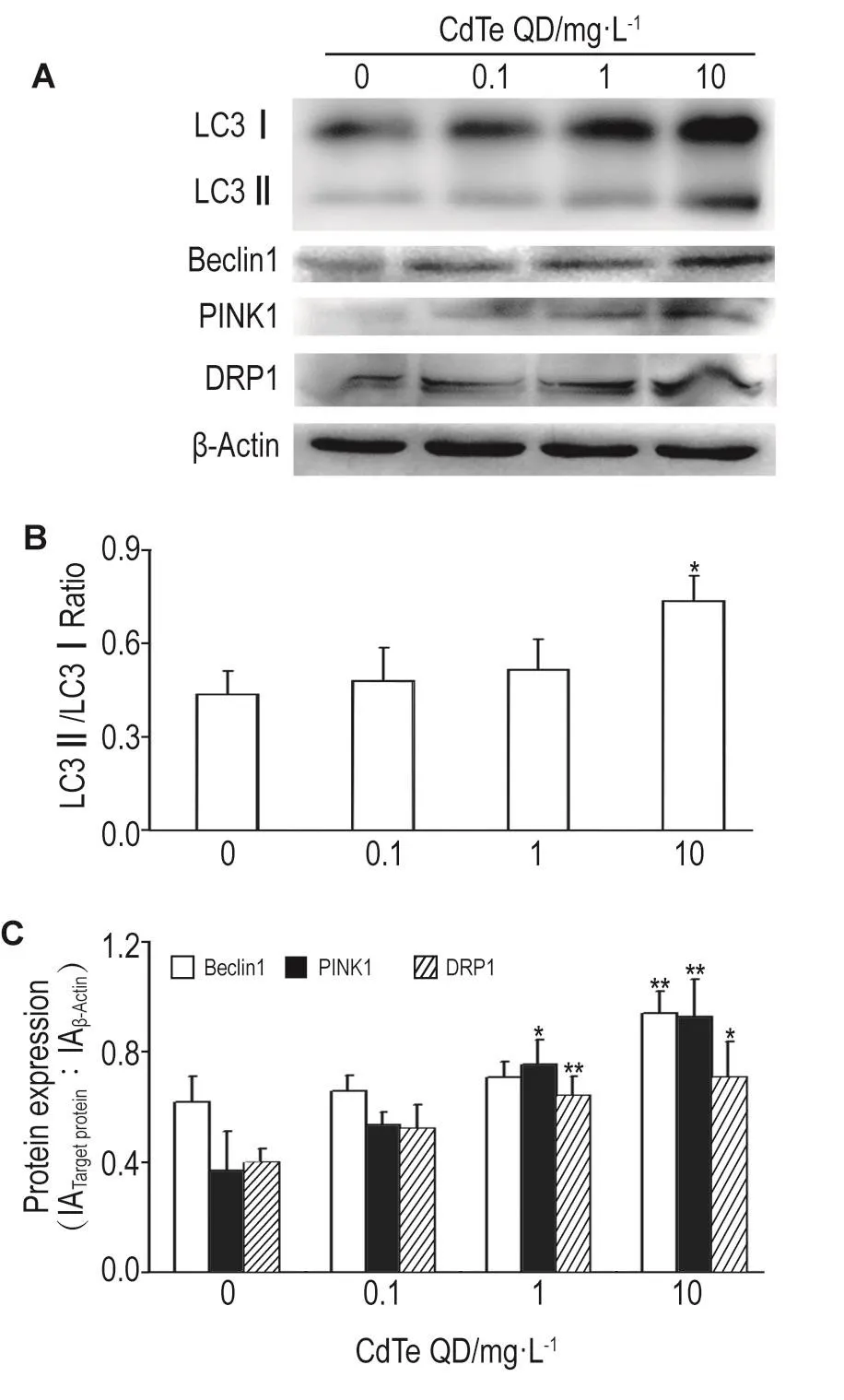
Fig.5 Effect of CdTe QD on expression of mitophagy related protein microtubule-associated proteinⅠlight chain 3Ⅰ/Ⅱ(LC3Ⅰ/Ⅱ),Beclin1,phosphate and tensin homolo-induced putative kinaseⅠ(PlNK1)and dynamin-related protein 1(DRP1)in HUVECs by Western blotting.See Fig.3 for the cell treatment.B and C were the semi-quantitative results of A.x±s,n=3.*P<0.05,**P<0.01,compared with cell control(0)group.
Western蛋白印迹法结果 (图5)示,与细胞对照组相比,CdTe QD作用24 h后,LC3Ⅱ/LC3Ⅰ比值升高(P<0.05),分别由0.44±0.08升高至0.48± 0.10,0.52±0.10和0.74±0.08。Beclin1蛋白表达增加(P<0.01),由细胞对照组的0.62±0.09上升至0.66±0.06,0.71±0.05和0.94±0.08。线粒体自噬相关蛋白PINK1和DRP1表达显著增加(P<0.05,P<0.01),PINK1由0.37±0.14上升至0.53±0.05,0.75±0.09和0.93±0.13,DRP1则由0.40±0.05上升至0.52±0.08,0.64±0.07和0.71±0.13。上述结果 表明,CdTe QD能诱导线粒体自噬相关蛋白表达增加。
3 讨论
本研究结果 表明,CdTe QD可显著抑制HUVEC细胞存活,导致其细胞内线粒体大量断裂,JC-1染色线粒体膜电位较高的HUVEC比例明显下降;同时CdTe QD可诱导自噬相关蛋白Beclin-1表达上升,上调LC3Ⅱ/LC3Ⅰ的比值,还造成线粒体自噬相关蛋白PINK1和DRP1水平显著上调,诱导细胞发生线粒体自噬。
细胞器是细胞功能正常运转的结构基础,线粒体因其能通过氧化磷酸化作用合成ATP,为细胞的生命活动提供能量,是细胞内最重要的细胞器之一。而线粒体的功能与其结构的完整性直接相关,换言之,线粒体断裂将可能直接影响能量的合成和细胞功能。近年有研究证实,线粒体也是纳米材料产生细胞毒性的重要靶点之一。如纳米金和纳米二氧化硅颗粒会造成VEC在内的多种细胞线粒体发生去极化和形态异常[8-9]。与之类似,本研究发现,CdTe QD也能导致HUVEC线粒体损伤(包括线粒体断裂和线粒体膜电位崩解。有研究表明,线粒体膜电位的崩解将抑制VEC合成一氧化氮,进而抑制细胞功能[10-11]。因此,CdTe QD造成的HUVEC线粒体损伤除了抑制细胞能量供给外,还可能直接参与诱导细胞功能异常、抑制VEC功能。
另一方面,线粒体膜电位崩解常被视为细胞凋亡的早期事件,受损的线粒体可释放并激活多种凋亡相关蛋白,诱导细胞凋亡[12]。因此,及时清除受损线粒体对维持细胞稳态至关重要。自噬是一种非常保守的细胞自我更新过程,在营养供应充足条件下的特异性自噬如线粒体自噬和过氧化物酶体自噬(pexophagy)等,可清除并回收受损细胞器,防止其对细胞造成进一步损伤甚至死亡。目前认为,PINK1介导的PINK1/Parkin通路与线粒体自噬密切相关。当线粒体膜电位下降时,PINK1在线粒体累积、将Parkin募集到受损线粒体并将其磷酸化。随后,Parkin泛素化线粒体内多种底物蛋白,上述蛋白被信号接头蛋白识别,再与LC3结合,介导线粒体进入自噬体。最终,随着自噬体与溶酶体的融合受损线粒体被清除,从而达到保护细胞的目的[13-14]。此外,病理条件下,细胞内DRP1也将发生聚集,造成线粒体的促分裂状态,从而调节线粒体自噬[15]。2014年常丽俊等[16]报道纳米氧化铝诱导神经细胞发生线粒体自噬。2015年Zhang等[17]研究发现,多金属氧酸盐纳米颗粒能导致线粒体膜电位下降并激活Parkin通路,诱导线粒体自噬。本研究结果 也显示,CdTe QD作用24 h造成PINK1和DRP1蛋白水平显著升高,表明CdTe QD能诱导线粒体促分裂状态的发生,并启动线粒体自噬。而自噬标志性蛋白LC3和Beclin1表达的增加,则进一步标志着下游自噬激活和受损断裂线粒体的清除。上述结果 提示,QD和其他纳米材料可能诱发线粒体自噬,后者可能是纳米材料诱导细胞应激调控的一种新机制。而线粒体自噬的激活对纳米材料造成的细胞损伤是否具有抑制作用还需进一步研究和验证。
综上,本研究发现,CdTe QD可显著抑制HUVEC细胞存活,并诱导细胞线粒体断裂和线粒体膜电位下降;还可激活细胞内线粒体自噬相关蛋白表达,受损断裂的线粒体可能通过线粒体自噬作用被清除。
[1]Michalet X,Pinaud FF,Bentolila LA,Tsay JM,Doose S,Li JJ,et al.Quantum dots for live cells,in vivo imaging,and diagnostics[J].Science,2005,307(5709):538-544.
[2]Yan M,Zhang Y,Xu K,Fu T,Qin H,Zheng X. An in vitro study of vascular endothelial toxicity of CdTe quantum dots[J].Toxicology,2011,282(3):94-103.
[3]Derfus AM,Chan WCW,Bhatia SN.Probing the cytotoxicity of semiconductor quantum dots[J]. Nano Lett,2004,4(1):11-18.
[4]Hu R,Yong KT,Roy I,Ding H,Law WC,Cai H,et al.Functionalized near-infrared quantum dots for in vivo tumor vasculature imaging[J].Nanotechnology,2010,21(14):145105.
[5]Reriani MK,Lerman LO,Lerman A.Endothelial function as a functional expression of cardiovascular risk factors[J].Biomark Med,2010,4(3):351-360.
[6]Kubli DA,GustafssonÅB.Mitochondria and mitophagy:the yin and yang of cell death control[J].Circ Res,2012,111(9):1208-1221.
[7]Jaffe EA,Nachman RL,Becker CG,Minick CR. Culture of human endothelial cells derived from umbilical veins.Identification by morphologic and immunologic criteria[J].J Clin Invest,1973,52(11):2745-2756.
[8]Liu X,Sun J.Endothelial cells dysfunction induced by silica nanoparticles through oxidative stress via JNK/P53 and NF-kappaB pathways[J].Biomaterials,2010,31(32):8198-8209.
[9]Pan Y,Leifert A,Ruau D,Neuss S,Bornemann J,Schmid G,et al.Gold nanoparticles of diameter 1.4 nm trigger necrosis by oxidative stress and mitochondrial damage[J].Small,2009,5(18):2067-2076.
[10]Quintero M,Colombo SL,Godfrey A,Moncada S. Mitochondria as signaling organelles in the vascular endothelium[J].Proc Natl Acad Sci USA,2006,103(14):5379-5384.
[11]Dedkova EN,Ji X,Lipsius SL,Blatter LA.Mitochondrial calcium uptake stimulates nitric oxide production in mitochondria of bovine vascular endothelial cells[J].Am J Physiol Cell Physiol,2004,286(2):C406-C415.
[12]Gottlieb E,Armour SM,Harris MH,Thompson CB. Mitochondrial membrane potential regulates matrix configuration and cytochrome c release during apoptosis[J].Cell Death Differ,2003,10(6):709-717.
[13]Kim I,Rodriguez-Enriquez S,Lemasters JJ. Selective degradation of mitochondria by mitophagy[J].Arch Biochem Biophys,2007,462(2):245-253.
[14]Geisler S,Holmström KM,Skujat D,Fiesel FC,Rothfuss OC,Kahle PJ,et al.PINK1/Parkin-Mediated mitophagy is dependent on VDAC1 and p62/ SQSTM1[J].Nat Cell Biol,2010,12(2):119-131.
[15]Kageyama Y,Hoshijima M,Seo K,Bedja D,Sysa-Shah P,Andrabi SA,et al.Parkin-independent mitophagy requires DRP1 and maintains the integrity of mammalian heart and brain[J].EMBO J,2014,33(23):2798-2813.
[16]Chang LJ,Guo WW,Ge CC,Niu Q,Zhang QL. Effect of nano-alumina on mitophagy in primary cortical neuronal cells from Wistar newborn rats[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2014,28(5):737-742.
[17]Zhang Z,Zhou L,Zhou Y,Liu J,Xing X,Zhong J,et al.Mitophagy induced by nanoparticle-peptide conjugates enabling an alternative intracellular trafficking route[J].Biomaterials,2015,65:56-65.
CdTe quantum dot inhibits cell survival and induces mitochondrial dysfunction in primary human umbilical vein endothelial cells
YAN Ming1,ZHANG Yun2,LIU Ke-zhou1,SUN Yong-hong3
(1.Department of Biomedical Engineering,College of Life Information Science and Instrument Engineering,Hangzhou Dianzi University,Hangzhou 310018,China;2.College of Medicine, Shaoxing University,Shaoxing 312000,China;3.Zhejiang Provincial Key Laboratory of Cardio-c erebral Vascular Detection Technology and Medical Effectiveness Appraisal, Department of Biomedical Engineering,College of Biomedical Engineering and Instrument Science,Zhejiang University,Hangzhou 310027,China)
OBJECTlVETo elucidate the toxicological properties of CdTe quantum dots(CdTe QD)by investigating their effect on mitophagy in human umbilical vein endothelial cells(HUVECs).METHODSThe purity of primarily cultured HUVECs was detected by immunofluorescence.Then, HUVECs were incubated with CdTe QD 0.1-100 mg·L-1for 24 h.After treatment,the cell viability of HUVECs was detected with MTT assay.The mitochondrial morphology was observed under a laser scanning confocal microscope after labeling with Mitotracker.The treated HUVECs were also labeled with JC-1 probe,and the mitochondrial membrane potential(MMP)was then examined by flow cytometry. The expression of mitophagy-related proteins including microtubule-associated protein 1 light chain 3Ⅰ/Ⅱ(LC3Ⅰ/Ⅱ),moesin-like BCL2-induced protein1(Beclin1),phosphatase and tensin(PTEN)homologinduced putative kinase 1(PINK1)and dynamin-related proteinⅠ(DRP1)was determined by Western blotting.RESULTSMore than 95%of the cultured cells expressed vascular endothelial cadherin and herein were vascular endothelial cells.The MTT result showed that the cell survival of HUVECs was significantly decreased after incubation with CdTe QD(0.1-100 mg·L-1)for 24 h(P<0.05,P<0.01).CdTe QD also induced extensive fragmentation of the mitochondrial network.The results of JC-1 assay showed that CdTe QD(0.1-100 mg·L-1)caused the disruption of MMP.The percentage of HUVECs with higher MMP was reduced from(91.8±0.6)%in cell control group to(90.2±1.1)%,(84.4±0.9)%(P<0.05)and(78.1± 1.3)%(P<0.01),respectively.The Western blotting data suggested that CdTe QD 10 mg·L-1significantly increased the expression of autophagy-related protein beclin 1 and the ratio of LC3Ⅱ/LC3Ⅰ(P<0.05, P<0.01),CdTe QD 1 mg·L-1also raised the level of mitophagy-related proteins like PINK1 and DRP1.CONCULSlONCdTe QD can induce mitochondrial dysfunction as well as mitophagy in HUVECs.
CdTe quantum dots;human umbilical vein endothelial cells;mitochondria;autophagy; mitophagy
The project supported by National Natural Science Foundation of China(31401008);Zhejiang Provincial Natural Science Foundation(LY15H180012);Zhejiang Provincial Natural Science Foundation(LY17H060007); Zhejiang Provincial Natural Science Foundation(LY14C100004);and Key Social Development Project of Major Scientific and Technological Special Projects in Zhejiang Province(2014C03017)
YAN Ming,E-mail:yanming@hdu.edu.cn,Tel:(0571)86878667
R995
A
1000-3002-(2017)06-0574-07
2016-12-21接受日期:2017-01-24)
(本文编辑:乔虹)
国家自然科学基金(31401008);浙江省自然科学基金(LY15H180012);浙江省自然科学基金(LY17H060007);浙江省自然科学基金(LY14C100004);浙江省重大科技专项重点社会发展项目(2014C03017)
严明,女,博士,讲师,主要从事生物制造和微纳米材料生物相容性研究。
严明,E-mail:yanming@hdu.eud.cn,Tel:(0571)86878667

