梅花鹿鹿茸总蛋白对顺铂诱导肾损伤小鼠的保护作用及其机制
杨慧海,王露露,何晓凤,孙航,刘芳芳,张晶
(1.吉林农业大学中药材学院,吉林长春130118;2.长春科技学院医药学院,吉林长春130600)
梅花鹿鹿茸总蛋白对顺铂诱导肾损伤小鼠的保护作用及其机制
杨慧海1,王露露2,何晓凤1,孙航1,刘芳芳2,张晶1
(1.吉林农业大学中药材学院,吉林长春130118;2.长春科技学院医药学院,吉林长春130600)
目的 研究梅花鹿鹿茸总蛋白(SVPr)对小鼠肾毒性的保护作用及其机制。方法40只ICR小鼠随机分为5组,即正常对照组(ig蒸馏水)、模型组(ig蒸馏水7 d,第7天ip给予顺铂25 mg·kg-1造模,随后ig蒸馏水3 d)及SVPr 5,10和20 mg·kg-1给药组(ig给予SVPr 7 d,末次给药2 h后ip给予顺铂25 mg·kg-1,随后ig给予SVPr治疗3 d)。用试剂盒方法测定小鼠肾功能指标尿素氮(BUN)和血肌酐(SCr),氧化应激反应指标超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽(GSH)和丙二醛(MDA)及炎症因子肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)水平,Western蛋白印迹法测定胱天蛋白酶3、促凋亡蛋白(Bax)和抗凋亡蛋白(Bcl-2)表达,HE染色观察肾组织病理变化。结果 SVPr 5,10和20 mg·kg-1可显著降低SCr,BUN,MDA,TNF-α和IL-6的水平及活化的胱天蛋白酶3和Bax表达(P<0.05,P<0.01),增加SOD,CAT和GSH的活性及Bcl-2的表达(P<0.05,P<0.01);改善肾组织病理变化。结论SVPr改善顺铂诱导的小鼠肾毒性,其机制与抑制氧化应激、炎症反应及细胞凋亡有关。
鹿茸总蛋白;顺铂;肾毒性;保护作用
DOl:10.3867/j.issn.1000-3002.2017.06.010
药物性肾损伤是指暴露于具有毒性或者潜在毒性药物之后,导致肾受到不同程度的损伤[1],其临床表现为尿检异常、肾病理结构异常和肾功能异常等[2]。目前,药物性肾毒性主要类型有急性肾损伤、急性肾衰竭、急性间质性肾病和肾病综合征等[3]。顺铂是常用的抗肿瘤药物,其抗瘤谱广,抗癌活性高[4-5]。但其在抗癌的同时,具有药物肾毒性,引起急性肾损伤。因此,减小顺铂肾毒性成为研究热点。
中医理论认为,顺铂肾毒性属“药毒”、“肾虚”,其本质为肾精气不足[6]。顺铂在肾中高浓度的分布和长时间的积累,导致肾不同程度的损伤[7]。顺铂肾毒性的病理机制主要分为2方面:一是减少肾小球滤过率,升高血清中肌酐(creatinine,Cr)和尿素氮(blood urea nitrogen,BUN)含量[8];二是肾近端小管上皮细胞缺血甚至坏死[9]。组织病理学分析发现,顺铂能够严重损害肾组织结构,出现大面积坏死区域,细胞排列疏松,刷状缘消失,肾小球出现明显萎缩,肾小管空泡变性等。
顺铂肾毒性的分子机制复杂,大多数研究认为其机制与氧化应激反应、炎症反应和细胞凋亡等相关。顺铂诱导的氧化应激反应主要由2方面因素:一是诱导产生大量活性氧,二是抑制或减弱抗氧化酶的活性。顺铂诱导产生大量的氧自由基使细胞膜发生脂质过氧化反应,改变了膜的通透性,导致生物膜功能异常[10]。超氧化物歧化酶(super oxide dismutase,SOD)和过氧化氢酶(catalase,CAT)是常见的清除自由基的抗氧化酶,丙二醛(malondialdehyde,MDA)是反映脂质过氧化反应的常用指标[11]。炎症反应是顺铂肾毒性中另一种重要的分子机制,该机制与顺铂激活肿瘤坏死因子α(tumour necrosis factor alpha-α,TNF-α)有关,从而增加白细胞介素6(interleukin-6,IL-6)和IL-1分泌以及细胞间黏附分子1的表达,并且促进中性粒细胞黏附到肾内皮细胞产生大量的活性氧,引起肾损伤[12-13]。顺铂诱导的细胞凋亡反应机制主要表现为激活胱天蛋白酶3蛋白并调控促细胞凋亡基因Bax和抗凋亡基因Bcl-2的表达,导致细胞凋亡[14-15]。
《中华人民共和国药典》中记载,鹿茸具有壮肾阳、益精血的功效,能够治疗阳痿滑精、宫冷不孕、畏寒和筋骨疲软等症状[16]。现代药理学研究表明,鹿茸具有清除自由基、抗炎和抗肿瘤等作用[17-19],梅花鹿鹿茸(Cervus nippon temminck)水提取物对顺铂肾毒性有一定的改善作用[20-22]。本研究旨在探讨梅花鹿鹿茸中对顺铂肾毒性发挥保护作用的成分及其机制。
1 材料与方法
1.1 动物、细胞、试剂和仪器
梅花鹿二杠茸于2016年采购于吉林双阳鹿场,经吉林农业大学中药材学院张晶教授鉴定品种为梅花鹿鹿茸。鹿茸粉碎过80目筛,取鹿茸粉末50.0 g,按料液比1∶3加入蒸馏水,60℃,80 Hz条件下超声30 min,过滤,重复3次,合并提取液[23]。在提取液中加入95%乙醇使醇含量达80%(V/V)以上。4℃下静置24 h后,8000×g离心10 min,分别收集沉淀和上清液。上清液浓缩至无醇味后,冷冻干燥,得梅花鹿鹿茸总蛋白(sika deer velvet antler protein,SVPr),1 g鹿茸总蛋白相当于20 g药材。
雄性ICR小鼠40只,SPF级,体质量18~22 g,购自于长春市亿斯实验动物技术有限责任公司,动物许可证号为SCXK-(吉)2011-0007。动物饲养条件符合实验动物福利伦理委员会的要求,小鼠自由饮食饮水,室温23.0~25.0℃,湿度55%~65%,明暗交替12 h的环境中适应性饲养,每天更换垫料,适应性饲养1周。
顺铂(上海思域化工科技有限公司,纯度≥99%);Cr,BUN,MDA,谷胱甘肽(glutathione,GSH),CAT和SOD测定试剂盒,南京建成生物工程研究所;小鼠TNF-α和IL-6 ELISA试剂盒,上海朗顿生物科技有限公司;兔抗鼠胱天蛋白酶3、Bax、Bcl-2和β肌动蛋白单抗(一抗)及HRP标记山羊抗兔IgG抗体(二抗),北京博奥森生物技术有限公司;OTC冷冻包埋液,美国Sakura Finetek公司;其余化学试剂均为分析纯。
BP211D电子天平(万分之一),德国Switzerland公司;KQ-250DB数控超声清洗器,昆山超声波仪器有限公司;TGL-16G离心机,上海安亭科学仪器制造厂;冷冻切片机,德国Leica;SpectraMax Plu384续光谱扫描式酶标仪,美谷分子仪器有限公司;XSPBM-8CA生物显微镜,上海彼爱姆光学仪器制造有限公司;CO2培养箱,西班牙SELECTA公司;超净工作台,日本SANYO公司。
1.2 实验分组及处理
40只ICR小鼠随机分为5组。正常对照组,按小鼠体质量(0.01 mL·g-1)连续ig蒸馏水10 d;模型组,按小鼠体质量(0.01 mL·g-1)连续ig蒸馏水7 d后,第7天ig蒸馏水2 h后ip顺铂(25 mg·kg-1)造模,随后继续ig蒸馏水3 d;SVPr给药组分别按小鼠体质量(0.01 mL·g-1)连续7 d,ig给予SVPr 5,10和20 mg·kg-1,末次ig 2 h后,ip给予顺铂(25 mg·kg-1)致肾损伤,随后继续ig给予SVPr 3 d。所有小鼠第10天给药前12 h禁食不禁水,给药1 h后眼眶内静脉取血后麻醉处死。整个给药期间观察小鼠体质量变化及日常活动情况。
1.3 小鼠体质量变化、肾指数和肾功能测定
实验过程中,每天ig给药前记录小鼠体质量。实验结束后,计算各组小鼠体质量变化率。小鼠处死后立即取新鲜双侧肾组织去包膜脂肪称重,并计算肾指数=(肾质量/体质量)×100。
取血液样本2 mL,待血液凝固30 min后,3500×g离心取上清液。Cr采用肌氨酸氧化酶法测定,BUN采用脲酶法测定。
1.4 氧化应激指标的测定
冰浴状态下解剖小鼠,取双侧肾,去除肾被膜。左肾剪取肾皮质按1∶9比例加入冰浴0.9%NaCl溶液稀释研磨制备成10%匀浆组织液,在4℃下3500×g离心10 min,取上清液按照试剂盒的步骤进行肾组织匀浆中SOD,CAT,MDA和GSH含量的测定。
1.5 ELlSA测定血清和肾组织中TNF-α和lL-6的含量
采用ELISA测定小鼠血清和肾组织中TNF-α和IL-6水平的测定。按照试剂盒说明书操作,用酶标仪在450 nm波长处测定A450nm值,据标准曲线计算含量。
1.6 Western蛋白印迹法检测胱天蛋白酶3,Bax和Bcl-2表达
采用RIPA裂解液提取小鼠肾组织总蛋白,BCA试剂盒测定蛋白质浓度。在各组织样品中加入2×上样缓冲液,沸水煮10 min,将组织蛋白变性。然后,采用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳将组织样本进行分离后,在80 V,60 min条件下进行转膜。将转好的PVDF膜,用PBST洗净放入5%脱脂奶粉中进行封闭,4℃过夜后,取出膜用PBST溶液洗净,进行一抗(胱天蛋白酶3,1∶1000;Bax,1∶500;Bcl-2,1∶500;β肌动蛋白,1∶500)室温孵育2 h,用PBST溶液进行洗膜,重复3次,每次10 min。将洗净的PVDF膜,进行二抗(1∶1000)室温孵育2 h,用PBST溶液洗膜,重复3次,每次10 min。最后,用ECL显色试剂盒进行显色,用Image J分析软件进行积分吸光度值分析。
1.7 HE染色观察组织病理变化
冰浴状态下解剖小鼠,取双侧肾,去除肾被膜。将新鲜的右肾修剪成大小为4 mm×3 mm×3 mm组织块,立刻用OTC冷冻包埋剂进行包埋,放入-20℃冷冻切片机中进行固定。然后将固定好的组织进行切片,厚度6 μm。将切好的肾组织切片按照HE染色步骤进行染色,然后用中性树胶封片,用光学显微镜分别在100和400倍显微镜下观察肾组织病理学变化。病理标本进行编号,每组随机选取3个标本在光学显微镜下随机选取8个视野,根据损伤程度进行评分。0分:无损伤;1分:肾小管上皮肿胀,出现炎症细胞浸润;2分:肾小管出现大面积炎症细胞浸润,管腔扩张;3分:肾小管上皮细胞核染色消失;4分:肾小管结构破坏,上皮细胞核无着色。利用Ridit软件分析结果 。
1.8 统计学分析
实验结果 数据采用x±s表示,用SPSS 17.0统计软件进行分析,各组间均数比较采用单因素方差分析(ANOVA),组间比较用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SVPr对顺铂诱导肾损伤小鼠体质量、肾指数和肾功能的影响
表1所示,与正常对照组相比,模型组造模后体质量及其造模前后的变化和肾指数均显著增加(P<0.05),表明顺铂对小鼠肾有损伤作用,造模成功。与模型组相比,经过SVPr 5,10和20 mg·kg-1治疗后,能够明显改善小鼠体质量和肾指数的变化(P<0.05)。
与正常对照组相比,模型组小鼠血清Cr和BUN含量显著升高(P<0.01),说明肾小球过滤功能严重紊乱,肾严重受损;与模型组相比,不同剂量的SVPr给药组均能明显减少血清Cr和BUN的含量(P<0.05,P<0.01),但均未恢复到正常水平(图1)。
2.2 SVPr对顺铂诱导肾损伤小鼠肾组织氧化应激反应的影响
与正常对照组相比,模型组小鼠肾组织中SOD和CAT的活性和GSH的含量显著降低(P<0.01),MDA含量明显升高(P<0.05)。与模型组相比,经不同剂量的SVPr治疗后,小鼠肾组织中SOD和CAT活性和GSH含量显著提高(P<0.05),而10和20 mg·kg-1组MDA水平明显减少(P<0.05,P<0.01),5 mg·kg-1组MDA含量无明显变化(图2)。

Tab.1 Effect ofsika deer velvetantler protein(SVPr)on body mass and kidney index of mice with kidney injury induced by cisplatin
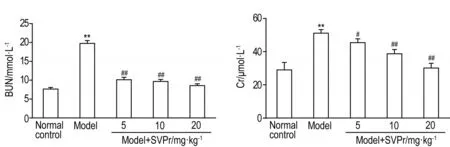
Fig.1 Effect of SVPr on serum urea nitrogen(BUN)and creatinine(Cr)levels of mice with kidney injury induced by cisplatin.See Tab.1 for the mouse treatment.x±s,n=6.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
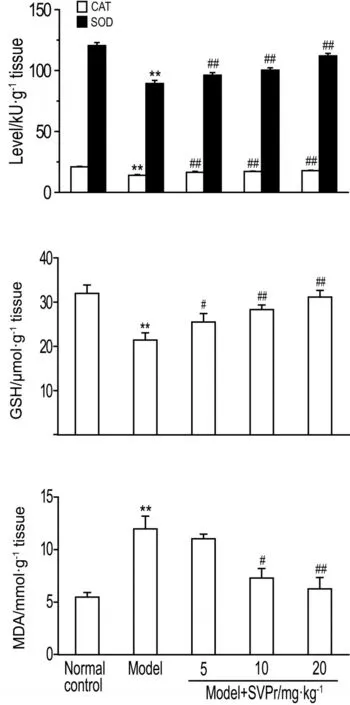
Fig.2 Effect of SVPr on catalase(CAT),superoxide dismutase(SOD),glutathione(GSH)and malondialdehyde(MDA)of mice with kidney injury induced by cisplatin.See Tab.1 for the mouse treatment.x±s,n=6.**P<0.01, compared with normal control group;#P<0.05,##P<0.01,compared with model group.
2.3 SVPr对顺铂诱导肾损伤小鼠肾组织中TNF-α和lL-6水平的影响
与正常对照组相比,模型组小鼠血清和肾组织中TNF-α和IL-6水平明显升高(P<0.05)。与模型组相比,不同剂量的SVPr给药组小鼠血清和肾组织中TNF-α和IL-6水平明显减少(P<0.05,P<0.01),但均未恢复到正常水平(图3)。
2.4 SVPr对顺铂诱导肾损伤小鼠肾组织细胞凋亡相关蛋白表达的影响
与正常对照组相比,模型组小鼠肾组织中活化的胱天蛋白酶3和Bax蛋白表达明显增加(P<0.01),Bcl-2的表达显著下降(P<0.01)。与模型组相比,不同剂量的SVPr给药组小鼠肾组织中活化的胱天蛋白酶3和Bax表达明显下降(P<0.05),抗凋亡蛋白Bcl-2表达升高(P<0.01),但均未恢复到正常水平(图4)。
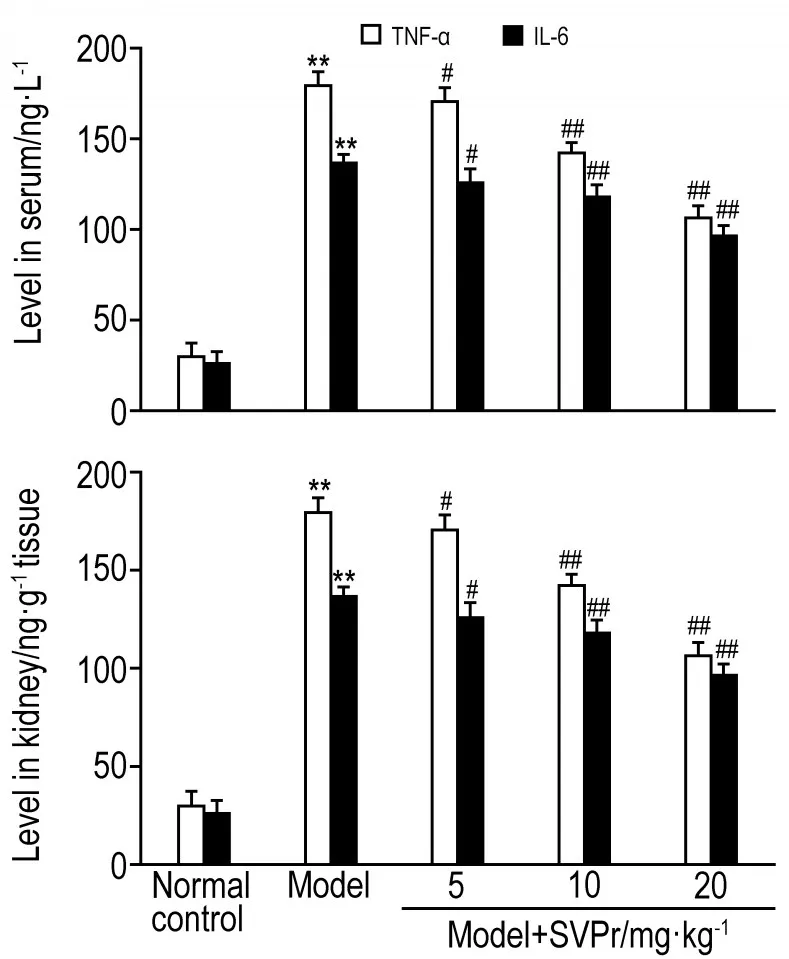
Fig.3 Effect of SVPr on tumour necrosis factor-α(TNF-α )and interleukin-6(lL-6)in serum and kidney of mice with kidney injury induced by cisplatin.See Tab.1 for the mouse treatment.x±s,n=6.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.

Fig.4Effect of SVPr on expression of apoptosisrelated proteins of mice with kidney injury induced by cisplatin.See Tab.1 for the mouse treatment.x±s,n=6.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group.
2.5 SVPr对顺铂诱导肾损伤小鼠肾组织病理变化的影响
用光学显微镜分别在100和400倍镜下观察。与正常对照组相比,模型组小鼠肾小管腔出血,肾小管空泡变性,上皮细胞脱落和变性坏死以及肾小球皱缩等。与模型组相比,SVPr给药组小鼠肾病理变化均有所改善,但均未恢复到正常对照组水平(图5)。根据Ridit分析可知,与正常对照组相比,模型组肾小管坏死程度等级提高,SVPr治疗组与模型组相比,坏死等级降低(表2)。
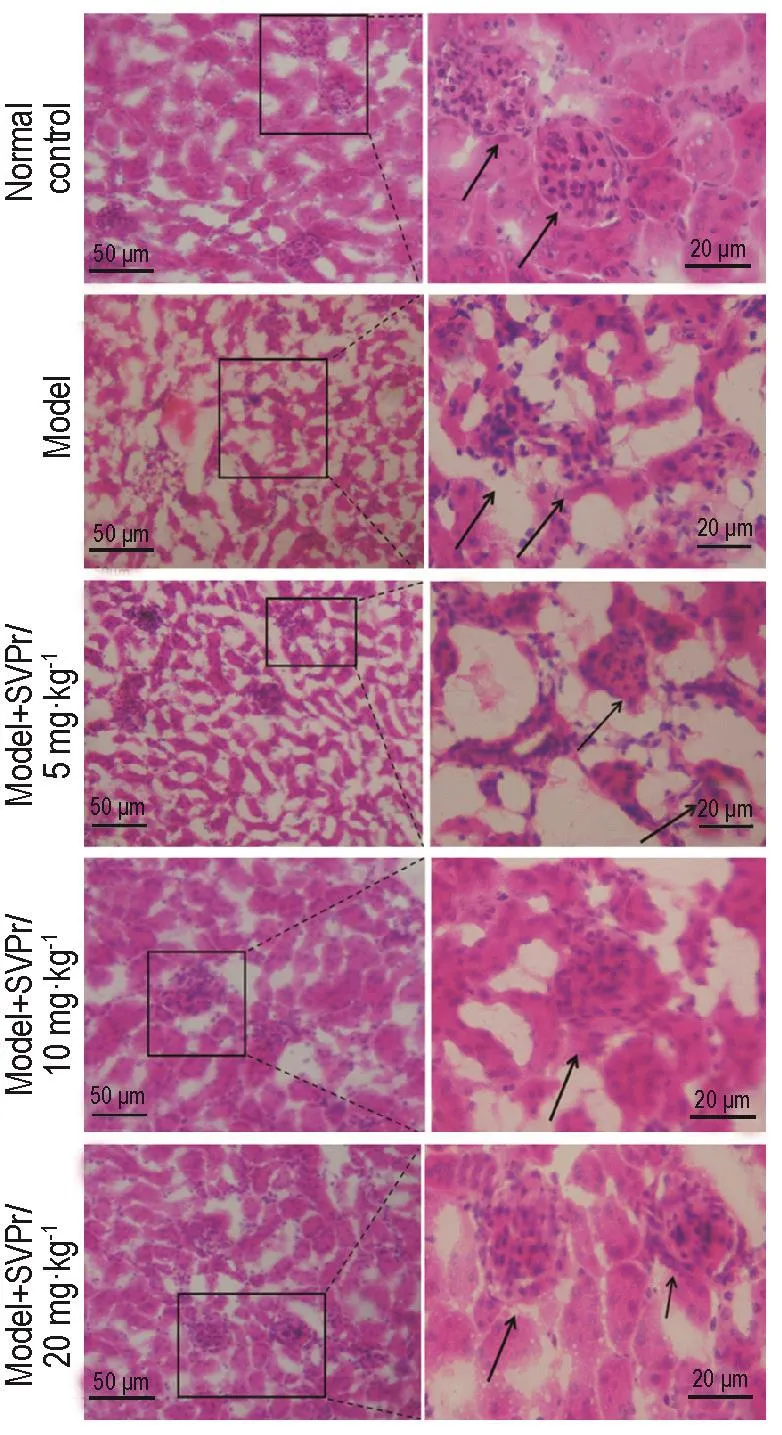
Fig.5 Effect of SVPr on histopathological changes of kidney of mice with kidney injury induced by cisplatin.See Tab.1 for the mouse treatment.There was acure tubular epithelial cell necrosis,cellular vacuolization and cast formationin in model gorup.Cisplatin-induced histopathological changes were significantly attenuated in SVPr groups.Arrows show the structure of glomerulus.
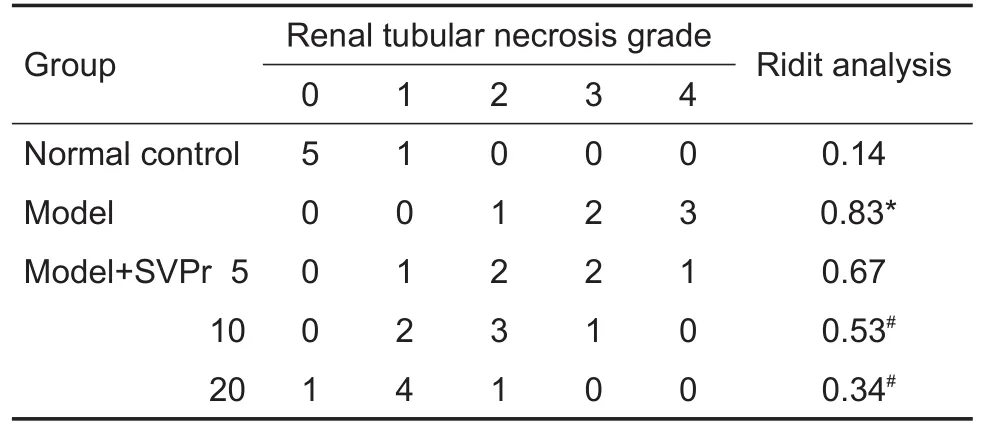
Tab.2 Effect of SVPr on renal tubular necrosis grade of mice with kidney injury induced by cisplatin
3 讨论
本研究结果 表明,顺铂25 mg·kg-1显著诱导小鼠血清中Cr和BUN水平升高,同时肾组织中SOD,CAT和GSH水平显著降低,MDA水平升高。经SVPr治疗后,血清中Cr和BUN水平降低,肾中SOD,CAT和GSH水平升高,MDA水平降低。由此提示,SVPr治疗后,顺铂所致的小鼠肾功能和氧化应激反应得到不同程度的恢复。ip给予顺铂诱导急性肾损伤模型小鼠血清和肾组织中TNF-α和IL-6水平明显升高;经SVPr治疗后,血清和肾组织中TNF-α和IL-6水平显著降低,表明SVPr能够通过抑制炎症反应发挥肾保护作用。Western蛋白印迹法结果 显示,顺铂诱导急性肾损伤小鼠肾组织中活化的天胱蛋白酶3和Bax表达明显增加,Bcl-2表达显著下降;经SVPr治疗后,细胞凋亡相关蛋白的表达均有所改善,但均未恢复到正常水平,表明SVPr能够通过抑制细胞凋亡相关蛋白的表达发挥肾保护作用。HE染色观察小鼠肾组织病理变化,结果 表明,SVPr对顺铂诱导的肾组织损伤具有改善作用。
综上所述,SVPr能够改善顺铂诱导的小鼠肾毒性,其作用机制与抑制肾组织氧化应激反应、炎症反应和细胞凋亡有关。
[1]Mehta RL,Kellum JA,Shah SV,Molitoris BA,Ronco C,Warnock DG,et al.Acute Kidney Injury Network:report of an initiative to improve outcomes in acute kidney injury[J].Crit Care,2007,11(2):R31.
[2]Sun HO,Hu WX.The mechanism and clinical expression of drug-induced renal damage[J].J Nephrol Daly Tansplant(肾脏病与透析肾移植杂志),2006,15(3):252-257.
[3]Jennette JC,Olson JL,Schwartz MM,Silva FG.Heptinstall′s Pathology of the Kidney[M].Sixth ed. Philadelphia:Lippincott Williams&Wilkins,USA,2007:20-25.
[4]Zhang P,Lyu MY,Liu Q,Bai RZ,Zhang ZJ,Xu FG. Advances in research on the effects of traditional Chinese medicines on platinum antitumor drugs[J].Prog Pharm Sci(药学进展),2013,37(5):207-214.
[5]Weiss RB,Christian MC.New cisplatin analogues in development:a review[J].Drugs,1993,46(3):360-377.
[6]Yu JZ.Astragaluscause renal damage againstDDP search progress[J].China Prac Med(中国实用医药),2010,5(32):220-221.
[7]Eljack ND,Ma HY,Drucker J,Shen C,Hambley TW,New EJ,et al.Mechanisms of cell uptake and toxicity of the anticancer drug cisplatin[J].Metallomics,2014,6(11):2126-2133.
[8]Li Q,Bowmer CJ,Yates MS.The protective effect of glycine in cisplatin nephrotoxicity:inhibition with NG-nitro-L-arginine methyl ester[J].J Pharm Pharmacol,1994,46(5):346-351.
[9]Safirstein R,Winston J,Moel D,Dikman S,Guttenplan J.Cisplatin nephrotoxicity:insights into mechanism[J].Int J Androl,1987,10(1):325-346.
[10]Li Z,Gao LP.The role of oxidative stress in cisplatin nephrotoxicity[J].Guangdong Med J(广东医学),2010,31(19):2600-2602.
[11]Guo Y,Liu Y,Xu LG,uo MY.Protective effect of amifostine on cisplatin-induced nephrotoxicity and its mechanism[J].Chin J Oncol(中华肿瘤杂志),2006,28(1):8-12.
[12]Sun XR,Zhang YN,Chen YC,Qi F,Luo Z,Li RN,et al.Effects of NF-κB inhibitor PDTC on nephrotoxicity of cisplatin[J].J Dalian Med Univ(大连医科大学学报),2011,33(2):131-133.
[13]Li CG,Gao HK,Sun ZP,Luo SH,Yang M,Hao WY,et al.Changes and significance of neutrophils in acute nephrotoxicity induced by high-dose cisplatin in mice[J].J Dalian Med Univ(大连医科大学学报),2011,33(2):111-115.
[14]Liu L,Yang C,Herzog C,Seth R,Kaushal GP. Proteasome inhibitors prevent cisplatin-induced mitochondrial release of apoptosis-inducing factor and markedly ameliorate cisplatin nephrotoxicity[J].Biochem Pharmacol,2010,79(2):137-146.
[15]Hong JY,Kim GH,Kim JW,Kwon SS,Sato EF,Cho KH,et al.Computational modeling of apoptotic signaling pathways induced by cisplatin[J].B MC Syst Biol,2012,6:122.
[16]National Pharmacopoeia Commission.Pharmacopoeia of the People′s Republic of China(中华人民共和国药典)[M].Beijing:China Medcine Science and Technology Press,2015:324-325.
[17]Zhao L,Luo YC,Wang CT,Ji BP.Antioxidant activity of protein hydrolysates from aqueous extract of velvet antler(Cervus elaphus)as influenced by molecular weight and enzymes[J].Nat Prod Commun,2011,6(11):1683-1688.
[18]Suh SJ,Kim KS,Lee AR,Ha KT,Kim JK,Kim DS,et al.Prevention of collagen-induced arthritis in mice by Cervus korean Temminck var.mantchuricus Swinhoe[J].Environ Toxicol Pharmacol,2007,23(2):147-153.
[19]Tang Y,Jeon BT,Wang Y,Choi EJ,Kim YS,Hwang JW,et al.First evidence that sika deer(Cervus nippon)velvet antler extract suppresses migration of human prostate cancer cells[J]. Korean J Food Sci Anim Resour,2015,35(4):507-514.
[20]Wang JY,Wang LL,Li B,Liu FF,Sun CB,Zhang J. Effect of velvet antler on human embryonic kidney cell injury induced by cisplatin[J].J Jilin Agric Univ(吉林农业大学学报),2015,37(6):694-697,714.
[21]Dong SM,Wang HL,Wang QK,Zhang J.Protective effect of aqueous extract of velvet antler on cisplatin-induced nephrotoxicity in mice[J].Chin J Pathophysiol(中国病理生理杂志),2016,32(8):1466-1470.
[22]Li CM,Zhao Y,Ruan YX,Liu SY,Zhu ZJ.Protective effect of carvedilol on acute renal failure induced by cisplatin in rats[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2007,21(5):434-437.
[23]Yang YL,Yuan ML,Chen LL,Bai CQ,Zhao L,Shi L,Su W.Water-soluble proteins from Corbicula fluminea:optimization of ultrasound-assisted extraction process by response surface analysis and antioxidant potential[J].Food Sci(食品科学),2015,36(6):96-102.
(本文编辑:贺云霞)
欢迎订阅2017年《中国药理学与毒理学杂志》
《中国药理学与毒理学杂志》是由中国药理学会、中国毒理学会和军事医学科学院毒物药物研究所共同主办的高级学术性刊物,1986年创刊,2016年由双月刊改为月刊。被北大图书馆评为药学专业中文核心期刊(中文核心期刊要目总览),同时还是中国核心科技期刊、中国学术核心期刊和中国生物医学核心期刊等。本刊被美国《生物学文摘(预评)》(BAP)和美国《化学文摘》(CA)等十余家数据库收录。
《中国药理学与毒理学杂志》设有前沿论坛、论著、实验方法和综述栏目。读者对象主要为从事药理学、毒理学、药学、医学和生物基础科学研究的工作者。本刊中英文稿件兼收,更欢迎投英文稿件。
本刊全年12期,每期定价20.00元。国内外公开发行,国内邮发代号:82-140,国外邮发代号:BM-1051。本刊主要通过邮局订阅,也可以联系编辑部商谈杂志订阅事宜。
地址:北京市海淀区太平路27号六所《中国药理学与毒理学杂志》编辑部
邮编:100850
电话:(010)68276743,(010)66931617
E-mail:cjpt518@163.com
网址:http://www.cjpt.ac.cn
Protective effect of Sika deer velvet antler protein on cisplatin-induced kidney injury
YANG Hui-hai1,WANG Lu-lu2,HE Xiao-feng1,SUN Hang1,LIU Fang-fang2,ZHANG Jing1
(1.College of Traditional Chinese Medicine,Jilin Agricultural University,Changchun 130118,China; 2.Medicinal College,Changchun Science-Technology University,Changchun 130600,China)
OBJECTlVETo investigate the protective effect of Sika deer velvet antler protein(SVPr)against renal toxicity in mice and its mechanism.METHODSForty ICR mice were randomly divided into 5 groups:normal control group(ig distilled water),model group(ig distilled water for 7 d,on the 7thday,ip cisplatin 25 mg·kg-1to establish the model,afterwards ig distilled water for 3 d)and SVPr 5,10 and 20 mg·kg-1groups(ig SVPr for 7 d,cisplatin 25 mg·kg-1was provided 2 h after the last administration,then ig SVPr for 3 d).Testing kits were adopted for the measurement of renal indexes in mice,such as blood urea nitrogen(BUN)and serum creatinine(SCr);oxidative stress indictors of super oxide dismutase(SOD),catalase(CAT),glutathione(GSH)and malondialdehyde(MDA);inflammation indictor levels of tumor necrosis factor-α(TNF-α)and interleukin-6(IL-6).Caspase 3,Bax and Bcl-2 were detected via Western blotting,and renal pathological changes were observed by HE staining.RESULTSSVPr(5,10 and 20 mg·kg-1)significantly reduced the levels of SCr,BUN,MDA,TNF-α and IL-6,and the expressions of caspase 3 and Bax(P<0.05),but increased the activities of SOD,CAT and GSH,and the expression of Bcl-2(P<0.05).The renal pathological changes were improved.CONCLUSlONSVPr can reduce renal toxicity induced by cisplatin in mice,and the mechanism is probably related to inhibiting oxidative stress or inflammatory reaction and improving cell apoptosis.
Sika deer antler protein;cisplatin;nephrotoxicity;renal protection
The project supported by Science and Technology Development Program of Jilin Province(20160204004YY)
ZHANG Jing,E-mail:zhjing0701@163.com,Tel:(0431)84533358;LIU Fang-fang,E-mail: 153085289@qq.com,Tel:(0431)84533087
R285
A
1000-3002(2017)06-0561-07
2017-03-10接受日期:2017-05-31)
吉林省科技发展计划项目(20160204004YY)
杨慧海,男,硕士研究生,主要从事天然产物开发研究。
张晶,E-mail:zhjing0701@163.com,Tel:(0431)84533358;刘芳芳,E-mail:153085289@qq.com,Tel:(0431)84533087

