组织芯片技术在乳腺癌HER2 FISH检测中的可靠性分析
陈玉娟,张伟璇,朱桂璐,张 伟
(皖南医学院弋矶山医院病理科,芜湖 241001;*通讯作者,E-mail:weisky1981@163.com)
组织芯片技术在乳腺癌HER2 FISH检测中的可靠性分析
陈玉娟,张伟璇,朱桂璐,张 伟*
(皖南医学院弋矶山医院病理科,芜湖 241001;*通讯作者,E-mail:weisky1981@163.com)
目的 探讨乳腺癌组织芯片HER2 FISH检测结果的可靠性。 方法 收集192例乳腺癌病例,制成直径0.9 mm的组织芯片,进行HER2 FISH检测,对照常规石蜡切片的检测结果,进行统计学分析。 结果 组织芯片中HER2 FISH的阳性率为25.0%(48/192),常规石蜡切片的阳性率为26.0%(50/192),配对χ2检验显示两组之间差异无统计学意义(P>0.05)。有4例乳腺癌病例存在检测结果的不一致,其中常规石蜡切片检测为点状扩增病例中有3例组织芯片检测为阴性,常规石蜡切片检测为无扩增病例中有1例组织芯片检测为点状扩增。 结论 组织芯片技术在乳腺癌HER2 FISH检测中的可靠性强,但对于临床中乳腺癌病例建议使用常规石蜡切片进行HER2 FISH检测。
组织芯片; 乳腺癌; HER2; FISH
Analysis of the reliability of tissue microarrays in the research of HER2 FISH detection of breast cancer
CHEN Yujuan,ZHANG Weixuan,ZHU Guilu,ZHANG Wei*(DepartmentofPathology,YijishanHospital,WannanMedicalCollege,Wuhu241001,China;*Correspondingauthor,E-mail:weisky1981@163.com)Abstract:ObjectiveTo explore the reliability of tissue chip in the research of human breast cancer HER2 FISH detection.MethodsTissue microarray(TMA) with 0.9 mm in diameter tissue core was constructed from 192 cases of human breast cancer.HER2 was detected by FISH technique.At the same time the results of the tissue microarrays were compared with those of the routine paraffin section.ResultsThe positive rates in HER2 FISH detection of breast cancer were 25.0% and 26.0% by TMA and the routine paraffin section,respectively,and there was no statistical difference(P>0.05).But the results of 4 cases were different between the two methods.Three cases of dot expansion using the routine paraffin section were negative by TMA,and 1 case of dot expansion using TMA showed no expansion by the routine paraffin section.ConclusionTissue microarrays could be a reliable tool in the application of human breast cancer HER2 FISH detection,but it is better to use the routine paraffin section in the clinical.Key words: tissue microarrays; breast cancer; HER2; FISH
组织芯片(tissue chip,TC)即微缩组织切片,是将多量组织标本高密度排列成组织微阵列(tissue microarrays,TMA)的形式,具有体积小、信息量大的特点,一次实验即可获得大量结果。1998年Kononen等[1]首次在Nature杂志上报道了这一高通量生物芯片技术。与传统方法相比较,组织芯片具有实验条件一致性强、误差性小和准确性高的优点。但组织芯片本身制作过程冗繁,缺乏标准化流程。乳腺癌HER2 FISH检测已经成为一种常规病理工作,能否对多例乳腺癌标本利用组织芯片技术进行HER2 FISH检测是一项具有实际临床意义的工作。本研究参阅文献资料,对组织芯片的制作流程进行优化,制备出高质量的乳腺癌组织芯片,再探讨组织芯片技术在乳腺癌HER2 FISH检测中的可靠性,以期为临床病理工作提供帮助。
1 资料和方法
1.1 病例来源
调取皖南医学院弋矶山医院病理科2012-11~2016-11的所有行常规石蜡切片HER2 FISH检测的乳腺癌病例,共214例,其中男性1例,女性213例,年龄25-75岁,平均49.9岁;其中包括HER2基因簇状扩增38例,HER2基因点状扩增17例,HER2基因无扩增159例。
1.2 组织芯片的制作
1.2.1 空白蜡块制作 将徕卡石蜡(Leica Histowax)与62-67 ℃纯蜂蜡(上海华申康复器材厂)混合(比例为2 ∶8),98 ℃温箱内融化50 min,去除底部沉渣,用蜡块制作模具制成34 mm×24 mm×10 mm大小空白蜡块。
1.2.2 受体蜡块制作 先用直尺和刀片在空白蜡块上画格,横竖间距均为2 mm,距边缘约3 mm,置65 ℃温箱约5 min(使受体蜡块受热稍软化),再应用组织微阵列制作仪(北京博医康医疗仪器有限公司),在已画好的方格内打孔,每个微孔的直径为0.9 mm,深约3 mm,制作成6×8 阵列的受体蜡块。
1.2.3 供体蜡块的取样及点样 先用显微镜观察常规石蜡HE切片并标记肿瘤组织,以切片的标记处作为供体蜡块的取样位点,再用组织芯片仪钻取出该处肿瘤组织,按顺序依次放入受体蜡块的孔内。受体蜡块左上角的第1个孔内放肝组织为坐标,同时在笔记本上绘制网格图,记录下每个网格内标本病理号。
1.2.4 融蜡 将制作好的受体蜡块(组织面朝上)再次放进蜡块制作模具中将其固定住,放入65 ℃温箱30 min,受体蜡可逐渐溶解浸润于组织芯周围,将受体蜡块取出室温稍冷却,将组织面朝下置于模具的铁板上,用另一铁板轻压使组织面平整;再将其置于冰箱冷冻后取出切片,切片过程与常规石蜡组织切片基本相同。
1.3 HER2 FISH检测方法
对制好的乳腺癌组织芯片受体蜡块进行双探针HER2荧光原位杂交染色,预杂交液代替杂交液为阴性对照。步骤如下:将组织芯片受体蜡块切成3-4 μm厚白片,切好的白片放入60 ℃烤箱烘烤2 h,常规脱蜡;使用3%H2O2甲醇溶液室温湿盒内孵育15 min,消除内源性过氧化物酶活性,阻断背景中非特异性染色;再用蒸馏水(pH7.0)冲洗3次×3 min;滴加蛋白酶K室温湿盒内孵育15 min(同时运用荧光显微镜观察细胞消化程度),使蛋白成分消化而充分暴露细胞核及DNA片断;使用原位杂交专用PBS(pH7.4)冲洗3次×5 min,蒸馏水冲洗2次×3 min;滴加预杂交液,将湿盒置入38 ℃水浴孵育3 h,阻断背景非特异性染色;去除多余液体,滴加杂交液,原位杂交专用盖玻片封盖组织,将湿盒放入38 ℃水浴孵育过夜;揭去盖玻片,37 ℃ 2×SSC缓冲液冲洗2次×5 min,37 ℃ 0.5×SSC缓冲液冲洗1次×15 min,最后用37 ℃ 0.2×SSC缓冲液冲洗2次×5 min;滴加封闭液,操作完成。乳腺癌HER2 FISH 检测试剂盒购自广州安必平医药科技股份有限公司。
1.4 结果判定
荧光显微镜下观察HER2基因拷贝数与17号染色体的比值,判定标准参照文献[2]。HER2/CEP17≥2.0或HER2/CEP17<2.0但是HER2平均拷贝数>6判为阳性,HER2/CEP17<2.0判为阴性。
1.5 统计学分析
应用 SPSS 13.0 统计软件包进行处理,采用配对χ2检验,P<0.05认为差异有统计学意义。
2 结果
2.1 组织芯片石蜡块及切片染色
所制备的组织芯片石蜡块共6个,均行HE切片染色及原位杂交检测,观察芯片的脱片率。脱片率为芯片脱落的点数与标本总点数的比值。HE染色切片脱片率为9.35%(20/214);FISH检测脱片率为10.3%(22/214),FISH检测时脱片的22例包括18例无扩增和4例扩增(3例簇状扩增及1例点状扩增)(见图1)。从组织芯的脱片率来看,普通石蜡与纯蜂蜡比例为2 ∶8优于比例8 ∶2。
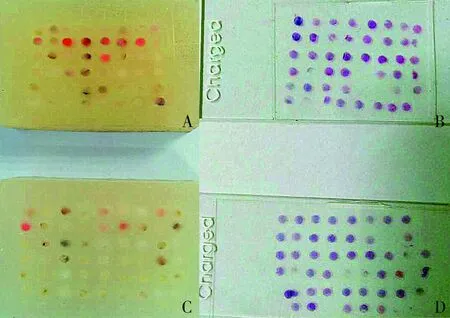
A,B.普通石蜡与纯蜂蜡比例为2 ∶8制成6×8 阵列的组织芯片蜡块及HE切片;C,D.普通石蜡与纯蜂蜡比例为8 ∶2制成6×9 阵列的组织芯片蜡块及HE切片图1 乳腺癌组织芯片及HE染色Figure 1 Microarrays of tissue chip and HE staining of breast cancer tissues
2.2 组织芯片与常规石蜡切片HER2 FISH检测结果比较
常规石蜡切片FISH检测为簇状扩增的38例乳腺癌经组织芯片检测后均为簇状扩增;常规石蜡切片FISH检测为无扩增的141例乳腺癌组织芯片检测后140例为无扩增,其中1例两者检测结果不一致(见图2)。192例乳腺癌组织芯片中HER2 FISH的阳性率为25.0%(48/192),常规石蜡切片的阳性率为26.0%(50/192),采用配对χ2检验P=0.625,依据α=0.05的水准,两者之间差异无统计学意义(P>0.05),提示组织芯片与常规石蜡切片FISH检测结果基本一致。
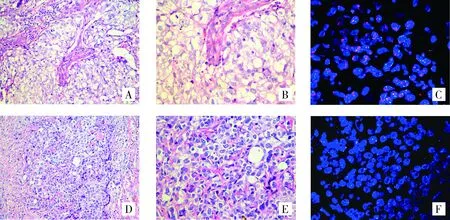
A.常规石蜡切片(HE染色,×200);B.组织芯片(HE染色,×400);C.组织芯片HER2基因簇状扩增(FISH法);D.常规石蜡切片(HE染色,×200);E.组织芯片(HE染色,×400);F.组织芯片HER2基因无扩增(FISH法)图2 乳腺癌常规石蜡切片和组织芯片HE染色及HER2 FISH检测Figure 2 The routine paraffin section and tissue microarray for breast cancer by HE staining and HER2 FISH test
3 讨论
1986年Battifora等[3]制造出组织芯片的前身,即多组织块和多组织片,是将100多个各类小组织包埋在同一个蜡块里,然后切片,再将切片裱于普通玻片而制成。1998年Kononen等[1]首次采用组织芯片机,通过钻洞取样的方法,将645个乳腺癌蜡块制成了组织芯片用于免疫组织化学检测。此后,组织芯片已在多种肿瘤中得到应用[4-7]。可以根据不同的需要制成正常组织芯片和肿瘤组织芯片等不同类型的芯片,还可以对其进行HE染色、组织化学染色、免疫组织化学检测及荧光原位杂交检测等不同的检查,在教学、科研及室内质控等方面的体现出重要价值。
组织芯片的制作方法灵活多样,本研究对组织芯片的制作过程进行了适当优化后提高了组织芯片的完成质量。在制作受体蜡块时,比较了普通石蜡与纯蜂蜡不同比例(比例为8 ∶2及2 ∶8)及不同组织密度(6×9 阵列及6×8 阵列)制成的组织芯片蜡块及HE切片的效果,最终认为使用普通石蜡与纯蜂蜡比例为2 ∶8制成6×8 阵列的组织芯片蜡块及HE切片效果较好。若普通石蜡含量高,受体蜡块在组织芯片制作过程中易裂开;若使用纯蜂蜡,制作组织芯片时受体蜡块极易变形扭曲。在室温较低的季节(冬春季节)在受体蜡快打孔前,可将其放于温箱稍加温后再进行制作,可有效防止受体蜡块的开裂现象,并且在打孔过程中可反复使用该方法,注意加温的时间不宜过长,否则受体蜡块会融化变形。本实验中HE切片及FISH检测中均有不同程度的组织位点脱片的现象,经过仔细观察发现,多数是由于组织芯位点低于受体蜡块表面,导致切片时无法将其切到;少数是由于供体组织本身固定不佳等原因导致捞片时组织卷曲或掉片。
随着乳腺癌赫赛汀靶向治疗的应用,越来越多的乳腺癌患者需要进行HER2 FISH检测,目前临床中主要是对常规石蜡切片进行FISH检测,但往往组织块大,消耗试剂多,同时暗室阅片花费的人力也大大增加。是否可以使用组织芯片技术对需要行HER2 FISH检测的一组乳腺癌同时进行检测?本实验对192例的乳腺癌组织芯片进行HER2 FISH检测,与常规石蜡切片的HER2 FISH检测结果进行比较,经χ2检验发现两种方法的检测结果差异无统计学意义,表明组织芯片与常规石蜡切片检测结果基本一致。常规石蜡切片的阳性率26.0%(50/192)略高于组织芯片25.0%(48/192),对于常规石蜡切片检测为簇状扩增病例,组织芯片的检出结果与其完全一致;对于常规石蜡切片检测为点状扩增病例中有3例组织芯片检测为阴性,回顾原常规石蜡切片的诊断报告,此3例常规石蜡切片HER2/CEP17的比值分别为2.02,2.14及2.23;对于常规石蜡切片检测为无扩增病例中有1例组织芯片检测为点状扩增,回顾常规石蜡切片HER2/CEP17的比值为1.88;综合分析,两者检测结果不一致的4个病例的HER2/CEP17的比值均是位于2.0附近,导致结果不一致的重要的原因可能是肿瘤组织的异质性。Moch等[8]曾对组织异质性的影响进行了组织芯片与常规石蜡切片对比性研究,其研究结果确实显示出一定的差异,他强调组织芯片是用于检查肿瘤群体,而不是个体。
组织芯片技术虽然具有常规石蜡切片无法比拟的优点,如体积小、数量多、检测结果的可靠性强,信息量大,效率高,消耗试剂少等,在科研方面显示出无比的优越性;但是组织芯片也具有一定的局限性,它无法回避肿瘤组织的异质性问题,对于临床个体的肿瘤患者目前还不推荐使用组织芯片技术进行乳腺癌HER2 FISH检测,以免给患者的治疗造成严重的后果。
[1] Kononen J,Bubendorf L,Kallioniemi A,etal.Tissue microarrays for high-throughput molecular profiling of tumor specimens[J].Nat Med,1998,4(7):844-847.
[2] 乳腺癌HER2检测指南(2014版)编写组.乳腺癌HER2检测指南(2014版)[J].中华病理学杂志,2014,43(4):262-267.
[3] Battifora H.The multitumor (sausage) tissue block: novel method for immunohistochemical antibody testing[J].Lab Invest,1986,55(2):244-248.
[4] 秦广琪,魏巧,顾燕子,等.一种简便易行的组织芯片制作技术[J].中国癌症杂志,2015,25(9):683-686.
[5] Aparicio LM,Villaamil VM,Gallego GA,etal.Expression of Notch 1 to 4 and their ligands in renal cell carcinoma: a tissue microarray study[J].Cancer Genomics Proteomics,2011,8(2):93-101.
[6] 李锐,叶胜兵,时姗姗.荧光原位杂交技术在组织芯片中的应用[J].中华病理学杂志,2016,45(1):51-52.
[7] 刘银华,张修稳,卢林明,等.改良组织芯片技术在胃癌研究中的应用及体会[J].皖南医学院学报,2012,31(2):112-115.
[8] Moch H,Kononen J,Kallioniemi OP,etal.Tissue microarrays: what will they bring to molecular and anatomic pathology?[J].Adv Anat Pathol,2001,8(1):14-20.
陈玉娟,女,1982-04生,本科,技师,E-mail:326432487@qq.com
2017-02-24
R737.9
A
1007-6611(2017)06-0632-04
10.13753/j.issn.1007-6611.2017.06.027

