黄连素对Aβ诱导的大鼠抑郁行为的缓解作用及其相关机制
牛玉虎,郭国英,弓 韬,张 栋,王惠珍
(山西医科大学生物化学与分子生物学实验室,太原 030001;*通讯作者,E-mail:niuyuhu_8905@163.com)
黄连素对Aβ诱导的大鼠抑郁行为的缓解作用及其相关机制
牛玉虎*,郭国英,弓 韬,张 栋,王惠珍
(山西医科大学生物化学与分子生物学实验室,太原 030001;*通讯作者,E-mail:niuyuhu_8905@163.com)
目的 探讨黄连素侧脑室注射对β淀粉样蛋白引起大鼠的抑郁焦虑行为的缓解作用及其可能机制。 方法 60只大鼠随机分为对照组、Aβ组、低剂量黄连素治疗组、高剂量黄连素治疗组和氟西汀阳性对照组,每组12只,行为学试验检测各组大鼠抑郁焦虑行为,ELISA测定血浆皮质醇和促肾上腺皮质素含量。体外培养的原代星形胶质细胞分为对照组、Aβ组、低剂量黄连素组、高剂量黄连素组和氟西汀阳性对照组,检测各组细胞上清液脑源性神经营养因子,神经生长因子及胶质源性神经营养因子的含量。 结果 悬尾实验与强制游泳实验显示,Aβ组比对照组大鼠的活动时间显著减少(P<0.001),高剂量黄连素治疗组比Aβ组活动时间显著延长(P<0.05),低剂量组与Aβ组差异并无统计学意义。应激状况下Aβ组血浆皮质醇与促肾上腺皮质激素相较于对照组明显升高(P<0.01),而正常情况下两种激素在各组差异无统计学意义。与Aβ组相比,黄连素治疗组两种激素水平下降(P<0.01)。细胞上清液检测显示,与对照组相比,Aβ组的脑源性神经营养因子、神经生长因子及胶质源性神经营养因子的分泌水平明显减低(P<0.001),与Aβ组相比,高剂量黄连素治疗组中三种神经营养因子分泌水平均显著增加(P<0.05)。 结论 黄连素能够显著缓解β淀粉样蛋白引起的抑郁焦虑情绪,这种缓解作用可能与其对应激性激素的调节以及对胶质细胞神经营养因子分泌的促进作用有关。
黄连素; β淀粉样蛋白; 抑郁焦虑行为; 脑源性神经营养因子; 神经生长因子; 胶质源性神经营养因子; 阿尔兹海默病
阿尔兹海默病(Alzheimer’s disease,AD),又称老年性痴呆,是一种严重影响认知以及其他神经精神功能的神经退行性疾病。2010年,中国AD确诊病例接近570万人次[1]。随着老龄化的发展,AD患病人数继续逐年攀升,严重增加社会经济负担。AD患者主要表现为一系列与年龄相关的认知功能障碍,例如空间学习能力以及认知功能逐渐缺失等[2]。脑内具有特异性淀粉样蛋白聚集形成的老年斑是AD的重要病理特征[3]。而淀粉样斑块的形成与β淀粉样蛋白(amyloid-beta,Aβ)的过度产生和异常聚集有直接的关系。在体外培养的PC12细胞,以及原代海马神经元的研究中早已证明Aβ能够导致严重的神经毒性作用[4]。这些神经毒性作用包括神经元电活性降低,神经组织炎症反应与氧化应激,并且可最终导致神经元的大量死亡形成脑萎缩[5-7]。而Aβ引起的神经功能失调,不仅能够引起动物认知功能的下降,也会严重影响大脑的情绪调节能力。据报道,Aβ可引起动物抑郁情绪且可能是调节情绪行为的重要靶点[8]。与此同时,抑郁症常规治疗药物氟西汀也表现出了对Aβ引起的神经毒性的保护作用[9]。研究发现,AD伴随的多种脑损伤,如海马萎缩、突触可塑性降低,、神经递质水平以及突触传递效能的减弱同时也是导致抑郁焦虑情绪的重要因素[10]。典型的AD动物模型除认知功能障碍外,同样会表现出抑郁焦虑等多种神经功能损伤的症状[11]。大量的临床以及流行病学调查显示,抑郁症是AD的一大重要危险因素,并且AD发病过程中往往伴有抑郁焦虑情绪的出现。有研究显示针对抑郁情绪的治疗可以改善AD病人的生活质量[12-13]。所以,在寻求与发展新的AD治疗药物与治疗靶点时,动物的情绪调控能力是否改善应该作为检验药物有效性的一个重要指标。
从天然用药成分中提取化学单体并开发新药是目前药理学研究的重要策略之一。黄连素,又称作小柴碱,是一种广泛存在于各类中草药如黄连中的苄基异喹啉类生物碱。黄连素可以抑制人神经胶质细胞瘤H4细胞系中Aβ过度产生[14]。黄连素作为一种具有神经保护功能的化学单体对Aβ引起的神经毒性以及学习记忆损伤的阻止作用已经在大量的报道中得以证实。在神经退行性病变的疾病治疗中的潜力也已有报道[15]。但是,黄连素在AD治疗方面的有效性需要进一步在动物的情绪调控行为上继续证实。除了对Aβ引起的神经毒性具有拮抗效应,AD症状条件下促进神经再生以及提高神经营养支持效应对神经功能的恢复同样至关重要。所以,本研究重点探索了黄连素对Aβ侧脑室注射引起的抑郁以及焦虑样行为的改善作用,并从神经内分泌学的角度探究了黄连素对应激性相关激素分泌的影响,同时利用原代体外培养的星形胶质细胞检测黄连素对促进神经生长的重要神经营养因子的表达是否具有恢复效应。
1 材料与方法
1.1 实验动物
清洁级雄性SD (Sprague Dawley)大鼠60只,体质量体质量220-240 g,购自军事医学科学院实验动物中心。动物常规分笼饲养、自然昼夜节律、自由饮水进食,室温20-23 ℃,相对湿度40%-60%。
1.2 主要试剂与仪器
Aβ1-40(Sigma公司);ELISA试剂盒(美国Enzo life science);氟西汀(Sigma公司,美国);立体定位仪、颅骨钻(瑞沃德生命科技有限公司,中国);OFT箱(瑞沃德生命科技有限公司,中国);高架十字迷宫(EPM迷宫)(瑞沃德生命科技有限公司,中国);酶标仪(Bio-rad 680,美国)。
1.3 动物分组
60只雄性大鼠随机分为5组(每组12只),分别为对照组、Aβ组、黄连素低剂量组(5 mg/kg)、高剂量组(20 mg/kg)、以及氟西汀阳性对照组。
1.4 AD模型建立与药物治疗
AD模型建立参照文献[16]方法进行。采用Aβ1-40(4 nmol/L,溶于生理盐水)侧脑室注射作为建立AD模型。大鼠经水合氯醛腹腔注射麻醉(0.3 g/kg),并将头部固定于立体定位仪上,通过颅骨钻钻孔,用微量注射器注射Aβ1-40溶液(4 μl),对照组注射相同体积的生理盐水。侧脑室定位为前囟点后0.8 mm,左侧旁开1.5 mm,深度3.6 mm。缓缓注入Aβ1-40溶液(15 min)并留针5 min,用骨蜡封口,封皮,将大鼠至于红外灯下保持体温并等待其苏醒。黄连素与氟西汀溶液溶于生理盐水中(10 mg/ml),大鼠手术后第3天开始连续灌胃1周[黄连素剂量5 mg/(kg·d),20 mg/(kg·d);氟西汀剂量:20 mg/(kg·d)],期间监测大鼠的体质量。
1.5 行为学实验
主要包括以下内容:强迫游泳实验和悬尾试验用于测定大鼠抑郁行为;旷场实验和高架十字迷宫实验则用于检测大鼠焦虑样症状。
强迫游泳实验:将大鼠置于水深30 cm、直径25 cm、高45 cm 的玻璃缸中,水温23-25 ℃,并保证大鼠后肢不能触及缸底,前肢不能附于缸壁顶部。实验时水缸周围围用黑色纸箱遮挡。实验观察6 min,记录后4 min内大鼠累计静止时间(大鼠停止挣扎或呈漂浮状态,四肢有轻微动作以保持头部在水面),期间摄像供实验后分析。游泳结束后用吹风机将大鼠吹干。严格控制水温,且每只大鼠实验前更换实验用水。
悬尾实验:强迫游泳实验结束后次日,将大鼠尾巴距尾尖部约1 cm处用胶布贴于悬尾箱(30 cm × 30 cm × 20 cm)支架上,使大鼠成倒挂状态,其头部离箱底约5 cm,一次悬挂1只大鼠。悬挂时间为6 min,统计大鼠整个过程内悬尾累积不动时间(不动状态即大鼠停止挣扎不动或无任何活动),实验期间摄像共实验后分析。
高架十字迷宫,宫体是由两个开放臂(长50 cm,宽10 cm,高40 cm)以及两个闭合臂(长50 cm,宽10 cm,高40 cm)呈十字状组成。开放臂与闭合臂各呈直线排列。EPM试验中,将大鼠轻轻放置于宫体中央,保证其鼻端朝向开放臂,并允许大鼠在宫体内自由活动5 min。整个试验过程有红外摄像头记录,采集信号后对其运动轨迹利用软件(Ethovision 3.0,Noldus Information Technology,荷兰)进行分析处理。通过记录大鼠进入开放臂以及闭合臂的次数和大鼠在开放臂以及闭合臂分别停留的时间来评价其焦虑情绪。
运动模型建成后次日,不同组别大鼠进行旷场实验(open field test,OFT)。OFT箱大小为(100 cm×100 cm×40 cm)的无盖方箱,箱体内壁均为黑色。箱体底部被分为面积相等的25个正方型格子(20 m×20 m),从左上角至右下角依次编号1-25,其中编号为7,8,9,12,13,14,17,18,19的方格范围为中央区域,其余为外周区域。实验时轻抓大鼠尾部放入正中区即13号方格中后,采用红外摄像监测5 min内大鼠在OFT箱的活动轨迹,每只大鼠记录完毕,清理旷场箱内的排泄物,并用75%的酒精清洗箱体内部,晾干后再进行下只大鼠的测试。摄像采集信号由行为学分析软件(Ethovision 3.0,Noldus Information Technology,Netherlands)进行处理。以大鼠在OFT箱的总活动距离、总穿越格数、中央区域活动时间以及中央区域活动距离,作为评价大鼠焦虑情绪的指标。
1.6 大鼠外周血应激激素测定
完成行为学检测后的大鼠,尾静脉收集静脉血,并在取血后用大鼠束缚器(带有呼吸孔的塑料圆筒)束缚大鼠30 min,造成短期应激反应,并立即从尾静脉收集静脉血,每次取血0.3-0.5 ml。所有收集血液3 000×g离心15 min收取血浆。ELISA试剂盒检测血浆中皮质醇以及促肾上腺皮质激素:将样品加入含有不同一抗(anti-CORT以及anti-ACTH)的96孔板中并室温孵育2 h。孵育后洗净96孔板,并加入带有生物素的二抗(anti-rat-CORT antibody,anti-rat-ACTH antibody)37 ℃孵育90 min。加入1 mol/L的硫酸终止反应,并立即在酶标仪下测定450 nm波长的吸光度。每个样本分别用3个复孔测定。
1.7 原代星形胶质细胞培养
体外培养的原代星形胶质细胞分为对照组、Aβ组、低剂量黄连素组、高剂量黄连素组和氟西汀阳性对照组。4周龄未经处理的雄性大鼠通过水合氯醛麻醉处死并取脑并分离皮层组织。将分离的皮层剪碎后浸入无Ca2+和Mg2+的Hank’s溶液中。胰酶消化20 min,将皮层组织捣碎并用培养液清洗3次。培养液为DMEM加10%FBS,100 U/ml的青霉素以及100 μg/ml的链霉素。悬液1 200×g离心3 min,将细胞种在24孔板内,密度2.0×105,培养在条件为37 ℃,5% CO2,并于种板后48 h 更换培养基。培养基更换频率为每周2次。药物(包括Aβ 1-40及不同浓度黄连素)溶于含有10%FBS的DMEM,同时含有100 U/ml的青霉素以及100 μg/ml的链霉素。Aβ 1-40(25 μmol/L)处理24 h后,治疗组用不同浓度的黄连素处理(10-6,10-5mol/L),同时阳性对照组用氟西汀溶液处理(10-5mol/L )。对照组加入不含有任何药物的DMEM(10%FBS)。
1.8 神经营养因子检测
ELISA试剂盒检测细胞培养液中脑源性神经营养因子,神经生长因子及胶质源性神经营养因子。将样品加入含有不同一抗(anti-BDNF,anti-NGF以及anti-GDNF)的96孔板中并室温孵育2 h。移除样品后与带有生物素的二抗(anti-rat-BDNF antibody,anti-rat-NGF antibody,anti-rat-GDNF antibody)37 ℃孵育90 min。之后,加入1 mol/L的硫酸终止反应,并立即在酶标仪测定450 nm波长的吸光度。每个样本分别用3个复孔测定。
1.9 统计学分析
2 结果
2.1 黄连素对Aβ引起的动物焦虑抑郁行为的影响
强制游泳和悬尾试验测定结果显示,与对照组相比,Aβ组的运动时间显著缩短(P<0.001,见图1A、B);与Aβ组相比,低剂量的黄连素组运动时间并没有显著变化,而高剂量黄连素组运动时间则显著延长(P<0.05,见图1A、B),同时,氟西汀阳性对照组运动时间也显著延长(P<0.05,见图1A、B)。说明与Aβ组相比黄连素处理组缓解了Aβ诱导的抑郁样行为学变化。旷场实验和高架十字迷宫实验结果显示Aβ同样导致了大鼠的焦虑样行为,具体表现在旷场实验的中心区域活动时间的缩短(P<0.001,见图1C),以及高架十字迷宫中开放臂中活动时间的缩短(P<0.001,见图1D)。高剂量黄连素缓解了Aβ导致的动物焦虑行为的变化,具体表现在大鼠在高架十字迷宫开放臂中活动时间的增加(图1D,P<0.05)。氟西汀阳性对照组与Aβ组相比开放臂活动时间显著增加(P<0.05,见图1D)。
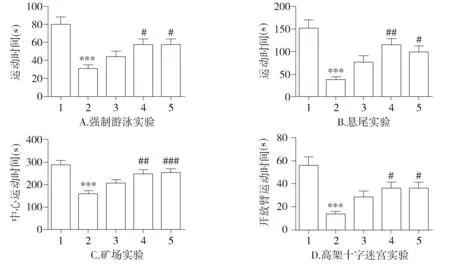
1.对照组;2.Aβ组;3.黄连素5 mg/kg组;4.黄连素20 mg/kg组;5.氟西汀组与对照组比,***P<0.001;与Aβ组比,#P<0.05,##P<0.01,###P<0.001 图1 不同处理引起的动物行为学变化Figure 1 Changes of animal behavior after different treatment
2.2 黄连素对大鼠体内应激激素的分泌影响
为了解黄连素能否引起大鼠应激性激素升高的缓解作用,用ELISA法对不同条件下两种应激性激素血浆中皮质醇以及促肾上腺皮质激素的含量进行了测定。在各组处理中,30 min的行动束缚引起了两种激素血液含量的显著升高(F1,50=964.0,P<0.001,见图2A;F1,50=441.3,P<0.001,图2B)。在正常情况下,两种激素水平在各组内差异均无统计学意义(见图2)。行动束缚后,Aβ组血浆中皮质醇以及促肾上腺皮质激素的血液含量显著上升(P<0.01,见图2)。低剂量以及高剂量黄连素组血浆中皮质醇以及促肾上腺皮质激素的上升均缓解(P<0.01,见图2),并且氟西汀也产生了相同效应(P<0.01,见图2)。
2.3 黄连素对胶质细胞神经营养因子分泌的影响
检测原代星型胶质细胞上清液结果显示,与对照组相比,Aβ组脑源性神经营养因子、神经生长因子及胶质源性神经营养因子含量显著下降(P<0.001,见图3)。而高浓度的黄连素处理则显著抑制了神经营养因子含量的降低(P<0.05,见图3)。同时,氟西汀组与黄连素处理组具有相同效应,胶质细胞神经营养因子的分泌水平也升高(P<0.01,见图3)。

A.黄连素抑制了压力状态下皮质醇的过度分泌 B.黄连素抑制了压力状态下ACTH在血液的过量表达与对照组相比,**P<0.01; 与Aβ组相比,##P<0.01图2 不同情况下与应激状态下各组皮质醇与促肾上腺皮质激素含量变化Figure 2 Changes of cortisol level and ACTH level after different treatment under normal or stress conditions
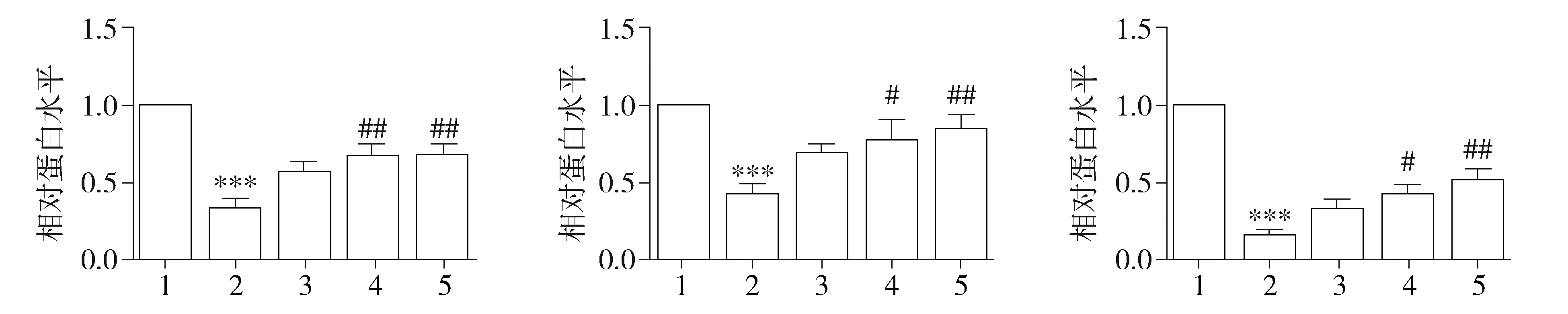
A.脑源性神经营养因子 B.神经生长因子 C.胶质源性神经营养因子1.对照组;2.Aβ组;3.10-6 mol/L黄连素组;4.10-5 mol/L黄连素组;5.氟西汀组与对照组相比,***P<0.001;与Aβ组相比,#P<0.05,##P<0.01 图3 黄连素对胶质细胞分泌神经营养因子分泌的作用Figure 3 Effect of berberine on the production of neurotrophins from the glia cells
3 讨论
作为一种神经退行性疾病,AD病人伴随着大量的神经元死亡,神经连接的丢失,神经内分泌以及神经营养因子的失调,同时可以导致除了认知功能障碍的更多行为学表现。而其中,AD引发的抑郁样症状便是一种伴随着认知功能同时产生的行为学障碍,并且这种相关的情绪失调也能够为患者及其家人带来相当显著的精神和物质压力,并导致治疗效果的下降。所以,在寻求治疗AD的特效药物时,针对其抑郁焦虑样行为表现的特殊药物的开发也十分重要。同时,是否能够产生情绪调控作用也应该作为评价AD治疗药物的一个重要指标。传统中医作为一种特殊的治疗方式,一直寻求从天然药物配伍出发,通过调节机体功能达到治疗目的。中药配方中“君-臣-佐-使”的掌握也是对疾病治疗的根本[17]。而从传统中药出发,从中药方剂常用的天然植物中寻找生物活性成分已经成为现代药物开发不可或缺的部分。黄连素的神经保护作用已经被广泛证实。在中风等严重影响神经系统的疾病模型中,黄连素均显示了显著的神经保护作用,其重点表现在阻止神经细胞的死亡以及对炎症反应的缓解等[18,19]。黄连素通过对β-分泌酶的作用从而抑制AD的发展已有相关报道[20]。然而,黄连素能否缓解AD导致的抑郁与焦虑作用的相关证据仍然欠缺。本研究从行为学角度首先证实了急性Aβ处理能够引起动物抑郁焦虑行为的变化,而这种变化同时能够被黄连素以及典型的抗抑郁西药氟西汀所缓解。这证明黄连素对动物的情绪有调节作用。进一步的神经内分泌学研究发现,黄连素缓解了在压力状态下Aβ引起的应激性激素的上升。应激性激素皮质醇和促肾上腺皮质激素作为一种在压力状态下产生的激素,正常情况下能够帮助动物缓解适应的复杂性。然而,在抑郁症情况下,这些激素会长期在体内保留较高水平并且在相对轻度的压力环境下加速释放,通过影响下丘脑-垂体-肾上腺轴形成负反馈,进一步导致下丘脑-垂体-肾上腺轴的持续亢进。这也是抑郁症的重要神经内分泌学机制之一[21]。持续性亢进的下丘脑-垂体-肾上腺轴会导致海马的一系列变化,并导致神经功能的进一步失调。本实验结果显示Aβ同样能够导致皮质醇和促肾上腺皮质激素的分泌增多,所以这有可能是AD中抑郁焦虑样行为表现的重要原因之一。
Aβ作为AD中最重要的生物标志之一,近年成为研究的热点。Aβ能够导致动物学习记忆的减退,导致细胞毒性并引起神经元的丢失,突触可塑性的降低等病理变化,在AD发展过程中扮演了重要角色[22-24]。所以,以Aβ作为靶点清除其毒性作用成为了AD治疗的一个关键思路。然而,仅仅对毒性蛋白这一单一因素进行针对治疗显然不够,药物治疗对AD这类多靶点神经退行性疾病还需要能够同时恢复神经元的正常作用。而神经营养因子对于神经元正常功能的发挥,如维持神经元的完整性,突触可塑性的帮助以及对神经新生的帮助等均具有不可替代的意义[25,26]。本研究指出,Aβ干预后胶质细胞神经营养因子的分泌减少,这可能是AD导致细胞损伤以及行为学异常的原因之一。而本实验结果提示,黄连素处理和氟西汀效果相同,均缓解了Aβ引起的神经营养因子的降低。所以,黄连素具有对神经营养因子的分泌和产生具有促进作用。
本实验重点研究了黄连素对Aβ引起的抑郁焦虑情绪的治疗作用以及其神经内分泌学和神经生物学机制。阳性对照氟西汀虽然具有相同的保护作用,但是这类药物的副作用与高复发概率等均驱使科学家进一步寻求更新的治疗药物。本研究通过研究AD中伴随的抑郁焦虑情绪,探究了黄连素的神经保护作用,为中医药天然植物提取成分对神经退行性疾病治疗的开发和发展提供了指导意见,同时也为黄连素对AD引起的情绪失调的缓解作用提供了依据。
[1] Chan KY,Wang W,Wu JJ,etal.Epidemiology of Alzheimer's disease and other forms of dementia in China,1990-2010:a systematic review and analysis[J].Lancet,2013,381(9882):2016-2023.
[2] Jonsson T,Atwal JK,Steinberg S,etal.A mutation in APP protects against Alzheimer's disease and age-related cognitive decline[J].Nature,2012,488(7409):96-99.
[3] Lovell MA,Robertson JD,Teesdale WJ,etal.Copper,iron and zinc in Alzheimer’s disease senile plaques[J].J Neurol Sci,1998,158(1):47-52.
[4] Yankner BA,Dawes LR,Fisher S,etal.Neurotoxicity of a fragment of the amyloid precursor associated with Alzheimer’s disease[J].Science,1989,245(4916):417-420.
[5] Varghese K,Molnar P,Das M,etal.A new target for amyloid beta toxicity validated by standard and high-throughput electrophysiology[J].PLoS One,2010,5(1):e8643.
[6] Yan Q,Zhang J,Liu H,etal.Anti-inflammatory drug therapy alters beta-amyloid processing and deposition in an animal model of Alzheimer’s disease[J].J Neurosci,2003,23(20):7504-7509.
[7] Ferreiro E,Oliveira CR,Pereira CM.The release of calcium from the endoplasmic reticulum induced by amyloid-beta and prion peptides activates the mitochondrial apoptotic pathway[J].Neurobiol Dis,2008,30(3):331-342.
[8] Pomara N,Sidtis JJ.Brain neurotoxic amyloid-beta peptides:their potential role in the pathophysiology of depression and as molecular therapeutic targets[J].Br J Pharmacol,2010,161(4):768-770.
[9] Keowkase R,Aboukhatwa M,Luo Y.Fluoxetine protects against amyloid-beta toxicity,in part via daf-16 mediated cell signaling pathway,in Caenorhabditis elegans[J].Neuropharmacology,2010,59(4-5):358-365.
[10] Popoli M,Gennarelli M,Racagni G.Modulation of synaptic plasticity by stress and antidepressants[J].Bipolar disord,2002,4(3):166-182.
[11] Pugh PL,Richardson JC,Bate ST,etal.Non-cognitive behaviours in an APP/PS1 transgenic model of Alzheimer's disease[J].Behav Brain Res,2007,178(1):18-28.
[12] Wragg RE,Jeste DV.Overview of depression and psychosis in Alzheimer’s disease[J].Am JPsychiatry,1989,146(5):577-587.
[13] Clyburn LD,Stones MJ,Hadjistavropoulos T,etal.Predicting caregiver burden and depression in Alzheimer's disease[J].J Gerontol B Psychol Sci Soc Sci,2000,55(1):S2-S13.
[14] Asai M,Iwata N,Yoshikawa A,etal.Berberine alters the processing of Alzheimer’s amyloid precursor protein to decrease Abeta secretion[J].Biochem Biophys Res Commun,2007,352(2):498-502.
[15] Ahmed T ,Gilani AU ,Abdollahi M ,etal.Berberine and neurodegeneration:A review of literature[J].Pharmacol Rep,2015,67(5):970-979.
[16] Wang XH,Yang W,Holscher C,etal.Val(8)-GLP-1 remodels synaptic activity and intracellular calcium homeostasis impaired by amyloid beta peptide in rats[J].J Neurosci Res,2013,91(4):568-577.
[17] Shi J,Tong Y,Shen JG,etal.Effectiveness and safety of herbal medicines in the treatment of irritable bowel syndrome:a systematic review[J].World J Gastroenterol,2008,14(3):454-462.
[18] Cui HS,Matsumoto K,Murakami Y,etal.Berberine exerts neuroprotective actions against in vitro ischemia-induced neuronal cell damage in organotypic hippocampal slice cultures:involvement of B-cell lymphoma 2 phosphorylation suppression[J].Biol Pharm Bull,2009,32(1):79-85.
[19] Zhang X,Zhang X,Wang C,etal.Neuroprotection of early and short-time applying berberine in the acute phase of cerebral ischemia:up-regulated pAkt,pGSK and pCREB,down-regulated NF-kappaB expression,ameliorated BBB permeability[J].Brain Res,2012,1459:61-70.
[20] Panahi N,Mahmoudian M,Mortazavi P,etal.Effects of berberine on beta-secretase activity in a rabbit model of Alzheimer’s di-sease[J].Arch Med Sci,2013,9(1):146-150.
[21] Pariante CM and Lightman SL.The HPA axis in major depression:classical theories and new developments[J].Trends Neurosci,2008,31(9):464-468.
[22] Roch JM,Masliah E,Roch-Levecq AC,etal.Increase of synaptic density and memory retention by a peptide representing the trophic domain of the amyloid beta/A4 protein precursor[J].Proc Natl Acad Sci U S A,1994,91(16):7450-7454.
[23] Mark RJ,Hensley K,Butterfield DA,etal.Amyloid beta-peptide impairs ion-motive ATPase activities:evidence for a role in loss of neuronal Ca2+homeostasis and cell death[J].J Neurosci,1995,15(9):6239-6249.
[24] Selkoe DJ.Soluble oligomers of the amyloid beta-protein impair synaptic plasticity and behavior[J].Behav Brain Res,2008,192(1):106-113.
[25] Lo DC.Neurotrophic factors and synaptic plasticity[J].Neuron,1995,15(5):979-981.
[26] Schmidt HD,Duman RS.The role of neurotrophic factors in adult hippocampal neurogenesis,antidepressant treatments and animal models of depressive-like behavior[J].Behav Pharmacol,2007,18(5-6):391-418.
Effects of berberine on Aβ-induced depression and its possible mechanism
NIU Yuhu*,GUO Guoying,GONG Tao,ZHANG Dong,WANG Huizhen
(DepartmentofBiochemistryandMolecularBiology,ShanxiMedicalUniversity,Taiyuan030001,China;*Correspondingauthor,E-mail:niuyuhu_8905@163.com)
ObjectiveTo investigate the antidepressant and anti-anxiety effects of berberine in Aβ-induced depression rats and its possible mechanism.MethodsSixty rats were randomized into five groups (n=12 in each group):control group,Aβ group,low dose berberine group,high dose berberine group,and fluoxetine group.Behavioral tests were performed to determine the depressive and anxiety behaviors of rats in each group.Plasma levels of corticosterone and adrenocorticotropic hormone were detected by ELISA.Astrocytes were divided into five groups:control group,Aβ group,low dose berberine group,high dose berberine group and fluoxetine group.The concentrations of brain-derived neurotrophic factor(BDNF),nerve growth factor(NGF) and glia-derived neurotrophic factor(GDNF) in cell culture fluids were analyzed by ELISA.Results①The tail suspension and forced swim tests indicated that the mobility time significantly decreased in Aβ group compared with control group (P<0.001).While the mobility time was significantly prolonged in high dose berberine group compared with Aβ group(P<0.05).②ELISA assay for detecting the stress hormone in plasma showed that compared with control group,the production of cortisol and ACTH increased under the stress condition in Aβ group(P<0.001),but no significant difference was found among different groups under the normal condition.Additionally,compared with Aβ group,the secretion of two stress hormones decreased under the stress condition in berberine groups(P<0.01).③Compared with control group,the production of BDNF,NGF and GDNF decreased in Aβ group(P<0.001).Compared with Aβ group,the secretion of BDNF,NGF and GDNF significantly increased in high dose berberine group(P<0.05).ConclusionBerberine can alleviate the depressive and anxiety symptoms induced by Aβ.The improved regulation on stress hormone and promotion effects on production of neurotrophins might be the neurobiological mechanisms underlying these therapeutic effects.
berberine; amyloid-β; depressive-/anxiety-like behaviors; brain-derived neurotrophic factor; nerve growth factor; glia-derived neurotrophic factor; Alzheimer’s disease
牛玉虎,男,1985-05生,硕士,助理实验师,E-mail:niuyuhu_8905@163.com
2017-03-06
R749.1
A
1007-6611(2017)06-0519-07
10.13753/j.issn.1007-6611.2017.06.002

