Hsa-miR-205-5p对食管鳞癌细胞系耐药的影响
王 芳,肖帅帅,阎 婷*
(1山西医科大学转化医学研究中心,太原 030001;2山西省肿瘤医院普外科;*通讯作者,E-mail:enntei@hotmail.com)
Hsa-miR-205-5p对食管鳞癌细胞系耐药的影响
王 芳1,肖帅帅2,阎 婷1*
(1山西医科大学转化医学研究中心,太原 030001;2山西省肿瘤医院普外科;*通讯作者,E-mail:enntei@hotmail.com)
目的 研究hsa-miR-205-5p对食管鳞癌铂类化疗耐药的影响。 方法 首先用RT-PCR法检测hsa-miR-205-5p在食管鳞癌耐药细胞系EcA109和敏感细胞系KYSE150中的表达。然后在EcA109和KYSE150中分别转染hsa-miR-205-5p mimics,mimics NC和hsa-miR-205-5p inhibitor,inhibitor NC,用MTT和CCK8法检测奥沙利铂浓度为60,120,240,480,960 μmol/L对细胞增殖的影响。 结果 hsa-miR-205-5p在食管癌耐药细胞系EcA109比在敏感细胞系KYSE150中低表达(P<0.05)。MTT和CCK8实验结果表明,与转染NC组相比,随着奥沙利铂浓度的增加,转染hsa-miR-205-5p mimics组的EcA109细胞抑制率上升(P<0.05),转染hsa-miR-205-5p inhibitor组的KYSE150细胞抑制率下降(P<0.05)。 结论 转染hsa-miR-205-5p mimics后EcA109细胞对奥沙利铂敏感性提高,转染hsa-miR-205-5p inhibitor后KYSE150细胞对奥沙利铂耐药性增加。说明hsa-miR-205-5p过表达可抑制食管鳞癌细胞产生耐药性。
hsa-miR-205-5p; mimics/inhibitor; 食管鳞癌; 耐药
hsa-miR-205-5p; mimics/inhibitor; esophageal squamous cell carcinoma; chemo-resistance
食管癌是人类常见的消化道恶性肿瘤之一,世界上约一半的食管癌发生在我国,其病理类型以鳞癌为主,由于食管癌的发病原因及流行病学特点,使得我国成为世界上食管癌发病率和死亡率最高的国家[1]。临床数据显示,尽管目前食管癌手术的R0切除率逐年增加,但是食管癌治疗效果依然不尽如人意[2]。化疗仍是食管癌主要的治疗手段,但化疗耐药常常导致肿瘤治疗失败,成为食管癌治疗的瓶颈。因此探寻食管癌化疗耐药机制,寻找与食管癌预后和治疗疗效相关的标志物,有效评估治疗疗效和预测预后成为近年来食管癌研究的热点。
miRNA广泛存在于真核生物中,长度约为21-24个核苷酸的单链、非编码、内源性的小分子RNA。大量临床实验和研究表明,肿瘤耐药细胞中存在miRNA表达异常,其异常会导致肿瘤细胞耐药。因此miRNA作为预测化疗疗效和逆转耐药靶点成为近年来研究热点。已有研究显示,miRNA可通过调控上皮间质转化、细胞凋亡基因表达、药物外排作用相关蛋白表达、细胞损伤后自我修复能力相关基因表达等发挥耐药机制。miR-205参与多种癌症的调控。在喉鳞状细胞癌中,miR-205调控癌细胞的侵袭和迁移。在非小细胞肺癌的早期检测中,miR-21,miR-205,miR-155等可作为血清标志物[3,4]。但是关于miR-205参与肿瘤化疗耐药的报道甚少。
本实验室对食管鳞癌细胞系进行小RNA测序系统分析,发现hsa-miR-205-5p在化疗耐药和敏感细胞系中表达差异显著,推测其参与了食管鳞癌细胞耐药机制的调控。本研究对hsa-miR-205-5p在食管鳞癌细胞耐药中的作用进行了进一步验证。
1 材料与方法
1.1 主要试剂与仪器
荧光定量PCR仪(美国Applied Biosystems),高压灭菌锅(日本Panasonic),CO2细胞培养箱(美国 Thermo),DMEM/F12培养基(美国HYCLONE),胰蛋白酶(美国HYCLONE),胎牛血清(美国GIBCO),逆转录试剂盒(德国QIAGEN),MTT(北京碧云天生物科技有限公司),DMSO(美国sigma),hsa-miR-205-5p inhibitor、hsa-miR-205-5p mimics、hsa-miR-205-5p mimics及inhibitor阴性对照(广州锐博生物科技有限公司)。
1.2 奥沙利铂化疗药物配制
奥沙利铂(oxaliplatin)分子量397.29 g/mol,浓度范围:0-1 200 μmol/L。母液配制:用生理盐水溶解配成50 mg/10 ml(12.58 mmol/L),分装300 μl/管,20 ℃密封储存。释液的配制:7 236.86 μl DMEM/F12完全培养基中加763.14 μl奥沙利铂母液,配成1 200 μmol/L稀释液8 ml,分别配制成60,120,240,480,960 μmol/L的稀释液。
1.3 细胞转染
转染当天,取对数增长期的细胞进行实验,将细胞接种于3个6孔板中,以(10-20)×105个细胞/孔的密度接种细胞,常规培养。将6孔板中的细胞分成6组,每组3个重复,分别转染hsa-miR-205-5p-mimics(20 μmol/)0.6 μl、mimics NC 0.6 μl、hsa-miR-205-5p-inhibitor(20 μmol/L)6 μl、inhibitor NC 6 μl和无处理组,分别加入基础培养基400 μl,吹打混匀后加入12 μl 转染试剂,混匀后在超净台中静置5-10 min。从培养箱中取出接种好细胞的6孔板,将不同的混合溶液分别滴入到6孔板每组细胞中,轻柔吹打混匀,5%CO2培养箱中继续培养。转染36-48 h用胰酶消化细胞,进行后续实验。
1.4 RT-PCR鉴定转染效率
收集细胞沉淀,采用Trizol法提取总RNA。逆转录按照QIAGEN公司试剂盒说明进行,其反应体系为:5×miScript HiSpec Buffer 4 μl;10×miScript Nucleics Mix 2 μl;MiScript Reverse Transcriptase Mix 2 μl;RNA 500 ng-2 μg;RNase-free water补充至10 μl,37 ℃ 60 min;95 ℃ 5 min获得cDNA。运用QIAGEN公司miScript SYBR®Green PCR Kit试剂盒进行实时荧光定量PCR验证,内参基因为U6,其hsa-miR-205-5p上游引物为:5′-TCCTTCATTCCACCGGAGTCTG-3′,内参U6上游引物为:5′-CGCTTCACGAATTTGCGTGTCAT-3′,下游引物为试剂盒自带引物,按照如下反应体系:SYBR Mix 10 μl;hsa-miR-205-5p primer 2 μl;Reverse primer 2 μl;cDNA 1 μl;ddH2O 5 μl;总体积为20 μl。按照如下反应条件:95 ℃ 预变性15 min,94 ℃ 15 s,55 ℃ 30 s,70 ℃ 30 s,共40个循环,72 ℃ 延伸10 min。
1.5 MTT法和CCK-8法检测转染前后对细胞增殖的影响
用胰酶消化对照组细胞、转染hsa-miR-205-5p mimics或hsa-miR-205-5p inhibitor以及阴性对照和阳性对照组细胞,10%FBS的DMEM/F12培养基终止消化,1 000 r/min离心3 min;弃去上清,加入10% FBS 的DMEM/F12培养基重悬细胞,以5 000个/孔密度接种于96孔板中,每组设置5个复孔。24 h,分别加入浓度为60,120,240,480,960 μmol/L的奥沙利铂化疗药物。5% CO2培养箱继续培养48 h,加入MTT溶液20 μl到96孔板中,5%CO2培养箱中继续培养4 h后弃去上清,加入DMSO溶液200 μl,将加入DMSO的96孔板放置在摇床上10 min以促进结晶充分溶解,观察颗粒结晶逐渐溶解后,应用酶标仪检测OD490 nm值。
CCK-8法:每孔加入CCK-8溶液10 μl,培养箱内孵育1-4 h,应用酶标仪检测OD450 nm值。调零后,计算抑制率,抑制率=(实验组-对照组)/(实验组-0.05)×100%。
1.6 统计学分析
两样本间均值比较采用独立样本t检验;多样本间的均值比较采用单因素ANOVA方差分析;统计软件使用SPSS19.0。P<0.05表示差异有统计学意义。
2 结果
2.1 hsa-miR-205-5p在食管鳞癌耐药和敏感细胞系中的表达
针对hsa-miR-205-5p设计PCR引物,real-time PCR检测该miRNA在食管癌耐药细胞系EcA109和敏感细胞系KYSE150中的表达情况。结果显示hsa-miR-205-5p在EcA109中低表达,在KYSE150中高表达(P<0.05,见图1)。
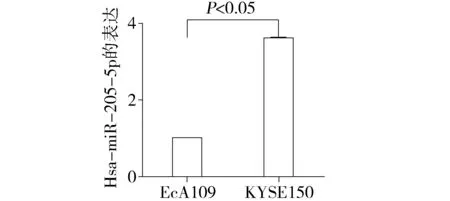
图1 hsa-miR-205-5p在EcA109和KYSE150中的表达Figure 1 Expression of hsa-miR-205-5p in EcA109 and KYSE150 cell lines
2.2 转染hsa-miR-205-5p mimics和inhibitor后细胞的表达
分别用hsa-miR-205-5p mimics和mimics NC转染食管癌耐药细胞EcA109,用hsa-miR-205-5p inhibitor和inhibitor NC转染食管鳞癌敏感细胞KYSE150,用RT-PCR准确定量hsa-miR-205-5p的表达,以homo-U6作为内参,结果显示:转染hsa-miR-205-5p mimics组hsa-miR-205-5p表达量比转染mimics NC组高15倍以上,转染hsa-miR-205-5p inhibitor组hsa-miR-205-5p表达量和转染inhibitor NC组相比差异显著,经统计学分析,均具有统计学意义(P<0.05,见图2)。
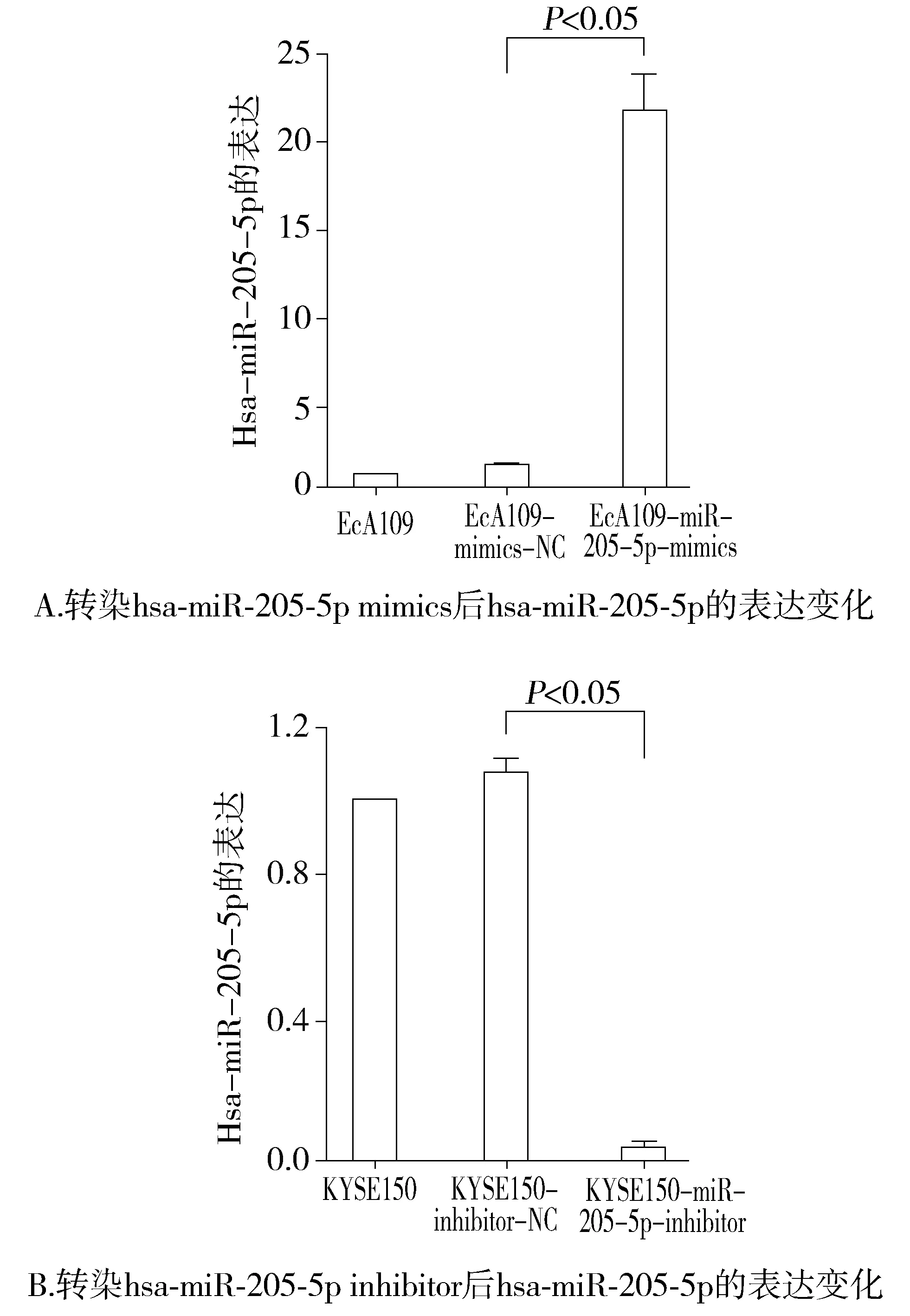
图2 RT-PCR检测hsa-miR-205-5p mimics/inhibitor转染效率Figure 2 The transfection efficiency of hsa-miR-205-5p mimics/inhibitor by RT-PCR
2.3 转染hsa-miR-205-5p mimics/inhibitor对奥沙利铂敏感性的影响
各组细胞用不同浓度的奥沙利铂作用48 h,MTT和CCK8法检测细胞抑制率。结果显示:在奥沙利铂浓度为60,120,240 μmol/L时,转染hsa-miR-205-5p mimics组的EcA109细胞抑制率与转染mimics NC组相比差异有统计学意义(P<0.01),当浓度为480,960 μmol/L时,两组相比差异也有统计学意义(P<0.05,见图3A和3C),说明耐药细胞系EcA109转染hsa-miR-205-5p mimics后对奥沙利铂浓度的敏感性提高。相反,在奥沙利铂浓度为120,240 μmol/L时,转染hsa-miR-205-5p inhibitor组的KYSE150细胞抑制率与转染inhibitor NC组差异有统计学意义(P<0.01),当浓度为60,480 μmol/L时,两组的KYSE150细胞抑制率差异有统计学意义(P<0.05,见图3B和3D),说明敏感细胞系KYSE150转染hsa-miR-205-5p inhibito后对奥沙利铂的敏感性降低。综上所述,改变细胞内hsa-miR-205-5p的表达,可使得细胞发生不同程度的耐药性。
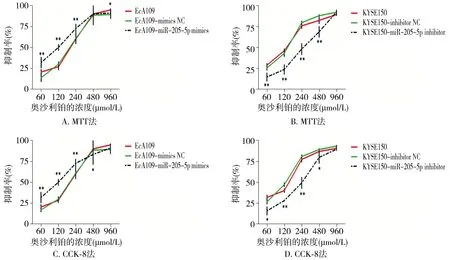
转染hsa-miR-205-5p mimics或inhibitor与NC组比较,*P<0.05,**P<0.01A,C.MTT法和CCK-8法分别检测EcA109细胞转染hsa-miR-205-5p mimics后对奥沙利铂耐药性的改变;B,D.MTT法和CCK-8法分别检测KYSE150转染hsa-miR-205-5p inhibitor后对奥沙利铂敏感性的改变图3 MTT法和CCK-8法检测食管鳞癌细胞系对奥沙利铂耐药性变化Figure 3 The variation of oxaliplatin-resistant phenotype of ESCC cell lines by MTT and CCK8 assays
3 讨论
现阶段食管鳞癌的治疗仍以采用手术为主,放疗、化疗、生物免疫治疗以及分子靶向治疗等为辅的综合治疗,但对于晚期不能手术的患者,化疗仍是食管鳞癌的主要治疗手段。近年来随着化疗药物的研发以及一些分子靶向药物的发展,比如mTOR抑制剂、Tarceva (EGFR受体的酪氨酸激酶抑制剂)、Avastin (VEGF抑制剂)、COX-2抑制剂等临床应用,使食管鳞癌患者现状得到明显改善,但是随之而来的耐药性也逐渐显现。因此,深入研究、挖掘与食管鳞癌耐药相关机制迫在眉睫[5-8]。
近几年对miRNA在肿瘤耐药中的作用逐渐成为研究热点,有文献报道hsa-let-7c、hsa-miR-34c-5p、hsa-miR-423-5p等miRNA,分别通过上皮间质转化、下调微管相关蛋白表达以及下调生长抑制因子4的表达、抑制ERBB2的表达等作用与化疗耐药密切相关[9-11]。TUBB3基因编码的β-tububin-Ⅲ是抗微管药物主要作用靶点,其高表达可导致抗微管药物如紫杉类药物发生耐药,而miRNA-200c可以通过调控其靶基因TUBB3使其表达水平发生下调,改善卵巢癌细胞对不同化疗药物的敏感性[12]。miR-24结合位点上发生单碱基突变时,肿瘤细胞对甲氨蝶呤等化疗药物的敏感程度亦会发生显著改变[13]。
目前,在食管鳞耐药过程中miRNA谱的变化及其作用机制仍缺乏系统性研究。本课题组前期通过比较5-FU、奥沙利铂、紫杉醇等化疗药物在各种食管鳞癌细胞系和正常食管细胞系的IC50,筛选出化疗敏感细胞系和耐药细胞系,进一步进行miRNA测序,鉴定出与耐药相关的差异基因及miRNA,hsa-miR-205-5p就是表达差异的miRNA之一。miRNA-205-5p是高度保守的miRNA,主要表达在鳞状上皮组织和乳腺组织[14-15]。有报道显示,与正常组织相比,miRNA-205-5p在乳腺肿瘤组织中表达明显下调,miRNA-205-5p可通过直接抑制ERBB2和间接抑制EGFR表达来抵抗靶向治疗[16,17]。在前列腺癌中,miR-205通过调控EMT使其表达下调,提示miR-205可能参与调控耐药表型,通过体内和体外研究发现,miR-205介导自噬通路来影响前列腺间质细胞对顺铂的敏感性[18]。本研究表明,hsa-miR-205-5p在奥沙利铂敏感细胞系中表达量明显增高,且细胞学实验表明 hsa-miR-205-5p过表达可抑制ESCC细胞产生耐药性,相反则会促进ESCC的耐药表型。推测hsa-miR-205-5p可能参与食管鳞癌化疗耐药的调控机制,但对其在食管鳞癌耐药过程中发挥作用的具体机制尚需进一步研究。
[1] Chen W,Zheng R,Baade PD,etal.Cancer atatistics in China[J].CA Cancer J Clin,2016,66:115-132.
[2] Wang B,Lv K,Chen W,etal.miR-375 and miR-205 regulate the invasion and migration of laryngeal squamous cell carcinoma synergistically via AKT-mediated EMT[J].BioMed Res Int,2016,11(9):1-11.
[3] Lai X,Friedman A.Exosomal miRs in lung cancer:a mathematical model[J].PLoS One,2016,11(12):33-39.
[4] Li P,Mao WM,Zheng ZG,etal.Down-regulation of PTEN expression modulated by dysregulated miR-21 contributes to the progression of esophageal cancer[J].Dig Dis Sci,2013,58(12):3483-3493.
[5] Guo F,Chen H,Chang J,etal.Mutation R273H confers p53 a stimulating effect on the IGF-1R-AKT pathway via miR-30a suppression in breast cancer[J].Biomed Pharmacother,2016,78(3):335-341.
[6] Li XL,Zhou J,Chen ZR,etal.P53 mutations in colorectal can-cer-molecular pathogenesis and pharmacological reactivation[J].World J Gastroenterol,2015,21(1):84-93.
[7] Bird-Lieberman EL,Fitzgerald RC.Early diagnosis of oesophageal cancer[J].Br J Cancer,2009,101(1):1-6.
[8] Lee Y,Ahn C,Han J,etal.The nuclear RNase Drosha initiates microRNA processing[J].Nature,2003,425(6956):415-419.
[9] Yu ST,Chen TM,Chen JW,etal.Downregulation of GSTpi expression by tryptanthrin contributing to sensitization of doxorubicin-resistant MCF-7 cells through c-jun NH2-terminal kinase-mediated apoptosis[J].Anticancer Drugs,2009,20(5):382-388.
[10] Shi H,Lu D,Shu Y,etal.Expression of multidrug resistance-related proteins p-glycoprotein,glutathione-s-transferases,topoisomerase-II and lung resistance protein in primary gastric cardiac adenocarcinoma[J].Hepatogastroenterology,2008,55(86-87):1530-1536.
[11] Chikamori K,Grozav AG,Kozuki T,etal.DNA topoisomerase II enzymes as molecular targets for cancer chemotherapy[J].Curr Cancer Drug Targets,2010,10(7):758-771.
[12] Cochrane DR,Spoelstra NS,Howe EN,etal.MicroRNA-200c mitigates invasiveness and restores sensitivity to microtubule-targeting chemotherapeutic agents[J].Mol Cancer Ther,2009,8(5):1055-1066.
[13] Mishra PJ,Humeniuk R,Mishra PJ,etal.A miR-24 microRNA binding-site polymorphism in dihydrofolate reductase gene leads to methotrexate resistance[J].Proc Natl Acad Sci U S A,2007,104(33):13513-13518.
[14] Farmer DT,Shariat N,Park CY,etal.Partially penetrant postnatal lethality of an epithelial specific MicroRNA in a mouse knockout[J].PLoS One,2013,8 (10):e76634.
[15] Greene SB,Gunaratne PH,Hammond SM,etal.A putative role for microRNA-205 in mammary epithelial cell progenitors[J].J Cell Sci,2010,123(Pt 4):606-618.
[16] Wu H,Zhu S,Mo YY.Suppression of cell growth and invasion by miR-205 in breast cancer[J].Cell Res,2009,19(4):439-448.
[17] De Cola A,Volpe S,Budani MC,etal.miR-205-5p-mediated downregulation of ErbB/HER receptors in breast cancer stem cells results in targeted therapy resistance[J].Cell Death Dis,2015,6(7):1823-1840.
[18] Pennati M,Lopergolo A,Profumo V,etal.miR-205 impairs the autophagic flux and enhances cisplatin cytotoxicity in castration-resistant prostate cancer cells[J].Biochem Pharmacol,2013,87(4):579-597.
ObjectiveTo explore the effect of hsa-miR-205-5p on the drug-resistance of oxaliplatin to esophageal squamous cell carcinoma.MethodsRT-PCR was used to detect hsa-miR-205-5p expression in different drug-resistant phenotypes of esophageal carcinoma cell lines.EcA109 cell line and KYSE150 cell line were transfected with hsa-miR-205-5p mimics,mimics NC and hsa-miR-205-5p inhibitor,inhibitor NC,respectively.Then the cell proliferation was detected after treated with different concentration of oxaliplation using MTT and CCK8 methods.ResultsThe hsa-miR-205-5p expression was lower in EcA109 cell line than in KYSE150 cell line(P<0.05).Compared with NC group,the inhibition rate of EcA109 cell line rose in a dose-dependent manner after treated with oxaliplatin in hsa-miR-205-5p mimics group(P<0.05),and the inhibition rate of KYSE150 cell line decreased in a dose-dependent manner after treated with oxaliplatin in hsa-miR-205-5p inhibitor group(P<0.05).ConclusionSensitivity of EcA109 cell line on oxaliplatin is increased by transfection of hsa-miR-205-5p mimics,and the resistance of KYSE150 cell line to oxaliplatin is increased by transfection of hsa-miR-205-5p inhibitor,which suggests that the overexpression of hsa-miR-205-5p could inhibit the drug resistance of ESCC cells.
山西医科大学博士启动基金资助项目(03201557)
王芳,女,1988-08生,硕士,初级实验师,E-mail:wangfang830@yeah.net
2017-02-27
R735.1
A
1007-6611(2017)06-0525-05
10.13753/j.issn.1007-6611.2017.06.003
Role of Hsa-miR-205-5p in the chemo-resistance of esophageal squamous cell carcinoma
WANG Fang1,XIAO Shuaishuai2,YAN Ting1*(1TranslationalMedicineResearchCenter,ShanxiMedicalUniversity,Taiyuan030001,China;2DepartmentofGeneralSurgery,ShanxiCancerHospital;*Correspondingauthor,E-mail:enntei@hotmail.com

