HIV-1转基因大鼠的肾脏氧化应激与凋亡基因的表达
高继萍,皇甫冰,李莉红,宋国华
(山西医科大学实验动物中心,太原 030001;*通讯作者,E-mail: ghsongg@hotmail.com)
HIV-1转基因大鼠的肾脏氧化应激与凋亡基因的表达
高继萍,皇甫冰,李莉红,宋国华*
(山西医科大学实验动物中心,太原 030001;*通讯作者,E-mail: ghsongg@hotmail.com)
目的 检测HIV-1转基因大鼠和F344大鼠肾脏COX3、COX5a、SOD2、GPx4、Caspase-1、Bax、BCL2L1、FasLg基因表达水平,探讨相关基因表达与HIV-1致肾脏病理变化的相关性。 方法 以GAPDH为内参照,应用SYBR Green染料法进行相对实时荧光定量PCR检测COX3、COX5a、SOD2、GPx4、Caspase-1、Bax、BCL2L1、FasLg在HIV-1转基因大鼠和F344大鼠肾脏中的表达情况。 结果 HIV-1转基因大鼠肾脏组织中氧化应激相关基因COX3、COX5a、SOD2、GPx4基因表达水平分别是F344大鼠的0.440,0.791,1.703,0.346倍,其中SOD2基因表达水平显著升高(P<0.05),COX3、COX5a、GPx4显著降低(P<0.05)。HIV-1转基因大鼠肾脏组织中凋亡相关基因Caspase-1、BCL2L1、Bax、FasLg的基因表达水平分别是F344大鼠的1.389,1.145,0.400,0.590倍,其中,Caspase-1和BCL2L1基因表达水平显著升高(P<0.05),Bax和FasLg显著降低(P<0.05)。 结论 HIV-1通过下调抗氧化酶基因表达水平使肾脏发生氧化应激,通过调控凋亡基因表达水平来拮抗肾脏细胞凋亡。
HIV; 转基因大鼠; 基因表达; 氧化应激; 细胞凋亡; 肾脏
自20世纪80年代证实人类免疫缺陷病毒Ⅰ型(human immunodeficiency virus-1,HIV-1)为艾滋病(AIDS)的病原体以来,由于HIV/AIDS有强烈的传染性和高度的致死率,已成为一个严重的全球性公共卫生问题[1]。人体免疫缺陷病毒Ⅰ型通过病毒蛋白Tat或gp120作用于免疫系统中的巨噬细胞和T淋巴细胞等细胞,造成人类免疫缺陷病毒Ⅰ型感染,破坏人体免疫系统功能[2,3],伴随着乙型肝炎(hepatitis B)[4]、心血管疾病(CVD)[5]、肾病等并发症的发生,目前AIDS发病机制尚未充分阐明,所以开展HIV-1转基因大鼠及探讨HIV-1的损伤机制,对AIDS的早期诊断、治疗及预后有重要意义。
机体在正常情况下会产生少量ROS,在自由基清除酶类和抗氧化剂的作用下能维持氧代谢平衡;一旦氧自由基产生过多或抗氧化体系出现故障,机体氧化与抗氧化系统之间的平衡被破坏,最终导致氧化应激。多项研究发现AIDS病人处于氧化应激状态[6,7],HIV及其产物均可诱导肾脏产生细胞凋亡[8,9]。HIV-1转基因大鼠作为研究AIDS比较好的动物模型有着明显的优势,为了更好地利用此模型,本实验应用SYBR Green实时荧光定量PCR法检测氧化应激相关基因(COX3、COX5a、SOD2、GPx4)及细胞凋亡相关基因(Caspase-1、Bax、BCL2L1、FasLg)在HIV-1转基因大鼠和F344大鼠肾脏中的基因表达水平,分析相关基因表达与HIV-1致肾脏病理损伤的关系,并探讨氧化应激和细胞凋亡在HIV-1损伤肾脏机制中的作用。
1 材料与方法
1.1 主要试剂及仪器
Trizol总RNA提取试剂盒购自美国Invitrogen公司,Revert Aid TM First strand cDNA Synthese Kit 购自美国Gibco BRL Life Technologies公司,SYBR Green荧光定量PCR试剂购自美国Bio-Rad公司。荧光定量PCR仪型号美国ABI公司7900HT Fast,分光光度计美国Thermo Fisher Scientific公司NanoDrop 2000c。
1.2 实验动物及分组
SPF级成年雄性HIV-1转基因大鼠和F344大鼠,8周龄,体质量250-300 g,购买于美国Harlan公司。按照弗吉尼亚大学的动物实验操作规程于弗吉尼亚大学实验动物中心进行饲养。适应性饲养1周,分别将HIV-1转基因大鼠和F344大鼠作为实验组和正常对照组,每组6只。本研究应用的HIV-1转基因大鼠,是将F344大鼠9个HIV-1中的gag基因和po1基因进行敲除,使其失去病毒复制的能力,只表达剩余的7个基因。大鼠体内不包含病毒复制,病毒蛋白可以在多个器官内表达。
1.3 取材
将HIV-1转基因大鼠和F344大鼠麻醉,处死,快速取出大鼠肾脏组织,将肾脏组织迅速放入液氮中速冻,然后转移至-80 ℃冰箱保存,以备实时荧光定量PCR检测。
1.4 引物设计
根据GenBank中公布的基因序列,应用美国ABI公司提供的Primer Express(v.3.0)软件设计引物,引物由华大基因公司合成。所有引物序列见表1。将管家基因GAPDH作为内参照。
表1 qRT-PCR的引物序列
Table 1 The primer sequence of qRT-PCR

基因 上游引物(5′-3′)下游引物(5′-3′)Cox3ACGAGATATCATCCGTGAAGGAATTCCGTATCGGAGGCCTTTCox5aTGGGCCTTGACAAAGTGTAAACTTTCCAGGCAACTGTTTCAATCASod2CGCTGGCCAAGGGAGATCCCCGCCATTGAACTTCAGpx4ACGAGTTCCTGGGCTTGTGTTGCGAATTCGTGCATGGACaspase⁃1CCTCAAGTTTTGCCCTTTAGAAATTGAAAGTCTGTGCTGCAGATAATGBaxCTCAAGGCCCTGTGCACTAAACCCGGAGGAAGTCCAGTGTBCL2L1GCAGTCAGCCAGAACCCTATCTGTCCAAAACACCTGCTCACTCAFaslgCCAACCACAGCCTTAGAGTATCATCTGTTAAGTGGGCCACACTCCTTGAPDHATGGAAATCCCATCACCATCTTCGCCCCACTTGATTTTGG
1.5 总RNA的提取
按Trizol试剂盒说明书提取总RNA;NanoDrop 2000分光光度计检测所提取样品在波长260 nm和280 nm处的吸光度(A260和A280),计算RNA纯度和浓度。总RNA-80 ℃保存备用。采用合格的RNA标本,按RevertAid TM First strand cDNA Synthese Kit说明书逆转录合成cDNA,-20 ℃保存。
1.6 实时定量PCR检测肾脏组织中氧化应激和细胞凋亡相关基因表达水平
反应体系10μl:5μl 2×Power SYBR Green PCR Master Mix,2.5 μl上游和下游引物,2.5 μl cDNA模板。每个样品均做3个复孔。反应条件:50 ℃ 1 min,95 ℃预变性10 min,95 ℃ 15 s,共40个循环;60 ℃延伸1 min。同时将定量模板梯度稀释,每个循环结束时系统都会收集相应的荧光曲线的Ct值,反应全部结束后自动给出由定量标准模板建立的标准曲线。反应结束后用计算机将样本与标准曲线对比得出各基因表达的拷贝数。
用内参基因GAPDH对目标基因进行均一化处理。由PCR反应曲线得到Ct值,采用ΔΔCt方法进行相对定量。校正公式为:Fold change=2-ΔCt,ΔCt=Ct目的基因-CtGAPDH。Ratio表示HIV-1转基因大鼠肾脏组织中目的基因表达水平与F344大鼠中相对应基因表达水平的比值。
1.7 统计学分析
用软件SPSS 22.0进行统计分析,采用t检验比较F344和HIV-1转基因大鼠肾脏的相对基因表达差异。P<0.05为差异有统计学意义。
2 结果
各样本的扩增曲线均已到达平台期,样品扩增的熔解曲线均未检测到引物二聚体,无非特异性荧光信号干扰。
2.1 氧化应激相关基因实时PCR检测结果
采用方差分析,结果显示HIV-1转基因大鼠肾脏中COX3、COX5a、SOD2、GPx4的基因表达水平与F344大鼠比较差异均具有统计学意义(P<0.05,见表2)。HIV-1转基因大鼠肾脏SOD2基因表达水平显著高于F344大鼠,其表达水平相对于GAPDH为F344大鼠的1.703倍 (见表2)。而COX3、COX5a、GPx4基因表达水平明显下降(P<0.05,见表2)。
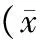
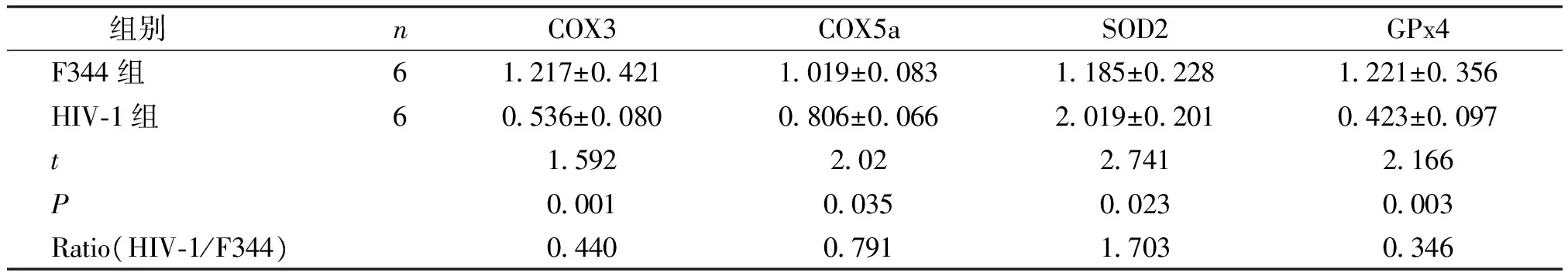
组别 nCOX3COX5aSOD2GPx4F344组61217±04211019±00831185±02281221±0356HIV⁃1组60536±00800806±00662019±02010423±0097t159220227412166P0001003500230003Ratio(HIV⁃1/F344)0440079117030346
2.2 细胞凋亡相关基因实时PCR检测结果
方差分析结果显示,HIV-1转基因大鼠肾脏中Caspase-1、Bax、BCL2L1、FasLg的基因表达水平与F344大鼠比较均具有统计学差异(P<0.05,见表3)。与F344大鼠相比,HIV-1转基因大鼠肾脏Caspase-1、BCL2L1基因表达水平明显升高,分别为F344大鼠的1.389,1.145倍,而Bax、FasLg显著降低,表达水平为F344大鼠的0.400和0.590倍(见表3)。
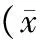
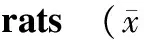
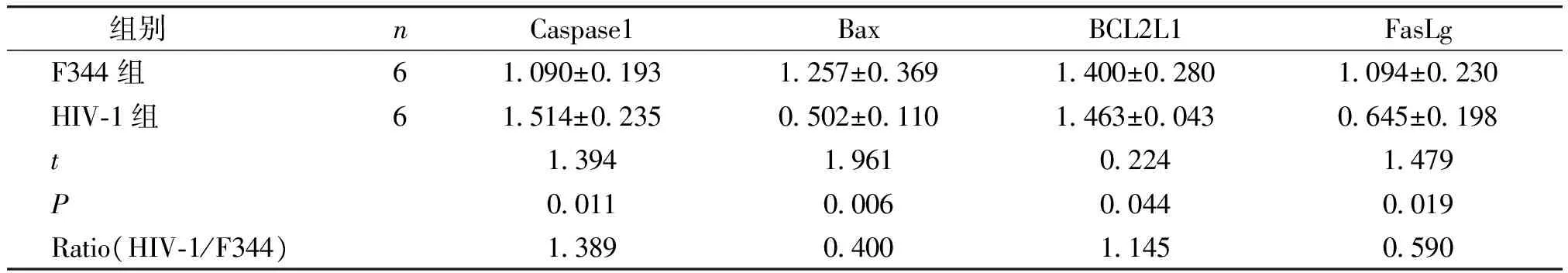
组别 nCaspase1BaxBCL2L1FasLgF344组61090±01931257±03691400±02801094±0230HIV⁃1组61514±02350502±01101463±00430645±0198t1394196102241479P0011000600440019Ratio(HIV⁃1/F344)1389040011450590
3 讨论
氧化应激(oxidative stress)是引起许多疾病和机体损伤的分子病理基础,是由于氧自由基(oxygen free radical,OFR)生成过多和/或细胞内自由基清除系统受损,导致OFR过量集聚,通过损伤生物大分子对细胞产生多种毒性作用。氧自由基的毒性作用在于对细胞生命活动中线粒体电子呼吸链及有关的酶的损伤[10]。细胞色素C氧化酶(COX)是线粒体呼吸链的重要组成部分。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽还原酶(GSH-R)、过氧化氢酶(CAT)和过氧化物酶(POD)等构成酶类自由基清除系统。线粒体酶COX以及内源性抗氧化酶SOD和GSH-Px的活性变化可反映体内OFR损害的程度。肾脏疾病是HIV感染的一个重要并发症[11,12],HIV相关性肾疾病常为HIV感染病程晚期的严重并发症,HIV感染肾脏并发症的临床和病理表现多样,累及肾小球、小管、间质、血管等[13]。因此本实验选取大鼠肾脏组织为研究对象。通过运用RT-PCR法检测HIV-1转基因大鼠和F344大鼠肾脏中氧化应激相关基因,结果显示HIV-1转基因大鼠肾脏同工酶COX3、COX5a基因表达水平对于F344大鼠明显下降,具有统计学差异(P<0.05),提示HIV-1可能通过破坏线粒体功能,影响线粒体呼吸链中相关酶的活性,进而破坏氧代谢平衡,导致肾脏组织发生损伤。而HIV-1转基因大鼠SOD2 基因表达水平显著高于F344大鼠,而GPx4明显低于F344大鼠,提示HIV-1转基因大鼠酶类自由基清除系统合成障碍,抗氧化酶活性降低,或清除酶消耗过多,不能有效地清除过多的OFR,从而加速了艾滋的发生发展。研究表明,SOD可保护GPx和CAT免受O2的灭活作用,三种抗氧化酶之间形成一个完整的互助保护系统[14]。本实验结果表明SOD2的代偿性升高可以抵消过多的自由基,从而保护GPx4及肾脏细胞,但GPx4活性显著下降及线粒体呼吸链的破坏,过量的OFR不能被有效地清除,不能中止自由基连锁反应,促使肾脏发生过氧化损伤。
研究发现HIV基因产物对细胞凋亡具有双重调节作用,既能促进细胞凋亡,也能抑制凋亡[15,16]。关于促进细胞凋亡主要取决于HIV基因编码的产物,如胞膜糖蛋白复合体(gp120-gp41)与 CD4+T细胞相互作用激活Fas-FasL通路而触发细胞凋亡[15]。Env与CD4+分子相互作用,不仅通过gp120与CD4+T细胞的交联而激活FAS-FASL(CD95-CD95L)路径引起细胞凋亡,还可以通过线粒体作用导致相应的多核巨细胞凋亡[16]。Vpr能够引起完整细胞内线粒体跨膜电势的快速衰退,释放细胞色素C,触发内源性凋亡途径[15,17]。Tat通过下调BCL-2和上调caspase-8诱发凋亡[15,16]。HIV能在高水平的子代病毒产生之前抑制感染细胞的凋亡,现已发现,一些HIV基因产物具有抗凋亡活性[15],Nef gp120和Vpu都可下调感染细胞CD4受体的表达,从而阻止继发的gp120-CD4介导的凋亡[18]。Nef下调感染细胞MHCⅠ类分子,从而有可能保护感染细胞免受CTLs或NK细胞的杀伤[19]。低水平表达的Vpr通过上调BCL-2和下调BAX抑制凋亡[20]。Tat通过降低TP53的转录而加速细胞循环过程抑制凋亡,使细胞增加病毒的产生[16]。Caspase-1不仅在炎症反应中起重要作用,还与细胞凋亡过程有密不可分的关系。Caspase-1既可以引起细胞程序性死亡,也可以促进其生存。在某些类型的细胞中,Caspase-1偏向激活生存相关通路,而在另外一些细胞(如免疫细胞)中,死亡相关通路更易被激活[21]。本研究显示:HIV-1转基因大鼠肾脏中凋亡相关基因Caspase-1表达水平与F344大鼠相比显著上调,差异具有统计学意义(P<0.05),HIV-1转基因大鼠肾脏中促凋亡基因Bax含量较F344大鼠显著降低,抗凋亡基因BCL2L1含量较F344大鼠显著上升,均差异具有统计学意义(P<0.05)。由此推测,Caspase-1在HIV-1对转基因大鼠肾脏细胞中执行抑制作用,促进细胞生存。本研究同时检测凋亡相关基因FasLg表达发现,与F344大鼠相比,FasLg基因表达水平显著下调(P<0.05),与以上推测结果相辅。因此,本实验结果提示HIV-1通过调控凋亡基因表达来抑制肾脏细胞凋亡。
通过研究显示,HIV-1通过破坏大鼠肾脏线粒体功能及抑制抗氧化酶的活性使机体处于氧化应激状态,HIV-1对肾脏的损伤机制可能与氧化应激有关。HIV-1通过调控凋亡相关基因表达水平来抑制肾脏细胞凋亡的发生,推测HIV可能在肾细胞中操纵凋亡机制使其有利于自己的生存。但关于HIV-1抗肾脏细胞凋亡机制有待进一步探讨。
[1] Fujita Y,Otsuki H,Watanabe Y,etal.Generation of a replication-competent chimeric simian-human immunodeficiency virus carrying env from subtype C clinical isolate through intracellular homologous recombination[J].Virology,2013,436(1):100-111.
[2] Van Braeckel E,Desombere I,Clement F,etal.Polyfunctional CD4(+) T cell responses in HIV-1-infected viral controls compared with those in healthy recipients of an adjuvanted polyprotein HIV-1 vaccine[J].Vaccine,2013,31(36):3739-3746.
[3] Fernandez CS,Kelleher AD,Finlayson R,etal.NKT cell depletion in humans during early HIV infection[J].Immunol Cell Biol,2014,92(7):578-590.
[4] Lee CY,Tsai HC,Lee SS,etal.Higher rate of hepatitis events in patients with human immunodeficiency virus,hepatitis B,and hepatitis D genotype II infection: a cohort study in a medical center in southern Taiwan[J].J Microbiol Immunol Infect,2015,48(1):20-27.
[5] Stein JH,Currier JS,Hsue PY.Arterial disease in patients with human immunodeficiency virus infection: what has imaging taught us?[J].JACC Cardiovasc Imaging,2014,7(5):515-525.
[6] Uzasci L,Nath A,Cotter R.Oxidative stress and the HIV-infected brain proteome[J].J Neuroimmune Pharmacol,2013,8(5):1167-1180.
[7] 金小荣,秦俊法,楼蔓藤,等.氧化应激与艾滋病[J].广东微量元素科学,2009,16(8):1-20.
[8] Vashistha H,Husain M,Kumar D,etal.Tubular cell HIV-1 gp120 expression induces caspase 8 activation and apoptosis[J].Ren Fail,2009,31(4):303-312.
[9] Snyder A,Alsauskas ZC,Leventhal JS,etal.HIV-1 viral protein R induces ERK and caspase-8 dependent apoptosis in renal tubular epithelial cells[J].AIDS,2010,24(8):1107-1119.
[10] Zhang H,Zhang HM,Wu LP,etal.Impaired mitochondrial complex III and melatonin responsive reactive oxygen species generation in kidney mitochondria of db/db mice[J].J Pineal Res,2011,51(3):338-344.
[11] 黄智勇,林淑华,谢红.艾滋病病毒阳性透析者的管理[J].中国中西医结合肾病杂志,2015,16(12):1102-1103.
[12] 江涛.HIV感染相关的肾脏疾病日趋增加[J].国外医学情报,2006,27(7):38-39.
[13] 范敏华.HIV相关性肾脏疾病[J].中国全科医学,2006,9(2):93-95.
[14] 刘涛.甲减大鼠肾脏脂质过氧化及GPx、SOD基因水平的实验研究[D].石家庄:河北医科大学,2007.
[15] 李莉平,康佳丽,夏薇.HIV致病机制的研究进展[J].细胞与分子免疫学杂志,2007,23(9):886-889.
[16] 史毓杰.HIV诱导T细胞凋亡机制研究进展[J].中国皮肤性病学杂志,2005,19(3):179-182.
[17] Gavrieli M,Watanabe N,Loftin SK,etal.Characterization of phosphotyrosine binding motifs in the cytoplasmic domain of B and T lymphocyte attenuator required for association with protein tyrosine phosphatases SHP-1 and SHP-2[J].Biochem Biophys Res Commun,2003,312(4):1236-1243.
[18] Salghetti S,Mariani R,Skowronski J.Human immunodeficiency virus type 1 Nef and p56lck protein tyrosine kinase interactwith a common element in CD4 cytoplasmic tail[J].Proc Natl Acad Sci USA,1995,92(2):349-353.
[19] Collins KL,Chen BK,Kalams SA,etal.HIV-1 Nef protein protects infected primary cells against killing by cytotoxic T lymphocytes[J].Nature,1998,391(6665):397-401.
[20] Conti L,Rainaldi G,Matarrese P,etal.The HIV-1 vpr protein acts as a negative regulator of apoptosis in a human lymphoblastoid T cell line: possible implications for the pathogenesis of AIDS[J].J Exp Med,1998,187(3):403-413.
[21] 邬皓晨,陈勇军,徐易尘,等.Caspase-1在炎症及程序性细胞死亡过程中的作用[J].中国细胞生物学学报,2011,33(2):182-189.
Gene expression of oxidative stress and cell apoptosis of kidney in HIV-1 Tg rats
GAO Jiping,HUANG Fubing,LI Lihong,SONG Guohua*
(LaboratoryAnimalCenter,ShanxiMedicalUniversity,Taiyuan030001,China;*Correspondingauthor,E-mail:ghsongg@hotmail.com)
ObjectiveTo detect the mRNA expression of COX3,COX5a,SOD2,GPx4,Caspase-1,Bax,BCL2L1,FasLg in the kidney of HIV-1 Tg rats and F344 normal rats,and explore its relationship with renal pathology induced by HIV-1.MethodsSYBR Green based real-time fluorescence quantitative PCR with GAPDH as internal reference was performed for evaluating the expression of COX3,COX5a,SOD2,GPx4,Caspase-1,Bax,BCL2L1,FasLg genes in the kidney of F344 and HIV-1Tg rats.ResultsThe gene expression level of COX3,COX5a,SOD2,GPx4 in HIV-1 Tg rats respectively was 0.440,0.791,1.703,0.346 times of F344 normal rats.The gene expression levels of SOD2 were significantly higher in HIV-1 Tg rats than those of F344 normal rats,and the levels of COX3,COX5a,GPx4 were lower(P<0.05).The gene expression levels of Caspase-1,BCL2L1,Bax,FasLg in HIV-1 Tg rats respectively were 1.389,1.145,0.400,0.590 times of F344 normal rats.Compared with F344 rats,the gene expression levels of caspase-1 and BCL2L1 mRNA significantly increased,but Bax and FasLg significantly decreased in HIV-1 Tg rats(P<0.05).ConclusionHIV-1 can induce the oxidative stress by down-regulating gene expression levels of antioxidant enzyme and inhibit the renal cell apoptosis by regulating apoptosis-related gene expression levels.
HIV; transgenic rat; gene expression; oxidative stress; cell apoptosis; kidney
高继萍,女,1987-07生,硕士,助理实验师,E-mail:gaojiping951753@163.com
2016-12-29
R512.91
A
1007-6611(2017)06-0530-05
10.13753/j.issn.1007-6611.2017.06.004

