腺病毒介导的色素上皮衍生因子对小鼠黑色素瘤肺转移的抑制作用
陈巧玲,白亦光,付 曦,何 朗,冯 刚
(1川北医学院第二临床医学院,南充市中心医院肿瘤科,南充 637000;2川北医学院第二临床医学院,南充市中心医院骨科;3川北医学院第二临床医学院,南充市中心医院组织工程与干细胞研究所;*通讯作者,E-mail:lssmd18@gmail.com)
腺病毒介导的色素上皮衍生因子对小鼠黑色素瘤肺转移的抑制作用
陈巧玲1,白亦光2,付 曦1,何 朗1,冯 刚3*
(1川北医学院第二临床医学院,南充市中心医院肿瘤科,南充 637000;2川北医学院第二临床医学院,南充市中心医院骨科;3川北医学院第二临床医学院,南充市中心医院组织工程与干细胞研究所;*通讯作者,E-mail:lssmd18@gmail.com)
目的 探讨腺病毒介导的色素上皮衍生因子(Ad-PEDF)对小鼠B16F10黑色素瘤肺转移模型的治疗作用。 方法 在体外用MTT实验测定Ad-PEDF感染复数(multiplicity of infection,MOI)为50,100,150,200,250时对B16F10细胞增殖的抑制作用,Transwell实验检测Ad-PEDF对B16F10细胞侵袭的抑制作用,以PBS和空载腺病毒(Ad-null)作为对照。在体内通过尾静脉接种小鼠B16F10细胞建立肺转移模型,将小鼠随机分为3组,分别经尾静脉注射100 μl PBS、100 μl Ad-null(1×108PFU)和100 μl Ad-PEDF(1×108PFU)。隔日注射1次,共5次。观察静脉注射Ad-PEDF对黑色素瘤肺转移结节数量以及肺湿重的影响。对肺转移灶进行TUNEL染色检测肿瘤细胞的凋亡情况。 结果 MTT实验显示,Ad-PEDF在不同的MOI值下均能对B16F10细胞产生作用,并随着MOI值的增加抑制率逐渐升高,与Ad-null组相比,差异有统计学意义(P<0.01)。Transwell实验显示,Ad-PEDF组与PBS组和Ad-null组相比,穿膜的肿瘤细胞数明显下降,侵袭能力受到显著抑制(123.3±21.9vs220.3±26.8,213.5±35.5,P<0.01)。体内实验结果提示,Ad-PEDF组小鼠的肺部转移灶较PBS组和Ad-null组明显减少(47.7±14.1vs75.1±20.9,73.3±17.3,P<0.05)。而Ad-PEDF组的小鼠肺湿重[(0.26±0.06)g]也明显低于PBS组[(0.39±0.05)g]和Ad-null组[(0.37±0.07)g],差异有统计学意义(均P<0.05)。TUNEL实验显示,Ad-PEDF组肺转移灶肿瘤细胞凋亡率较PBS组和Ad-null组增多(25.3%±3.3%vs3.9%±1.2%,4.1%±1.4%,P<0.01)。 结论 腺病毒介导的PEDF能够显著抑制小鼠黑色素瘤肺转移灶的形成,其作用机制可能为抑制肿瘤细胞增殖和侵袭,以及诱导肿瘤细胞凋亡。
色素上皮衍生因子; 腺病毒载体; 黑色素瘤; 肺转移
皮肤黑色素瘤是一种高度恶性的皮肤肿瘤,侵袭性强,极易复发和转移,而一旦出现转移则临床预后极差,因此抑制其侵袭和转移是临床治疗的重点[1]。色素上皮衍生因子(PEDF)是一种50 kDa的分泌型糖蛋白,在胎儿及成人组织内广泛表达,被认为是最有潜力的内源性血管生成抑制因子[2]。近来研究发现PEDF还具有直接的抗肿瘤作用:如抑制肿瘤细胞增殖和转移、促进肿瘤细胞凋亡、促进肿瘤细胞分化等[2]。研究显示,PEDF在多种肿瘤中呈低表达,而低表达或不表达PEDF的肿瘤具有更强的增殖能力和侵袭转移能力[3]。本实验利用复制缺陷型腺病毒作为PEDF基因载体,通过体内外研究观察重组PEDF腺病毒对小鼠B16F10细胞增殖和迁移的抑制作用及其机制。
1 材料与方法
1.1 细胞株、腺病毒和实验动物
小鼠黑色素瘤细胞株B16F10购自ATCC,由南充市中心医院组织工程与干细胞研究所保存;细胞培养使用DMEM培养基加入10%胎牛血清,2 mmol/L链霉素和100 μg/ml阿米卡星。携带PEDF基因的重组腺病毒(Ad-PEDF)由四川大学生物治疗国家重点实验室提供,腺病毒的扩增与纯化方法如前所述[4];6-8周龄雌性C57BL/6小鼠,清洁级,购自四川大学华西实验动物中心,生产许可证号:SCXK(川)2005-09。
1.2 主要试剂和仪器
DMEM培养基(Gibco,USA),10%胎牛血清(FBS,Gibco,USA),MTT溶液(Sigma,USA),DMSO溶液(Sigma,USA),Transwell小室(Millipore,USA),基质胶(BD Biosciences,USA);原位凋亡检测(TUNEL)试剂盒(Promega,USA);荧光显微镜(Olympus BX51,Japan)。
1.3 细胞培养
小鼠黑色素瘤B16细胞用含有10%FBS的DMEM培养基于37 ℃、5% CO2培养,用0.25%胰蛋白酶消化并传代,每3 d传代1次。
1.4 MTT法检测Ad-PEDF对B16F10细胞增殖能力的影响
将对数生长期的B16F10细胞悬液按2×103个/孔接种于96孔板,每孔体积100 μl。置于37 ℃,5% CO2培养过夜。待细胞贴壁后分别加入PBS(阴性对照)以及感染复数(multiplicity of infection,MOI)分别为50,100,150,200,250的Ad-null(空载腺病毒)和Ad-PEDF,体积均为50 μl,每组设置4个复孔,继续培养48 h。每孔加入浓度为的MTT溶液(5 mg/ml)10 μl,并继续培养4 h。弃去上清液,加入150 μl DMSO,振荡10 min,490 nm波长测定各孔光吸收值(OD),以不含细胞的等体积培养基作为空白对照。得到数值后按如下公式进行计算:细胞生长抑制率(%)=[1-(OD试验-OD空白)/(OD对照-OD空白)]×100%。
1.5 Transwell实验检测Ad-PEDF对B16F10细胞侵袭能力的影响
在Transwell小室上层底部用50 μl的基质胶覆盖。将B16F10细胞以1×105个/孔置于Transwell迁移小室上层小室中,上室加入无血清培养基100 μl,下室加入含有10%胎牛血清的培养基600μl。分别在上室培养基中加入NS、Ad-null(MOI 200)、Ad-PEDF(MOI 200)各50 μl,每组设置2个复孔。37 ℃、5% CO2继续培养24 h后,用棉棒擦去上室细胞,PBS清洗后用结晶紫染色,倒置显微镜下计数100倍下5个视野,统计细胞迁移率。
1.6 B16黑色素瘤肺转移模型的建立
收集对数生长期、生长状态良好的B16F10细胞,胰酶消化,离心计数,用无菌生理盐水调整细胞浓度至5×106个/ml。将B16F10细胞沿尾静脉注射于C57BL/6小鼠体内,5×105个/只,共30只,并随机分为3组。于接种后第2日开始分别经尾静脉注射100 μl PBS、100 μl Ad-null(1×108PFU)和100 μl Ad-PEDF(1×108PFU)。隔日注射1次,共5次,并定期观察小鼠状态和体重。于接种后第20 d,断颈处死实验小鼠,解剖取下肺,统计肺部转移结节数,并称肺组织湿重。
1.7 统计学分析
实验数据用均数±标准差来表示,采用SPSS 17.0统计软件来进行数据分析。多组之间比较采用单因素方差分析(ANOVA),两两比较用t检验进行处理。P<0.05判定差异具有统计学意义。
2 结果
2.1 Ad-PEDF对B16F10细胞增殖能力的影响
通过MTT法检测Ad-PEDF对B16F10黑色素瘤细胞的增殖抑制情况,以PBS组作为阴性对照组。结果显示,Ad-PEDF在MOI值为200时对B16F10细胞的抑制率为55.2%±0.9%,并随着腺病毒浓度的增加抑制率逐渐升高,说明抑制率与浓度呈剂量依赖效应。Ad-null则对B16F10细胞无明显抑制作用。Ad-PEDF组与Ad-null组相比,抑制率差异有统计学意义(图1,P<0.01)。以上实验结果表明,Ad-PEDF可抑制B16F10细胞增殖。
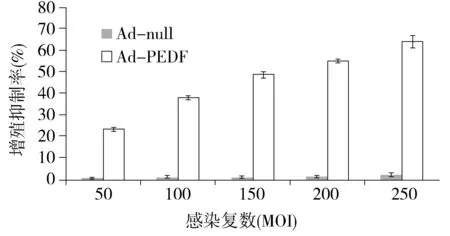
图1 Ad-PEDF体外抑制B16F10细胞增殖Figure 1 Ad-PEDF inhibits the B16F10 cells proliferation in vitro
2.2 Ad-PEDF对B16F10细胞侵袭能力的影响
Transwell实验显示,B16F10细胞经Ad-PEDF处理24 h后,穿膜的肿瘤细胞数明显下降(123.3±21.9),与PBS组(220.3±26.8)和Ad-null组(213.5±35.5)相比,差异有统计学意义(P<0.01,见图2)。而Ad-null组与PBS组差异无统计学意义。说明Ad-PEDF对小鼠黑色素瘤细胞迁移具有抑制作用。
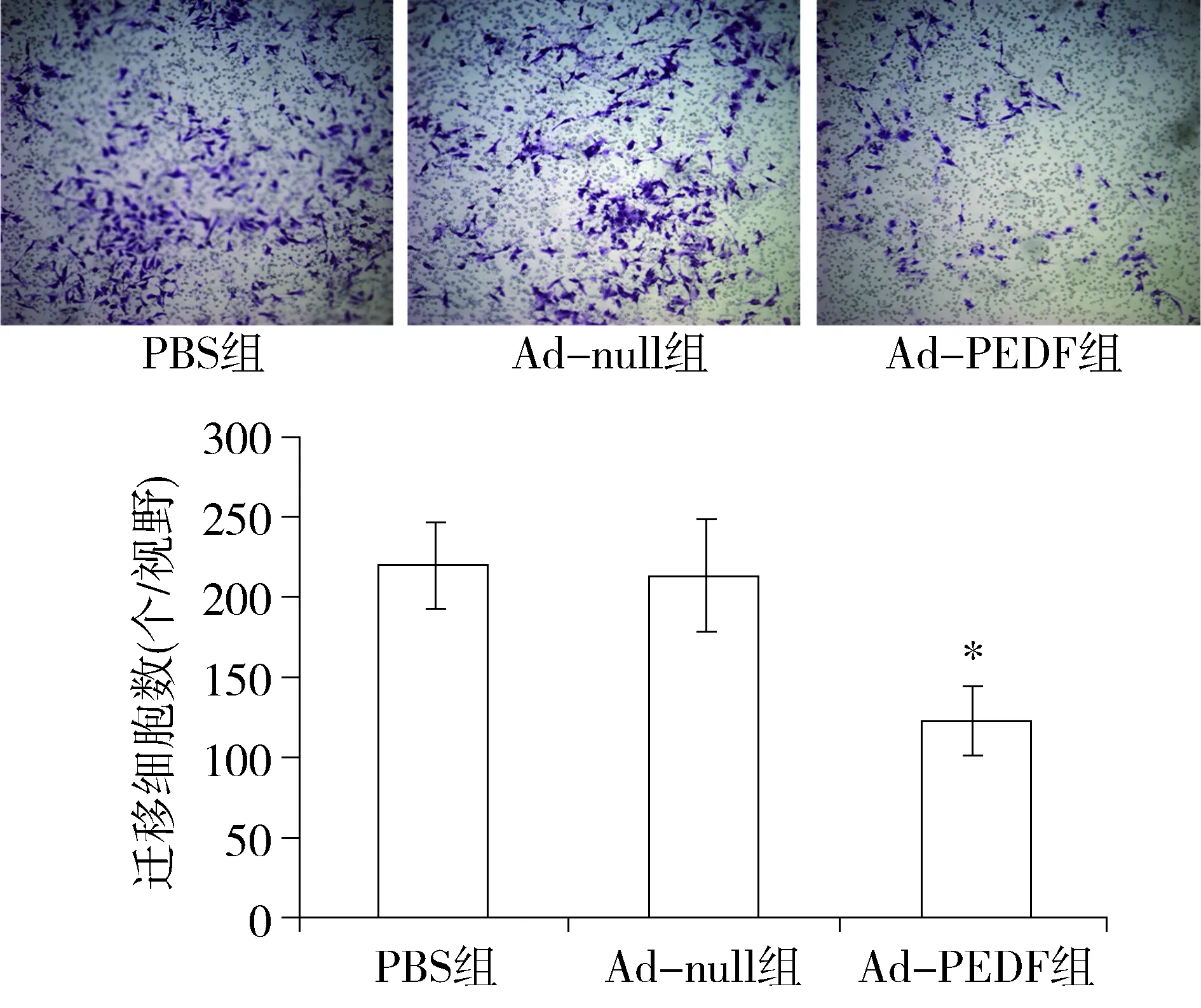
与PBS组和Ad-null组比较,*P<0.01图2 Ad-PEDF体外抑制B16F10细胞迁移(×100)Figure 2 Ad-PEDF inhibit the B16F10 cells migration in vitro(×100)
2.3 Ad-PEDF体内抑制黑色素瘤肺转移
用Ad-PEDF通过尾静脉给药的方式治疗B16F10黑色素瘤肺转移模型,于接种第20天处死小鼠并观察小鼠肺部肿瘤转移情况。PBS组和Ad-null组肺部转移灶平均值分别为(75.1±20.9)个和(73.3±17.3)个,而Ad-PEDF组的肺部转移灶明显减少,仅为(47.7±14.1)个,与前两组相比,差异有统计学意义(P<0.05,见图3)。Ad-PEDF组的小鼠肺湿重明显低于PBS组和Ad-null组[(0.26±0.06)g,(0.39±0.05)gvs(0.37±0.07)g,差异有统计学意义(P<0.05,见图4)。
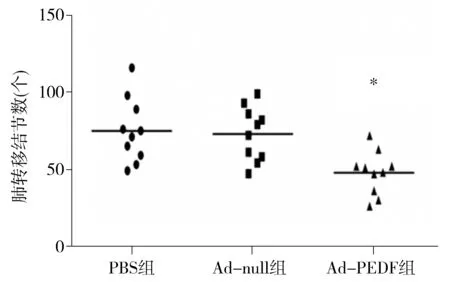
与PBS组和Ad-null组比较,*P<0.05图3 各组小鼠肺表面转移结节数Figure 3 The numbers of metastatic foci on lung surface in mice
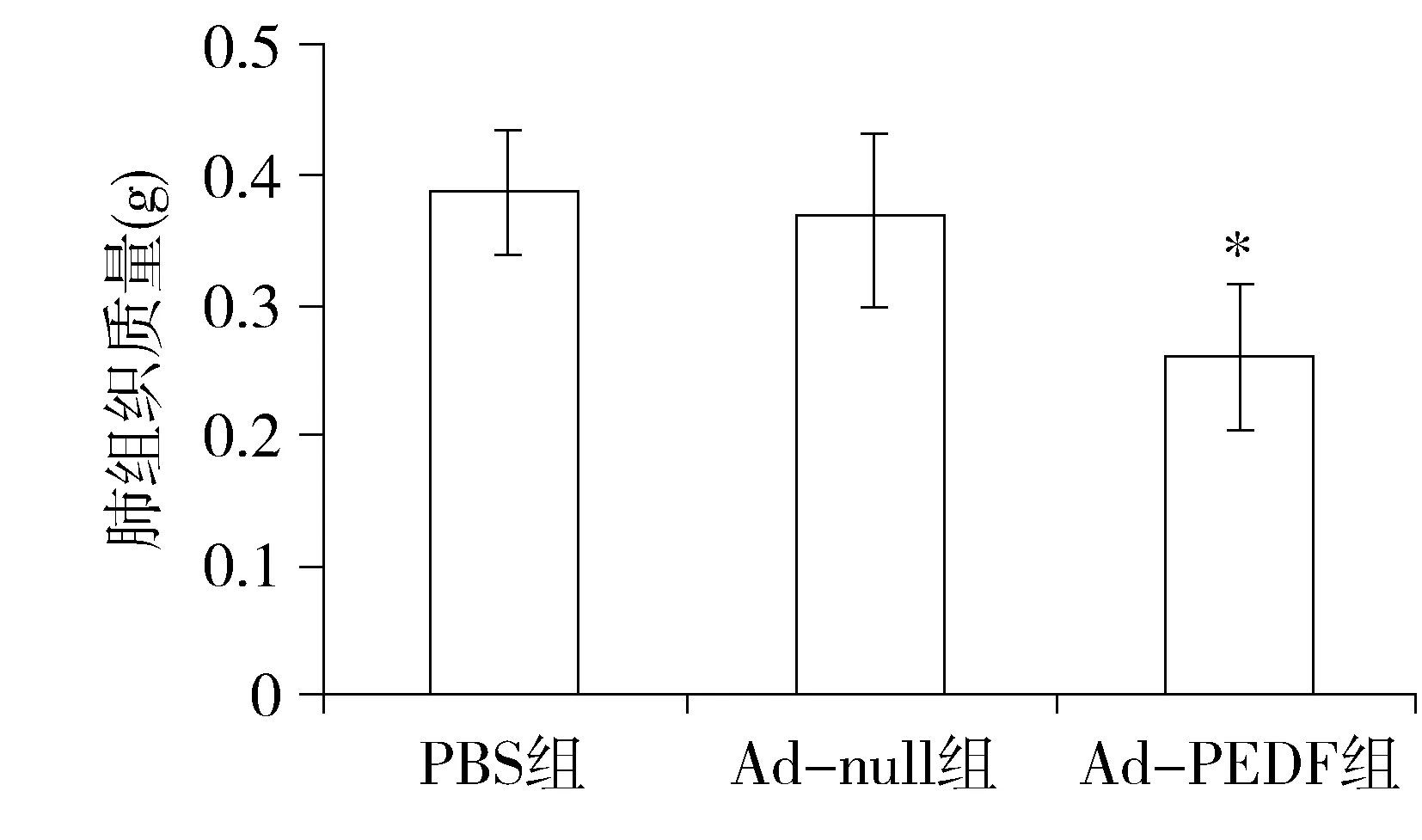
与PBS组和Ad-null组比较,*P<0.05图4 各组小鼠肺组织湿重Figure 4 The wet weight of lungs in mice after different treatment
2.4 肺部肿瘤组织原位凋亡检测
对肺部的肿瘤组织石蜡切片进行TUNEL染色及凋亡细胞计数。荧光显微镜下可观察到,凋亡细胞的染色质呈致密浓染的块状或颗粒状绿色荧光,呈散在分布。凋亡细胞计数结果显示,Ad-PEDF组的肿瘤细胞凋亡率明显高于PBS组及Ad-null组(P<0.01,见图5)。
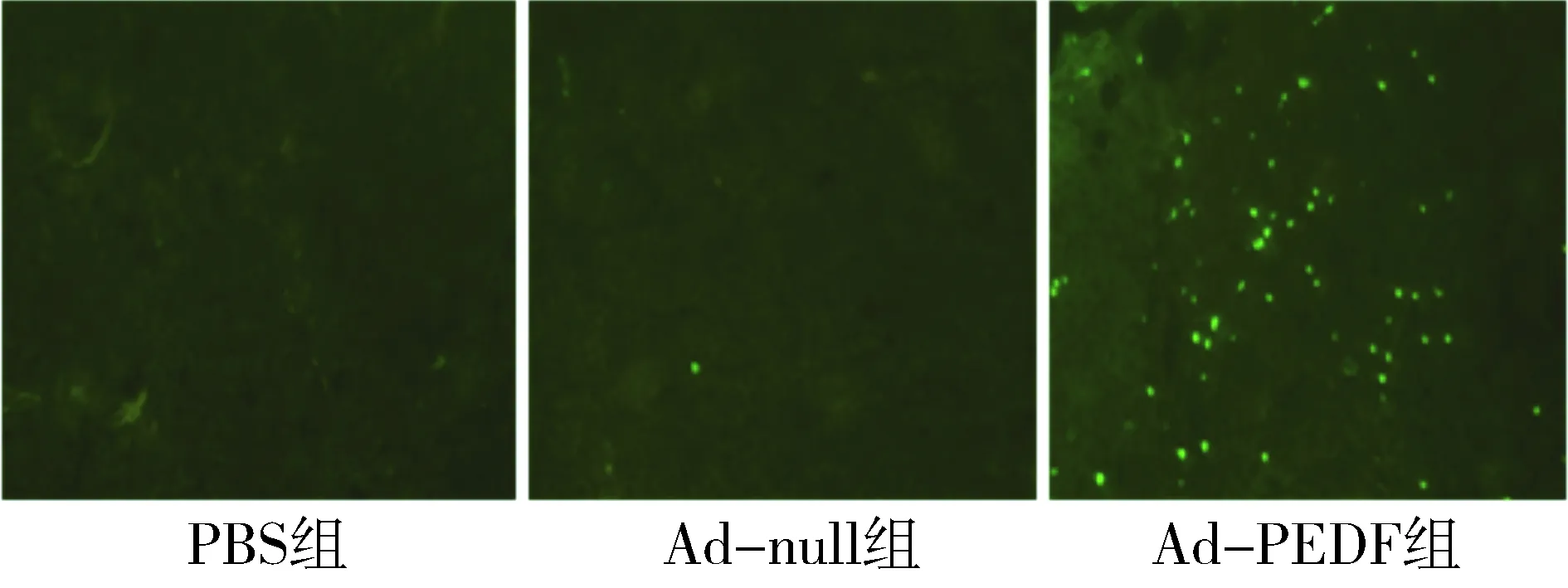
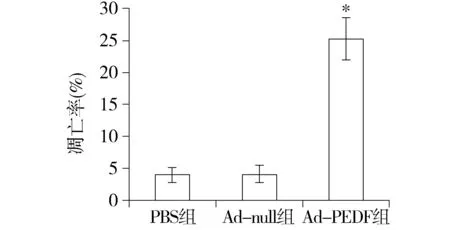
与PBS组和Ad-null组比较,*P<0.01图5 TUNEL染色检测肿瘤组织中肿瘤细胞凋亡率(×200)Figure 5 Apoptosis of tumor cells by TUNEL staining(×200)
3 讨论
侵袭与转移是恶性肿瘤最显著的生物学特征,是导致肿瘤患者死亡的主要原因,抑制肿瘤的侵袭和转移是恶性肿瘤治疗成败的关键因素[5]。PEDF作为一种多功能蛋白,不仅具有抗血管生成的作用,更可通过抑制肿瘤侵袭和转移、促进肿瘤细胞凋亡等直接途径发挥抗肿瘤作用[2,3]。PEDF在多种肿瘤中表现出抑制转移的效应,包括黑色素瘤、骨肉瘤、前列腺癌、神经胶质瘤等[6]。有研究发现,PEDF能下调基质金属蛋白酶MMP-9以及与胶原Ⅰ和Ⅲ结合,从而降低肿瘤细胞的侵袭性[7]。本研究通过MTT和Transwell实验也观察到重组PEDF腺病毒可在体外抑制B16F10黑色素瘤细胞的增殖和迁移。黑色素瘤易发生肺转移,通过尾静脉注射黑色素瘤细胞的方式建立肺转移模型,能直观反映肿瘤细胞在血管内转移情况,可以较好地评价药物的抗肿瘤转移作用。本实验结果显示,Ad-PEDF在体内可显著抑制小鼠肺表面的转移灶数量,治疗组小鼠的肺湿重也明显低于PBS组及Ad-null组。Palmieri等[8]在体外实验中发现PEDF能够通过诱导子宫内膜癌细胞凋亡而抑制其生长,且抑制作用呈时间、剂量依赖性。很多研究也证实PEDF能对结肠癌、骨肉瘤、黑色素瘤细胞有着直接的凋亡效应[9-11]。在本研究中,TUNEL实验显示,Ad-PEDF组肺部肿瘤凋亡率较PBS组和Ad-null组明显增多,提示Ad-PEDF可同时通过促进肿瘤细胞凋亡从而抑制转移灶肿瘤生长。
基因转运技术是肿瘤基因治疗的重要环节之一,寻找合适的基因转运载体一直是研究的重点。其中腺病毒载体因感染及表达效率高、制备方法相对简单、可获得高滴度纯化载体且不整合入宿主细胞染色体等诸多优点,成为基因治疗中应用最为广泛的载体系统[12]。虽然重组PEDF腺病毒在本研究中表现出明显的抗肿瘤效应,但如应用于临床仍面临着很多问题:腺病毒缺乏靶向性,可能会在肿瘤外的器官和组织中也高表达目的基因;腺病毒载体具有抗原性,会引起机体产生针对性抗体[13]。故需进一步观察其远期副作用,以及寻找更具靶向性和安全性的联合治疗方案,如联合细胞载体、阳离子脂质体或其他靶向载体等。
本研究证实,腺病毒介导的PEDF可通过抑制黑色素瘤细胞增殖、侵袭,并诱导肿瘤细胞凋亡,从而抑制黑色素瘤肺转移,为肿瘤基因治疗研究提供了实验基础。
[1] Lee CS,Thomas CM,Ng KE.An overview of the changing landscape of treatment for advanced melanoma[J].Pharmacotherapy,2017:Epub ahead of print.
[2] Belkacemi L,Zhang SX.Anti-tumor effects of pigment epithelium-derived factor(PEDF):implication for cancer therapy.A mini-review[J].J Exp Clin Cancer Res,2016,35:4.
[3] Hoshina D,Abe R,Yamagishi SI,etal.The role of PEDF in tumor growth and metastasis[J].Curr Mol Med,2010,10(3):292-295.
[4] 陈巧玲,别俊,白亦光,等.骨髓间充质干细胞作为携带PEDF基因载体的可行性研究[J].西部医学,2015,27(10):1464-1471.
[5] 沈阳,田立志,项鹏程,等.PEDF在肿瘤生长和转移中的作用[J].现代生物医学进展,2015,15(5):995-997.
[6] Broadhead ML,Dass CR,Choong PF.Invitroandinvivobiological activity of PEDF against a range of tumors[J].Expert Opin Ther Targets,2009,13(12):1429-1438.
[7] 向江东,周莉娜,席晓薇.PEDF在肿瘤中的研究进展[J].现代肿瘤医学,2011,19(4):0812-0815.
[8] Palmieri D,Watson JM,Rinehart CA.Age-related expression of PEDF/EPC-1 in human endometrial stromal fibroblasts:implications for interactive senescence[J].Exp Cell Res,1999,247(1):142-147.
[9] Cui FY,Song XR,Li ZY,etal.The pigment epithelial-derived factor gene loaded in PLGA nanoparticles for therapy of colon carcinoma[J].Oncol Rep,2010,24(3):661-668.
[10] Ek ET,Dass CR,Contreras KG,etal.Pigment epithelium-derived factor overexpression inhibits orthotopic osteosarcoma growth,angiogenesis and metastasis[J].Cancer Gene Ther,2007,14(7):616-626.
[11] Yang LP,Cheng P,Peng XC,etal.Anti-tumor effect of adenovirus-mediated gene transfer of pigment epithelium-derived factor on mouse B16-F10 melanoma[J].J Exp Clin Cancer Res,2009,28:75.
[12] 刘阳,杜联芳.腺病毒载体的研究进展[J].医学综述,2015,21(24):4438-4440.
[13] 杨亚利,丁振宇,李秋,等.用脂质体包裹重组survivin腺病毒治疗肿瘤的实验研究[J].四川大学学报(医学版),2006,37(5):704-707.
Inhibitive effect of recombinant adenoviruses loaded with pigment epithelium-derived factor gene on pulmonary metastases of melanoma in mice
CHEN Qiaoling1,BAI Yiguang2,FU Xi1,HE Lang1,FENG Gang3*
(1DepartmentofOncology,NanchongCentralHospital,SecondClinicalCollegeofNorthSichuanMedicalCollege,Nanchong637000,China;2DepartmentofOrthopedics,NanchongCentralHospital,SecondClinicalCollegeofNorthSichuanMedicalCollege;3ResearchInstituteofTissueEngineeringandStemCell,NanchongCentralHospital,SecondClinicalCollegeofNorthSichuanMedicalCollege;*Correspondingauthor,E-mail:lssmd18@gmail.com)
ObjectiveTo explore the inhibitive effect of recombinant adenoviruses loaded with pigment epithelium-derived factor gene on pulmonary metastases of melanoma B16F10 in mice.MethodsMTT and Transwell assays were performed to observe the inhibitive effect of Ad-PEDF on B16F10 cells proliferation and invasion ability of B16F10 cells with PBS and adenovirus vector(Ad-null) as the controls.The C57BL/6 mice pulmonary metastases models of melanoma were established by the injection of B16F10 cells via tail vein.Then 30 tumor-bearing mice were randomly divided into 3 groups:PBS group,Ad-null group and Ad-PEDF group.The mice were intravenously administrated with PBS(100 μl),adenoviruses vector(1×108PFU,100 μl) or Ad-PEDF(1×108PFU,100 μl) every other day for five times,respectively.The influence of Ad-PEDF on the pulmonary metastases nodule numbers was observed,and the wet weight of the lungs in mice was calculated.The apoptosis of the tumor cells in metastasis nodules was detected by TUNEL assay.ResultsMTT assay showed that B16F10 cells proliferation decreased in a dose-dependent manner after treatment with different multiplicity of infection(MOI)of Ad-PEDF(P<0.01).Transwell assay demonstrated that the number of B16F10 cells migrating to the other side of the membrane in Ad-PEDF group was markedly decreased compared with PBS group or Ad-null group(123.3±21.9vs220.3±26.8,213.5±35.5,P<0.01).Theinvivoresults showed that the number of pulmonary metastases nodules in Ad-PEDF group was less than in PBS group and Ad-null group(47.7±14.1vs75.1±20.9,73.3±17.3,P<0.05).And the wet weight of the lungs was reduced in Ad-PEDF group compared with PBS group and Ad-null group[(0.26±0.06)gvs(0.39±0.05)g,(0.37±0.07)g,P<0.05].The TUNEL assay showed that Ad-PEDF increased the apoptosis rate of tumor cells in lung metastasis foci compared with PBS and Ad-null(25.3%±3.3%vs3.9%±1.2%,4.1%±1.4%,P<0.01).ConclusionAd-PEDF can inhibit the pulmonary metastasis of melanomainvitroandinvivo.
pigment epithelium-derived factor; adenoviruses; melanoma; pulmonary metastases
国家自然科学基金资助项目(30872614);四川省教育厅理科重点项目(15ZA0216,15ZB0201);南充市科技局科技支撑项目(14A0017,14A0022);川北医学院科研发展计划资助项目(CBY14-A-ZD02,CBY15-A-ZD02);四川省卫计委科研基金资助项目(16PJ202)
陈巧玲,女,1983-02生,博士,主治医师,E-mail:cql166@163.com
2017-02-21
R739.5
A
1007-6611(2017)06-0534-05
10.13753/j.issn.1007-6611.2017.06.005

