肝宁方对肝细胞内质网应激相关分子GRP78蛋白及其mRNA表达的影响
李椿莹,文 彬,李福英,邓 鑫*
·论著·
·中医·中西医结合研究·
肝宁方对肝细胞内质网应激相关分子GRP78蛋白及其mRNA表达的影响
李椿莹1,文 彬2,李福英1,邓 鑫2*
目的 探讨肝宁方对肝细胞内质网应激(ERS)相关分子葡萄糖调节蛋白78(GRP78)蛋白及其mRNA表达的调控作用及临床意义。方法 本研究时间为2015年10月—2016年7月。SPF级SD健康大鼠20只用于制备肝宁方血清;衣霉素溶于DMSO溶液,完全溶解后加入含有胎牛血清的培养液制备衣霉素培养液。将HL-7702肝细胞分为正常对照组、ERS模型组、肝宁方治疗组。正常对照组予正常培养液培养,ERS模型组予衣霉素培养液培养,肝宁方治疗组予含肝宁方血清的衣霉素培养液培养。采用qRT-PCR测定各组肝细胞ERS中GRP78 mRNA表达水平及Western blotting法检测相应蛋白的表达水平。结果 ERS模型组肝细胞GRP78 mRNA表达水平高于正常对照组(P<0.05);肝宁方治疗组肝细胞GRP78 mRNA表达水平低于ERS模型组(P<0.05)。ERS模型组与肝宁方治疗组GRP78蛋白表达水平高于正常对照组(P<0.05);肝宁方治疗组GRP78蛋白表达水平低于ERS模型组(P<0.05)。结论 肝宁方能够改善肝功能损伤情况,有效降低肝细胞的凋亡,其机制可能与抑制肝细胞内GRP78的表达有关。
肝细胞;内质网应激;肝宁方;葡萄糖调节蛋白78
李椿莹,文彬,李福英,等.肝宁方对肝细胞内质网应激相关分子GRP78蛋白及其mRNA表达的影响[J].中国全科医学,2017,20(21):2644-2648.[www.chinagp.net]
LI C Y,WEN B,LI F Y,et al.Effect of Ganning Decoction on the mRNA and protein expression levels of GRP78 associated with hepatic endoplasmic reticulum stress[J].Chinese General Practice,2017,20(21):2644-2648.
内质网(ER)是细胞蛋白质合成、折叠、分泌、运输和Ca2+存储的重要场所,肝细胞内含有丰富的ER。近年来内质网应激(ERS)调节肝脏疾病方面的研究较广泛[1]。葡萄糖调节蛋白78(GRP78)是ER分子伴侣,是促进胞蛋白质成熟、维系细胞功能和存活的关键性调节蛋白,在ERS的激活过程中发挥重要作用,是ERS的标志性蛋白[2-3]。课题组的前期研究结果表明,肝宁方可改善肝脏炎症状态,保护受损肝细胞,有效减轻肝纤维增生程度,提高机体氧化应激能力,改善机体代谢,在改善临床症状及肝功能方面均有较好的疗效[4-5]。本研究通过采用qRT-PCR、Western blotting法观察肝宁方对肝细胞ERS相关分子GRP78蛋白及其mRNA表达的影响,探讨肝宁方对肝细胞ERS的调控作用及其机制。
1 材料与方法
1.1 实验动物 本研究时间为2015年10月—2016年7月。SPF级SD健康大鼠20只,6~7周龄,雄性,体质量(180±20)g,购自广西医科大学动物实验中心,动物合格证:scxk 桂2015-0008,置于恒温(25 ℃),湿度50%的环境中饲养。
1.2 主要试剂及仪器 Trizol试剂(北京百奥森泰生物技术有限公司),RNA提取试剂盒(美国Sigma公司),四季青胎牛血清(北京索莱宝科技有限公司),RPMI-1640培养基(美国Gibco公司),青链霉素混合液(北京索莱宝科技有限公司),DMSO试剂(美国Amresco公司),DEPC处理水(上海碧云天生物技术有限公司),0.25%胰酶及2 mg/ml Ⅰ型胶原酶(北京索莱宝生物科技有限公司),肝宁方(广西中医/民族医药研发基地),衣霉素(美国Sigma 公司),反转录试剂盒及SYBR Green荧光定量染料法试剂盒(美国Thermo fisher 公司),GRP78多克隆抗体(Abcam美国公司),β-actin 多克隆抗体(美国Santa Cruz 公司),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒(上海碧云天生物技术有限公司)。电泳仪及电转仪(美国伯乐公司),0-2PE型荧光倒置显微镜(日本OLYMPUS 公司),3-16K高速冷冻离心机(美国Sigma 公司),PCR扩增仪(德国Eppendoff公司)。
1.3 药物制备
1.3.1 完全培养液配制 每100 ml的RPMI-1640培养基中加入10%胎牛血清、1%的青链霉素混合液,放置于4 ℃冰箱保存备用。
1.3.2 肝宁方血清制备 SPF级SD大鼠20只,按照大鼠体质量灌胃给予肝宁方,25 g·kg-1·d-1,2次/d,连续给药7 d,最后1 d禁食24 h。末次给足全天药量2 h后,腹腔内注射乳化异氟烷麻醉,解剖,腹主动脉取血,37 ℃水浴60 min,高速离心机,3 000 r/min离心15 min(离心半径为5 cm),然后取上清液,56 ℃水浴30 min灭活补体,过滤除菌,-57 ℃条件下真空干燥48 h形成干燥粉末,保存备用。
1.3.3 衣霉素培养液制备 将1 mg衣霉素溶于200 μl的DMSO试剂,待衣霉素完全溶解后加入含有胎牛血清的完全培养液,配成50 ml含有衣霉素的培养液,置放于-20 ℃冰箱冻存备用,使用前置于4 ℃冰箱溶解。
1.4 实验方法
1.4.1 人正常肝细胞株HL-7702细胞培养 将人正常肝细胞株HL-7702(购自中国科学院细胞库)置于25 cm2的培养瓶中,加入含5 ml的完全培养液,无菌条件下置于5 ℃ CO2恒温孵育箱内培养,温度为37 ℃,饱和湿度,每2 d换液一次,常规培养48 h,倒置显微镜下观察细胞形态、贴壁情况和生长状况,取对数生长期细胞用于实验检测。
1.4.2 实验分组 将HL-7702肝细胞分别设置为正常对照组、ERS模型组、肝宁方治疗组,每组细胞分别置于25 cm2的细胞培养瓶中,正常对照组予正常培养液培养,ERS模型组予衣霉素培养液培养,肝宁方治疗组予含肝宁方血清的衣霉素培养液培养。3组细胞培养72 h后分离提取细胞。
1.5 ERS模型组细胞培养 取对数生长期的HL-7702肝细胞常规培养24 h后,在倒置显微镜下观察细胞形态、贴壁情况和生长状况,待细胞生长至50%时,将含有0.30 μg/ml浓度的衣霉素培养液加入到常规培养的HL-7702肝细胞培养瓶内干预,放入恒温箱内培养48 h(衣霉素浓度及培养时间根据不同的实验目的而定,本研究选择对细胞生长有抑制作用,但不会使大量细胞凋亡的浓度作为诱导形成ERS的适宜浓度和时间),培养48 h后更换常规培养液,在37 ℃、5%CO2、95%湿度条件下再继续培养6 h。
1.6 肝宁方治疗组细胞培养 将灭菌后的大鼠含药血清按照10 μg/ml浓度加入含有胎牛血清的完全培养液中备用。肝宁方治疗组在ERS模型组完成的基础上加入含有10 μg/ml含药血清培养液,培养72 h后分离细胞。
1.7 qRT-PCR测定GRP78 mRNA的表达 根据实验分组的不同方法,PBS冲洗2次后,弃去PBS,每瓶细胞内加入1 ml Trizol试剂,反复吹打使细胞裂解后移入离心管,加入200 μl CCl4,混匀,4 ℃高速离心机,12 000 r/min离心15 min(离心半径为12 cm)后取上清液,加入200 μl异丙醇,冰上放置10 min,4 ℃高速离心机,12 000 r/min离心10 min(离心半径为12 cm)后去上清液,加入预冷的 1 ml 75%乙醇,4 ℃高速离心机,8 000 r/min离心5 min(离心半径为7 cm)后去上清,加入20 μl DEPC处理水溶解RNA沉淀;紫外分光光度仪检测RNA纯度和浓度;采用反转录试剂盒将提取的肝细胞总RNA反转录合成cDNA后进行qRT-PCR检测,反应体系配制及反应条件严格按照SYBR Green荧光定量染料法试剂盒说明书进行操作,以SYBR Green荧光染料法进行qRT-PCR检测GRP78 mRNA表达水平。以GAPDH作为内参照,PCR反应条件为:94 ℃预变性3 min;扩增40个循环:95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s。上述实验重复3次。用2-ΔΔCt法计算各组肝细胞中GRP78 mRNA表达水平。
1.8 Western blotting法检测GRP78 蛋白表达 按实验分组收集各组细胞,PBS冲洗2次,分别加入500 μl的RIPA细胞裂解液,用移液枪吹打均匀后置于冰上裂解30 min ,然后于4 ℃高速离心机,12 000 r/min离心15 min(离心半径为12 cm),取上清液,此为细胞总蛋白,用BCA 法检测蛋白浓度。按5∶1比例将细胞总蛋白与6×蛋白电泳上样缓冲液混合,95 ℃水浴变性5 min,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后,电转移法将蛋白转移至PVDF滤膜上。转膜后用5%的脱脂牛奶封闭1 h后去封闭液,加入按1∶1 000稀释后的一抗,于4 ℃孵育过夜,再予1∶2 000的HRP标记的辣根过氧化物酶标记IgG 室温孵育1 h,ECL显色,Quantity One 软件测定分析结果。采用GAPDH作为内参照,分别以相应蛋白与GAPDH光密度比值表示该蛋白相对表达水平。
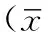
2 结果
2.1RNA纯度及PCR扩增曲线 提取总RNA用超微量分光光度计测定OD260/OD280为1.8~2.0,RNA纯度符合扩增要求;产物熔解曲线呈锐利的单一峰,熔解温度(Tm)均一,说明PCR产物特异性高,无杂带。GAPDH、GRP78qRT-PCR扩增曲线呈S型,基线平滑,将检测临界点定在Ct值,即PCR产物进入指数增长期的起始点(见图1)。
2.2 肝细胞ERS相关分子GRP78mRNA表达水平 3组GRP78mRNA表达水平比较,差异有统计学意义(P<0.01)。ERS模型组肝细胞GRP78mRNA表达水平高于正常对照组,差异有统计学意义(P<0.05);肝宁方治疗组肝细胞GRP78mRNA表达水平低于ERS模型组,差异有统计学意义(P<0.05,见表1)。
2.3 肝细胞ERS相关分子GRP78蛋白表达水平 各组肝细胞GRP78与内参GAPDH平均灰度值比值分别为:正常对照组为(17.93±3.40)%,ERS模型组为(80.21±14.43)%,肝宁方治疗组为(51.05±6.94)%。3组GRP78蛋白表达水平比较,差异有统计学意义(F=34.43,P<0.05)。ERS模型组与肝宁方治疗组在GRP78蛋白表达水平高于正常对照组,差异有统计学意义(P<0.05);肝宁方治疗组GRP78蛋白表达水平低于ERS模型组,差异有统计学意义(P<0.05,见图2)。
Table1ExpressionlevelsofGRP78mRNAassociatedwithERPinhepatocytesinthethreegroups

组别GRP78mRNA正常对照组1.00±0.10ERS模型组1.84±0.19a肝宁方治疗组1.34±0.43bF值64.79P值<0.01
注:GRP78=葡萄糖调节蛋白78,ERS=内质网应激;与正常对照组比较,aP<0.05;与ERS模型组比较,bP<0.05
图2 各组肝细胞GRP78、GAPDH蛋白表达水平
Figure 2 GRP78 and GAPDH protein expression levels in hepatocytes in the three groups
3 讨论
肝脏是人体最大且功能复杂的代谢器官,是外源性产物及代谢产物攻击的主要靶器官[6]。目前许多研究证明肝脏疾病的发病机制与ERS相关[7-8]。ER是真核细胞重要的细胞器,细胞内最大的网络结构,其具有蛋白质合成、修饰与加工,脂类和糖类的合成,水和电解质代谢,Ca2+储存及调节功能,还参与物质运输、物质交换、解毒作用以及对细胞的机械支持,保持ER稳态是维持细胞正常生理状态的重要因素。ERS是在缺氧、药物、病毒感染、氧化应激、代谢障碍等刺激下,细胞ER钙稳态失衡,蛋白质错误折叠,未折叠的蛋白堆积使细胞处于应激状态,由此导致的一系列反应[9-10]。近年来研究显示,ERS可能是肝损伤发生过程中的重要环节[11-12]。ERS发生后主要是通过活化转录因子6(ATF6)、肌醇依赖酶1(IRE1)和PERK 3种跨膜蛋白传递信号,调节ER功能,其能够引起细胞凋亡又能最大限度清除过度损伤的细胞[13]。GRP78是ERS的标志性蛋白,主要分布于细胞ER中,参与ERS相关的多种生物学过程。GRP78作为ER中的分子伴侣,在维持细胞内环境稳态方面发挥着重要作用,被认为是ER稳态的中心调节剂,且当ER功能异常情况时,GRP78大量表达以维持ER稳定,具有保护细胞的作用,被认为是发生ERS的标志[14]。本实验通过用衣霉素诱导HL-7702肝细胞建立ERS模型,经肝宁方干预后与ERS模型组相比,各种细胞内GRP78的表达水平均较模型组降低,由此可见肝宁方能够有效抑制ERS的强度,对缓解肝细胞受损具有一定的疗效。
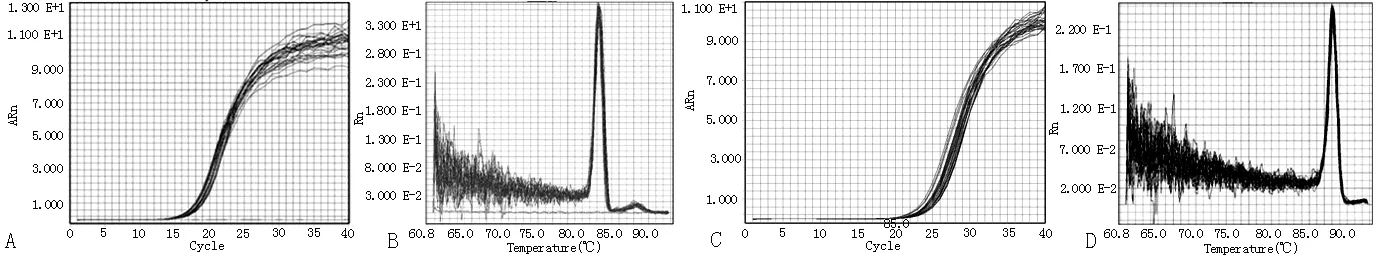
注:A表示GAPDH扩增曲线,B表示GAPDH溶解曲线,C表示葡萄糖调节蛋白78(GRP78)扩增曲线,D表示GRP78溶解曲线
图1 GAPDH、GRP78扩增和溶解曲线图
Figure 1 Amplification and dissolution curves of GAPDH and GRP78
我国是乙型肝炎病毒(HBV)感染的高发地区,HBV感染患者大部分转化为慢性感染,从而导致肝细胞免疫系统损害以致发展成肝硬化甚至肝癌[15]。中药在治疗肝脏疾病上具有较好的前景,肝宁方是结合中医、瑶医、壮医药理理论优势整合的方剂,由泽兰、鳖甲、猛老虎、葫芦茶、黄芪、白芍、白术、当归组成。方中黄芪、白芍、白术、当归健脾益气,兼以养血;泽兰、鳖甲、猛老虎、葫芦茶活血化瘀通络,兼以利水。方中猛老虎为广西瑶药,具有散瘀消肿作用;葫芦茶为广西壮药,具有消滞利水的作用;以上两药是广西民间医师治疗急慢性肝炎、肝硬化的常用药。综合全方具有攻补兼施,扶正祛邪,以健脾益气、祛瘀通络为主,兼以清热解毒。结合前期研究表明,肝宁方可以降低肝纤维化透明质酸(HA)、Ⅳ型胶原(Ⅳ-C)水平,增强机体抗氧化损伤能力,减轻肝硬化患者症状,降低门脉压力及HBV-DNA病毒载量,抑制HBV病毒复制,且对中医临床症状具有明显的改善作用等[16-17]。
本实验qRT-PCR和Western blotting显示,以浓度为0.30 μg/ml的衣霉素诱导ERS模型,ERS模型组GRP78 mRNA及其蛋白表达水平显著高于正常对照组,肝宁方治疗组在降低GRP78 mRNA及其蛋白表达水平方面优于模型组,说明正常状态下,ER分子伴侣GRP78处于无活性状态,ERS模型组在经过衣霉素诱导后在肝细胞内形成ERS效应,显著提高GRP78表达水平,经肝宁方药物干预后,GRP78表达水平较ERS模型组有所降低,可见当ERS发生时,ER腔内未折叠或错误折叠的蛋白增多,GRP78则从跨膜蛋白上解离,促进蛋白折叠。同时也证明了ER功能正常的情况下,GRP78的表达水平较低,而发生ERS时,其表达水平显著升高。此外,当GRP78表达上调时,提示发生ERS,当肝宁方干预后GRP78表达下调,提示ERS得到了一定程度的缓解。中药肝宁方可抑制肝细胞内GRP78的过度表达,减少ERS激造成的肝脏损伤,进而起到保护肝细胞的作用。
综上所述,肝宁方能够改善肝功能损伤情况,有效降低肝细胞的凋亡,其机制可能与抑制肝细胞内GRP78的表达有关,但肝宁方在对肝细胞ERS相关分子GRP78的作用及机制有待医学工作者更深一步的探讨研究,本研究通过下调GRP78的表达水平降低对肝细胞的损害,减少肝细胞的凋亡作用,这也为中医药研究防治肝脏疾病提供了新的思路和方向。
作者贡献:李椿莹进行研究设计与实施、资料收集整理、撰写论文并对文章负责;文彬、李福英进行研究实施、评估、资料收集;邓鑫进行质量控制及审校。
本文无利益冲突。
[1]MALHI H,KAUFMAN R J.Endoplasmic reticulum stress in liver disease[J].J Hepatol,2011,54(4):795-809.DOI:10.1016/j.jhep.2010.11.005.
[2]HAMMADI M,OULIDI A,GACKIRE F,et al.Modulation of ER stress and apoptosis by endoplasmic reticulum calcium leak via translocon during unfolded protein response:involvement of GRP78[J].FASEB J,2013,27(4):1600-1609.DOI:10.1096/fj.12-218875.
[3]MATSUO K,GRAY M J,YANG D Y,et al.The endoplasmic reticulum stress marker,glucose-regulated protein-78(GRP78) in visceral adipocytes predicts endometrial cancer progression and patient survival[J].Gynecol Oncol,2013,128(3):552-559.DOI:10.1016/j.ygyno.2012.11.024.
[4] 邓鑫,梁建,李益忠,等.肝宁方对肝硬化大鼠氧化损伤的保护作用[J].中国中西医结合消化杂志,2007,15(2):102-104.DOI:10.3969/j.issn.1671-038X.2007.02.010. DENG X,LIANG J,LI Y Z,et al.The protective effect of Ganning Fang on oxidative injury in cirrhosis rats[J].Chinese Journal of Integrated Traditional and Western Medicine in Digestion,2007,15(2):102-104.DOI:10.3969/j.issn.1671-038X.2007.02.010.
[5] 邓鑫,梁建,周薇,等.肝宁方对肝硬化大鼠细胞因子调控作用的研究[J].实用中医内科杂志,2007,21(5):26-27.DOI:10.3969/j.issn.1671-7813.2007.05.014. DENG X,LIANG J,ZHOU W,et al.Regulating effect of Ganning Fang on cytokines in cirrhotic rats[J].Journal of Practical Traditional Chinese Nternal Medicine,2007,21(5):26-27.DOI:10.3969/j.issn.1671-7813.2007.05.014.
[6]ZHANG X,OUYANG J,THUNG S N.Histopathologic manifestations of drug-induced hepatotoxicity[J].Clin Liver Dis,2013,17(4):547-564.DOI:10.1016/j.cld.2013.07.004.
[7]钟卫卫,林世德.内质网应激与肝损伤研究进展[J].世界华人消化杂志,2010,18(10):1021-1025.DOI:10.3969/j.issn.1009-3079.2010.10.010. ZHONG W W,LIN S D.Role of endoplasmic reticulum stress in hepatocytes in the pathogenesis of liver injury[J].World Chinese Journal of Digestology,2010,18(10):1021-1025.DOI:10.3969/j.issn.1009-3079.2010.10.010.
[8]杨丙章,任锋,段钟平,等.内质网应激与病毒性肝炎[J].胃肠病学和肝病学杂志,2013,22(2):167-170.DOI:10.3969/j.issn.1006-5709.2013.02.022. YANG B Z,REN F,DUAN Z P,et al.Endoplasmic reticulum stress and viral hepatitis[J].Chinese Journal of Gastroenterology and Hepatology,2013,22(2):167-170.DOI:10.3969/j.issn.1006-5709.2013.02.022.
[9]GROENENDYK J,SREENIVASAIAH K,KIM H D,et al.Biology of endoplasmic reticulum stress in the heart[J].Circ Res,2010,107(10):1185-1197.DOI:10.1161/CIRCRESAHA.110.227033.
[10]GARDNER B M,PINCUS D,GOTTHARDT K,et al.Endoplasmic reticulum stress sensing in the unfolded protein response[J].Cold Spring Harb Perspect Biol,2013,5(3):a013169.DOI:10.1101/cshperspect.a013169.
[11]MALHI H,KAUFMAN R J.Endoplasmic reticulum stress in liver disease[J].J Hepatol,2011,54(4):795-809.DOI:10.1016/j.jhep.2010.11.005.
[12]KOJIMA S,KUO T F,TATSUKAWA H,et al.Induction of cross-linking and silencing of Sp1 by transglutaminase during liver injury in ASH and NASH via different ER stress pathways[J].Dig Dis,2010,28(6):715-721.DOI:10.1159/000324278.
[13]MADHUSUDHAN T,WANG H,DONG W,et al.Defective podocyte insu-lin signaling through p85-XBP1 promotes ATF6-dependent mal-adaptive ER-stress response in diabetic nephropathy[J].Nat Commun,2015,6:6496.DOI:10.1038/ncomms7496.
[14]薛欣,李玉梅,李海玉,等.逍遥散对大鼠肝细胞脂肪变性及内质网/SREBP1/脂代谢通路的影响[J].中国中医基础医学杂志,2012,18(2):154-157. XUE X,LI Y M,LI H Y,et al.Effects of Xiaoyao San on hepatic steatosis and ER Stress/SREBP1/lipid metabolism pathway in rats[J].Chinese Journal of Basic Medicine in Traditional Chinese Med icine,2012,18(2):154-157.
[15]陈然,邓鑫,彭佩纯.内质网应激与乙型肝炎关系的研究进展[J].广西医学,2014,36(10):1432-1436.DOI:10.11675/j.issn.0253-4304.2014.10.23. CHEN R,DENG X,PENG P C.Research progress of relationship between endoplasmic reticulum stress and hepatitis B[J].Guangxi Medical Journal,2014,36(10):1432-1436.DOI:10.11675/j.issn.0253-4304.2014.10.23.
[16]邓鑫,梁建,李益忠,等.肝宁方对肝硬化门脉高压的抑制作用[J].辽宁中医药大学学报,2007,9(4):180-181.DOI:10.3969/j.issn.1673-842X.2007.04.118. DENG X,LIANG J,LI Y Z,et al.Inhibitory effect of Ganning fang on cirrhotic portal hypertension[J].Journal of Liaoning University of Traditional Chinese Medicine,2007,9(4):180-181.DOI:10.3969/j.issn.1673-842X.2007.04.118.
[17]秦祖杰,邓鑫.肝宁方治疗慢性乙型肝炎湿热证的临床观察[J].辽宁中医杂志,2012,39(3):497-499. QIN Z J,DENG X.Clinical observation of Ganning fang treatment of chronic hepatitis B with damp heat syndrome[J].Liaoning Journal of Traditional Chinese Medicine,2012,39(3):497-499.
(本文编辑:崔莎)
Effect of Ganning Decoction on the mRNA and Protein Expression Levels of GRP78 Associated with Hepatic Endoplasmic Reticulum Stress
LIChun-ying1,WENBin2,LIFu-ying1,DENGXin2*
1.GuangxiUniversityofChineseMedicine,Nanning530000,China2.RuikangHospitalAffiliatedtoGuangxiUniversityofChineseMedicine,Nanning530011,China
*Correspondingauthor:DENGXin,Post-doctoral;E-mail:3379806575@qq.com
Objective To investigate the effect and significance of Ganning Decoction on the mRNA and protein expression levels of GRP78 associated with hepatic endoplasmic reticulum stress(ERS).Methods This study was conducted from October 2015 to July 2016.We prepared the serum with Ganning Decoction by using the abdominal aortic blood taken from 20 intervened SPF grade healthy SD rats,and tunicamycin culture medium by adding culture medium containing fetal bovine serum to the DMSO solution with completely dissolved tunicamycin.HL-7702 hepatocytes were divided into normal control group,ERS model group,and Ganning Decoction treatment group,cultured with normal culture medium,tunicamycin culture medium,tunicamycin culture medium containing serum with Ganning Decoction,respectively.The mRNA and protein expression levels of GRP78 associated with hepatic ERS in all the groups were detected by qRT-PCR,and western blotting,respectively.Results The expression level of GRP78 mRNA in hepatocytes of ERS model group was higher than that in the normal control group(P<0.05).The expression level of GRP78 mRNA in hepatocytes of Ganning Decoction treatment group was lower than that in the ERS model group(P<0.05).The normal control group had lower expression level of GRP78 protein than the other two groups(P<0.05).Ganning Decoction treatment group had lower expression level of GRP78 protein than the ERS model group(P<0.05).Conclusion Ganning Decoction can effectively improve the impaired liver function and reduce the apoptosis of hepatocytes.The mechanism may be related to the inhibition of the expressions of GRP78 in hepatocytes.
Hepatocytes;Endoplasmic reticulum stress;Ganning Decoction;Glucose-regulated protein 78
国家自然科学基金资助项目(81360532);广西八桂学者资助,广西特聘专家资助
R 329.24
A
10.3969/j.issn.1007-9572.2017.21.017
2017-01-15;
2017-05-05)
1.530000广西南宁市,广西中医药大学
2.530011广西南宁市,广西中医药大学附属瑞康医院
*通信作者:邓鑫,博士后;E-mail:3379806575@qq.com

