纳米细菌大鼠肾结石模型肾脏结石形成时间的动态研究
褚 浩,王勤章,吴 双,钱 成,王议鹤,钱 彪
·论著·
纳米细菌大鼠肾结石模型肾脏结石形成时间的动态研究
褚 浩,王勤章,吴 双,钱 成,王议鹤,钱 彪*
目的 采用微计算机断层扫描技术(Mirco-CT)和病理组织学检查动态观察纳米细菌诱导的大鼠肾结石模型肾脏结石形成情况。方法 2015年11月—2016年6月,将60只SPF级Wistar大鼠适应性饲养1周后,随机分为对照组和诱石组,各30只。对照组大鼠一次性尾静脉注射0.9%氯化钠溶液1.2 ml,诱石组大鼠一次性尾静脉注射纳米细菌悬液1.2 ml。两组大鼠注射后第1~10周每周处死3只,收集双侧肾脏待测。采用Mirco-CT检查两组大鼠肾脏,统计第1~10周两组大鼠检测到的肾脏高密度影情况。光学显微镜下观察两组大鼠肾脏晶体的形成情况,统计第1~10周两组大鼠肾脏晶体阳性情况。结果 Mirco-CT扫描结果:第1~10周,对照组大鼠肾脏均未见高密度影;第7~10周诱石组大鼠肾脏可见白色颗粒样高密度影。第1~10周,诱石组大鼠肾脏高密度影检出4只(13.3%),对照组未检出;截至第10周末,两组大鼠肾脏高密度影检出率比较,差异无统计学意义(P=0.056)。病理组织学检查结果:第1~10周,对照组大鼠肾脏内无晶体沉积。第4周及第6~10周诱石组大鼠肾脏可见灰白色晶体。第1~10周,诱石组大鼠肾脏晶体阳性11只(36.7%),对照组均为阴性;截至第10周末,诱石组大鼠肾脏晶体阳性率高于对照组(P<0.001)。结论 纳米细菌在第4周开始诱导大鼠肾脏形成结晶,这个病理过程在第6~10周持续存在,Mirco-CT检查可见第7~10周形成高密度结石样物质,纳米细菌可能通过早期损伤肾脏诱导结晶形成并进一步产生结石。
肾结石;纳米细菌;模型,动物;体层摄影术,螺旋计算机
褚浩,王勤章,吴双,等.纳米细菌大鼠肾结石模型肾脏结石形成时间的动态研究[J].中国全科医学,2017,20(21):2613-2618.[www.chinagp.net]
CHU H,WANG Q Z,WU S,et al.Dynamic study on the time of stone formation in rat nephrolithiasis model induced by nanobacteria[J].Chinese General Practice,2017,20(21):2613-2618.
纳米细菌自从被发现以来,其身影出现于生物体内的各种钙化现象,且一直是泌尿系结石病因学的研究热点。纳米细菌在肾结石形成中的作用一直备受关注,国内外相关学者常通过纳米细菌感染动物建立相关肾结石模型,从血尿生化检测、病理切片观察等方面做出针对性的探讨研究[1-4]。本研究在借鉴上述经典方法的同时,参考在骨骼等高密度物质研究方面有较广泛应用的微计算机断层扫描技术(Mirco-CT)这一相对新颖的技术手段,首次采用Mirco-CT动态观察感染纳米细菌的大鼠肾结石形成情况,同时进行病理组织学检查,具体报道如下。
1 材料与方法
1.1 实验材料 SPF级雄性Wistar大鼠60只,6周龄左右,体质量(200±20)g,购自新疆医科大学实验动物中心〔合格证号SCXK(新) 2013- 0001〕。基本饲料由石河子大学实验动物中心提供,多功能光学显微镜及图像采集系统(BX40,日本Olympus公司)、Mirco-CT(Bruker Company)。
1.2 方法
1.2.1 大鼠肾结石模型建立及实验取材 本课题组前期收集上尿路结石患者的尿液,过滤处理后进行细胞培养,得到的纳米细菌悬液经相差显微镜、电镜、钙染色鉴定[5]。2015年11月—2016年6月,60只SPF级Wistar大鼠适应性饲养1周后,随机分为对照组和诱石组,各30只。对照组大鼠一次性尾静脉注射0.9%氯化钠溶液1.2 ml,诱石组大鼠一次性尾静脉注射纳米细菌悬液1.2 ml。两组大鼠注射后第1~10周每周处死3只,收集双侧肾脏,并置于10%甲醛溶液中固定。
1.2.2 Mirco-CT检查 将大鼠肾脏固定在放射源和照相机之间,并保持在可视范围内,沿垂直长轴做0.9°~180.0°旋转,并同时保持在扫描视野范围内。Mirco-CT检查条件:功率8 W、电压30 kV,电流300 μA,空间分辨率35 μm,Filter=0.5 mm AL,观察大鼠肾脏是否存在高密度影,双侧肾脏同时出现高密度影时仅计1次,统计第1~10周两组大鼠检测到的肾脏高密度影情况。
本研究背景:
纳米细菌广泛存在于人体内,是一种具有超微结构的生物,可以在人体钙化组织器官或体液中检测到,并被认为与多种钙化性疾病有关,具体到纳米细菌与泌尿系结石的关联,从纳米细菌对肾小管上皮细胞水平的影响到纳米细菌感染大鼠动物模型的构建,国内外学者均做出一定的探索,观察到纳米细菌与结石的形成具有一定的相关性,这种改变可能与纳米细菌的细胞毒性作用或矿化能力有关,具体机制有待进一步研究。
1.2.3 病理组织学检查 于10%甲醛溶液中取出肾脏常规脱水,石蜡包埋制片后固定于载玻片上,HE染色,光学显微镜下观察晶体的形成情况,参考文献[6]提供的肾脏判定标准进行统计,0级为阴性结果,Ⅰ~Ⅳ级为阳性结果,双侧肾脏同时出现阳性结果时,仅计1次,统计第1~10周两组大鼠肾脏晶体阳性情况。
1.3 统计学方法 采用SPSS 17.0统计学软件进行数据分析。计数资料比较采用Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 Mirco-CT检查结果 第1~10周,对照组大鼠肾脏大体轮廓清晰可见,边缘无毛糙;三视图图像中肾皮质、肾髓质及肾盂均未见高密度影,见图1。诱石组大鼠第7周起肾脏可见白色颗粒样高密度影分布于肾实质中,三视图图像可见高亮点状影随机分布于肾实质的各截面中,见图2。第1~10周,诱石组大鼠肾脏高密度影检出4只(13.3%),对照组未检出(见表1);截至第10周末,两组大鼠肾脏高密度影检出率比较,差异无统计学意义(P=0.056)。
2.2 病理组织学检查结果 第1~10周,对照组大鼠肾脏内无晶体沉积,未见明显病理学改变。诱石组大鼠第4周起肾脏石蜡切片可见灰白色晶体,主要分布于远曲小管、近曲小管及部分肾小球,周围形态不规则,晶体多呈零星散在分布,少量晶体呈互相连接成片或成堆分布,见图3。第1~10周,诱石组大鼠肾脏晶体阳性11只(36.7%),对照组均为阳性(见表2);截至第10周末,诱石组大鼠肾脏晶体阳性率高于对照组,差异有统计学意义(P<0.001)。
3 讨论
纳米细菌是由Kajander发现能形成磷灰石碳酸盐晶体的特殊生物,在人体许多器官组织及体液中广泛存在[7-8],参与体内诸多病理性钙化过程[1]。GARCA CUERPO等[2]应用培养的纳米细菌经皮肾脏穿刺注射,初步建立了纳米细菌致大鼠肾结石动物模型,解剖大鼠后发现其肾小管可见广泛钙化,因此提出纳米细菌作为结石核心的设想。胡卫国等[3]、粟宏伟等[4]参照SHIEKH等[9]实验大鼠尾静脉注射纳米细菌,8周后发现实验组大鼠肾小管管腔内不规则片状高亮晶体,主要分布于远曲小管和近曲小管,进一步进行结晶分级计数,发现与经典的乙二醇氯化铵诱导肾结石模型相比,纳米细菌诱导的大鼠肾结石模型晶体数量少,肾盂等集合系统内晶体或结石形成极少,肾小管内的晶体少有连接成片或成堆。但上述研究对于纳米细菌的结石形成过程仅进行了总结性的报道,缺乏动态的观察描述,因此,本研究建立纳米细菌大鼠肾结石模型,以造模后10周为时间截点,观察大鼠各周肾脏结石形成情况,并引入近年来发展较快的Mirco-CT,实现了对样本的空间结构、微观结构和重塑性的三维可视化同步呈现,同时兼有快捷方便、无创性等特点,其在观察和测量高密度物质方面相对于传统的组织切片技术具有明显优势[10-11],因此在分析研究骨骼等高密度物质的实验研究领域得到一定应用[12-13]。鉴于结石是高密度物质的物理特性,本实验首次尝试利用Mirco-CT,定性分析大鼠肾脏结石形成情况,同时分析肾脏HE染色结果,共同探讨纳米细菌大鼠肾结石模型结石形成的时间规律特点。
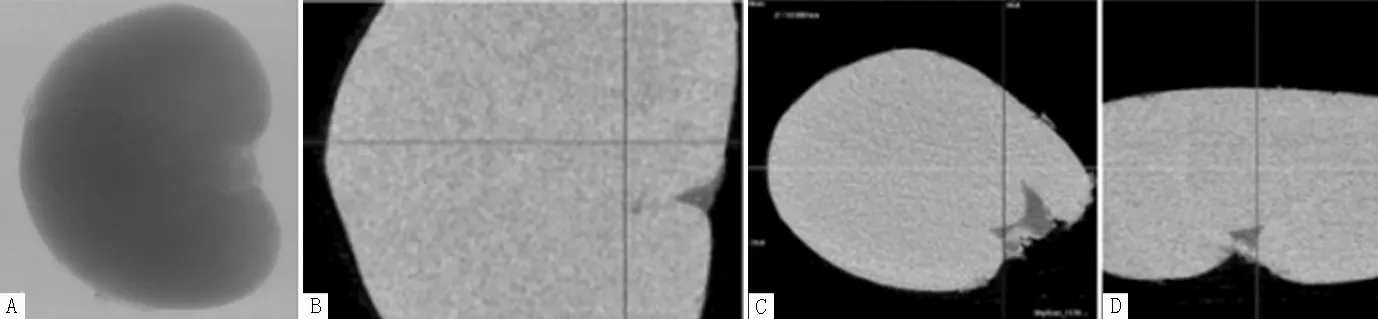
注:A为肾脏CT图,肾盂向前:B、C、D依次为矢状面、横截面、冠状面
图1 对照组大鼠第7周肾脏Mirco-CT检查结果
Figure 1 Results of kidney Mirco-CT examination in control group of rats for the seventh week
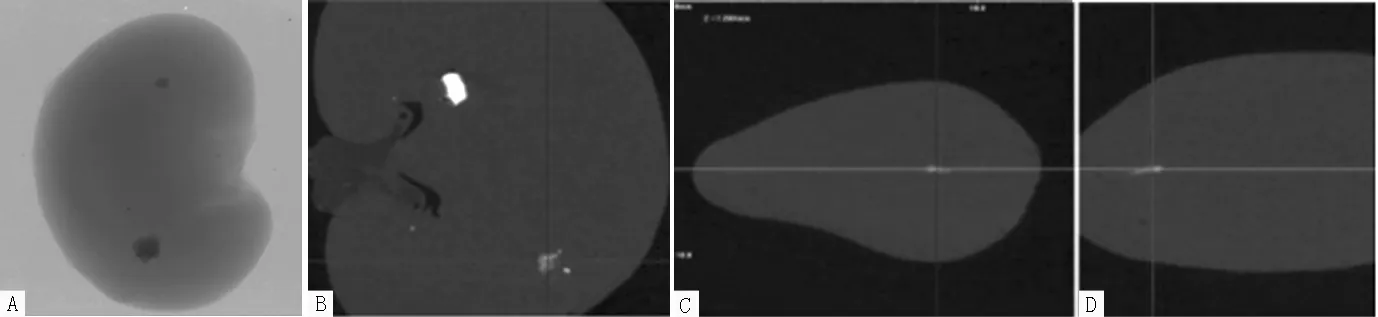
注:A为肾脏CT图,肾盂向前:B、C、D依次为矢状面、横截面、冠状面

图2 诱石组组大鼠第7周肾脏Mirco-CT检查结果

表2 两组大鼠各周肾脏晶体阳性情况(只)

注:A为对照组大鼠肾脏,B为诱石组大鼠肾脏
图3 两组大鼠第6周肾脏病理组织图(HE染色,×200)
Figure 3 Pathological structure of kidney in two groups of rats for the sixth week
本实验发现Mirco-CT检查和病理组织学检查结果提示诱石组的结石检出率较对照组高,但是Mirco-CT检查结果无统计学差异,可能与肾结石程度较轻、个别标本未被Mirco-CT检查检出而呈假阴性有关。Mirco-CT检查示,第7~10周诱石组大鼠均有肾脏高密度影检出,对照组大鼠未检出。病理组织学检查结果显示,第4周及第6~10周诱石组大鼠肾小管内发现晶体,且主要分布于远曲小管和近曲小管,对照组大鼠未见晶体。相关研究显示,乙二醇诱导肾结石周期普遍为4周左右[14-15],而纳米细菌诱导大鼠结石造模周期较长,这可能与纳米细菌的生物学代谢特点有关。纳米细菌只能在细胞培养基上生长,且生长缓慢,倍增时间平均为3~5 d,细胞培养常需要4~6周以上才能出现肉眼可见白色沉淀[7,16]。ZHOU等[17]经大鼠尿道将纳米细菌逆行感染前列腺,然后分别在不同时间点处死大鼠,收集标本检测感染率达95%,对照组无感染大鼠,组间差异明显;光镜下大鼠感染4周后前列腺均表现为慢性炎症;透射电子显微镜下胞质内可见聚集的球状或杆状纳米细菌存在,周围出现空泡状、透明样结构,本研究观察到的肾脏病理损害与之相印证,同时体外细胞实验[18-19]发现纳米细菌不仅通过损伤肾小管上皮细胞诱导大鼠肾小管内产生含钙结晶,而且损伤细胞后,细胞的晶体黏附性明显增强,随损伤作用时间的延长,细胞与晶体的黏附量也会相应增加[20],上述过程相互协同、共同促进肾结石的形成。钙化和结石形成均离不开纳米细菌独特的生物矿化作用,并且均是以纳米细菌为核心,通过不断结合钙离子,逐渐在其周围聚集,形成沉淀并发展为钙化、结石等[21]。
与纳米细菌肾结石模型相比,传统的乙二醇诱导草酸钙大鼠结石模型建立后,能较快的观察到结石出现,虽然二者的原发机制可能不尽相同,但是均出现肾脏损害及结晶形成的现象,这就有利的佐证了纳米细菌对肾结石形成的促进作用,同时,纳米细菌的钙化作用受自身生理条件的影响较大,正因为如此,纳米细菌诱导的成石模型在某方面可能更接近人类肾结石疾病的代谢过程,对相关研究也是一个有益的探索及尝试。
综上所述,纳米细菌在第4周开始诱导大鼠肾脏形成结晶,这个病理过程在第6~10周持续存在,Mirco-CT检查可见第7~10周形成高密度结石样物质。纳米细菌在利用自身矿化特性诱导结晶形成的同时损伤肾小管等肾脏结构,上述病理过程相互作用,互相协同,进一步导致肾脏结构的变化,最终导致结石的形成。作为肾结石病因学的一个研究方向,全面阐明纳米细菌在整个疾病变化中的机制还需要更广泛、更深入的研究,例如在细胞学水平上进行更多的时间点观察并检测更多相关蛋白及其他指标的表达,了解纳米细菌对相关指标的影响情况,为肾结石的病因研究及诊治预防做进一步探索。
作者贡献:褚浩、王勤章、钱彪进行文章的构思与设计,研究的实施与可行性分析,撰写论文,论文修订;褚浩、吴双、钱成、王议鹤进行数据收集与整理;褚浩进行统计学处理,结果分析与解释,负责文章的质量控制及审校;褚浩、王勤章、钱彪对文章整体负责,监督管理。
本文无利益冲突。
本研究不足之处:
目前国内纳米细菌均是通过收集人体标本进行细胞培养获得,培养周期至少6~8周,并且每个培养瓶获得纳米细菌的数量有限,而实验造模要求纳米细菌提取后要达到一定浓度,这就使最终纳米细菌的数量受到限制,能被其感染的大鼠数量相应受到限制,样本量较小,整体阳性率不高,同时微计算机断层扫描技术(Mirco-CT)的应用尚显粗糙,有待进一步改善和研究。
[1]KAJANDER E O,CIFTCIOGLU N.Nanobacteria:an alternative mechanism for pathogenic intra- and extracellular calcification and stone formation[J].Proc Natl Acad Sci U S A,1998,95(14):8274-8279.
[3]胡卫国,王晓峰,徐涛,等.纳米细菌大鼠肾结石模型初步建立及成石因素分析[J].北京大学学报(医学版),2010,42(4):433-435.DOI:10.3969/j.issn.1671-167X.2010.04.016. HU W G,WANG X F,XU T,et al.Establishment nephrolithiasis rat model induced by nanobacteria and analysis of stone formation[J].Journal of Peking University(Health Sciences),2010,42(4):433-435.DOI:10.3969/j.issn.1671-167X.2010.04.016.
[4]粟宏伟,王杰,朱永生,等.钙化性纳米微粒致大鼠肾结石模型的构建[J].重庆医学,2016,45(3):310-312,316.DOI:10.3969/j.issn.1671-8348.2016.03.007. SU H W,WANG J,ZHU Y S,et al.Establishment renal calculus rat model induced by calcifying nanoparticles[J].Chongqing Medicine,2016,45(3):310-312.DOI:10.3969/j.issn.1671-8348.2016.03.007.
[5]刘志立,王勤章,钱彪,等.上尿路结石患者原尿纳米细菌的培养及鉴定[J].医学信息,2015,28(42):70-71.DOI:10.3969/j.issn.1006-1959.2015.42.097. LIU Z L,WANG Q Z,QIAN B,et al.Culture and identification of primary urinary nanometer bacteria in patients with upper urinary calculi[J].Medical Information,2015,28(42):70-71.DOI:10.3969/j.issn.1006-1959.2015.42.097.
[6]安瑞华,冯陶,郭应禄,等.香豆素对实验性大鼠草酸钙结石形成的影响[J].中华泌尿外科杂志,1994,15(3):209-212. AN R H,FENG T,GUO Y L,et al.Effect of coumarin on the formation of calcium oxalate calculus in rats[J].Chinese Journal Urology,1994,15(3):209-212.
[7]任海林,颜东文,史葆光,等.上尿路结石中纳米细菌的检测[J].中华泌尿外科杂志,2006,27(9):620.DOI:10.3760/j:issn:1000-6702.2006.09.022. REN H L,YAN D W,SHI B G,et al.Detection of nanobacteria in upper urinary tract stones[J].Chinese Journal Urology,2006,27(9):620.DOI:10.3760/j:issn:1000-6702.2006.09.022.
[8]WOOD H M,SHOSKES D A.The role of nanobacteria in urologic disease[J].World Journal of Urology,2006,24(1):51-54.DOI:10.1007/s00345-005-0041-3.
[9]SHIEKH F A,KHULLAR M,SINGH S K.Lithogenesis:induction of renal calcifications by nanobacteria[J].Urolithiasis,2006,34(1):53-57.
[10]姜玲,金东春,黎卫星,等.显微CT在口腔种植研究领域中的应用[J].中华临床医师杂志(电子版),2009,3(11):1888-1895.DOI:10.3969/j.issn.1674-0785.2009.11.019. JIANG L,JIN D C,LI W X,et al.Application of micro CT in dental implant research[J].Chinese Journal of Clinicians (Electronic Version),2009,3(11):1888-1895.DOI:10.3969/j.issn.1674-0785.2009.11.019.
[11]吴兴,汤光宇.骨质疏松骨髓微环境的影像研究进展[J].国际医学放射学杂志,2016,39(4):390-394.DOI:10.19300/j.2016.Z3898. WU X,TANG G Y.Advances in imaging research of bone marrow microenvironment in osteoporosis[J].Int J Med Radiol,2016,39(4):390-394.DOI:10.19300/j.2016.Z3898.
[12]RITMAN E L.Micro-computed tomography-current status and developments[J].Annu Rev Biomedl Eng,2004,6(1):185-208.
[13]SNOEKS T J,KAIJZEL E L,QUE I,et al.Normalized volume of interest selection and measurement of bone volume in micro CT scans[J].Bone,2011,49(6):1264-1269.DOI:10.1016/j.bone.2011.09.037.
[14]李笑然,岳中瑾,裴薇,等.4种大鼠肾草酸钙结石模型的比较[J].现代泌尿外科杂志,2013,18(4):329-331,338.DOI:10.3969/j.issn.1009-8291.2013.04.006. LI X R,YUE Z J,PEI W,et al.Comparison of four renal calcium oxalate calculus rat models[J].Journal of Modern Urology,2013,18(4):329-331,338.DOI:10.3969/j.issn.1009-8291.2013.04.006.
[15]向松涛,甘澍,周建甫,等.广金钱草水提取液对肾草酸钙结石模型大鼠氧化应激的影响研究[J].中华泌尿外科杂志,2014,35(6):465-468.DOI:10.3760/cma.j.issn.1000-6702.2014.06.018. XIANG S T,GAN S,ZHOU J F,et al.Effects of aqueous extract from Desmodium styracifolium(Osb.)Merr.on oxidative stress of renal calcium oxalate rat modles[J].Chinese Journal Urology,2014,35(6):465-468.DOI:10.3760/cma.j.issn.1000-6702.2014.06.018.
[16]KHULLAR M,SHARMA S K,SINGH S K,et al.Morphological and immunological characteristics of nanobacteria from human renal stones of a north Indian population[J].Urol Res,2004,32(3):190-195.
[17]ZHOU Z,HONG L,SHEN X,et al.Detection of nanobacteria infectionin type Ⅲ prostat it is[J].Urology,2008,71(6):1091-1095.DOI:10.1016/j.urology.2008.02.041.
[18]陶芝伟,黎承杨,邓耀良,等.尿液钙化性纳米微粒与肾结石形成的关系[J].现代泌尿外科杂志,2009,14(3):235-237.DOI:10.3969/j.issn.1009-8291.2009.03.030. TAO Z W,LI C Y,DENG Y L,et al.Effect of nanobacteria on cell damage and crystal retention in renal tubular epithelial cells[J].Journal of Modern Urology,2009,14(3):235-237.DOI:10.3969/j.issn.1009-8291.2009.03.030.
[19]汪越,张力,郝宗耀,等.纳米细菌及其诱发泌尿系结石形成的研究进展[J].临床泌尿外科杂志,2015,30(7):665-668.DOI:10.13201/j.issn.1001-1420.2015.07.026. WANG Y,ZHANG L,HAO Z Y,et al.Nanobacteria and the research progress of its effect on urinary stone formation[J].Journal of Clinical Urology,2015,30(7):665-668.DOI:10.13201/j.issn.1001-1420.2015.07.026.
[20]于澄钒,黄晓波,陈亮,等.纳米细菌对肾小管上皮细胞的损伤及晶体滞留的影响[J].北京大学学报(医学版),2010,42(4):436-442.DOI:10.3969/j.issn.1671-167X.2010.04.017. YU C F,HUANG X B,CHEN L,et al.Effect of nanobacteria on cell damage and crystal retention in renal tubular epithelial cells[J].Journal of Peking University(Health Sciences),2010,42(4):436-442.DOI:10.3969/j.issn.1671-167X.2010.04.017.
[21]ZENG J,YANG F,ZHANG W,et al.Association between dental pulp stones and calcifying nanoparticles[J].Int J Nanomedicine,2011,25(12):2633-2638.DOI:10.2147/IJN.S13267.
(本文编辑:毛亚敏)
Dynamic Study on the Time of Stone Formation in Rat Nephrolithiasis Model Induced by Nanobacteria
CHUHao,WANGQin-zhang,WUShuang,QIANCheng,WANGYi-he,QIANBiao*
DepartmentofUrologySurgery,theFirstAffiliatedHospitalofMedicalSchoolofShiheziUniversity,Shihezi832000,China
Objective To dynamically observe the stone formation in rat nephrolithiasis model induced by nanobacteria by using micro computed tomography(Mirco-CT) examination and histopathological examination.Methods From November 2015 to June 2016,60 SPF class Wistar rats were adaptively fed for one week.Then the rats were randomly divided into two groups:control group and induced stone group,30 rats in each group.The rats in the control group were injected with 1.2 ml of 0.9% sodium chloride solution via the tail vein at one time,the rats in the induced stone group were injected with 1.2 ml of nanobacterial suspension at one time.Three rats in each group were sacrificed every week from the 1st to 10th week after injection,bilateral renal tissues were collected to be tested.The kidneys of the two groups of rats were examined by Mirco-CT,the detected high density shadow in the kidneys of the two groups of rats at the 1st to 10th week was statistically analyzed.The crystal formation in the renal tissues of the two groups of rats was observed under light microscope,and the positive condition in the renal of the two groups of rats at the 1st to 10th week was statistically analyzed.Results Mirco-CT scan results showed that there was no high density shadow in the kidneys of rats in the control group from the 1st to 10th week,while there were white high density granules in the kidneys of the rats in induced stone group from the 7th to 10th week.From the 1st to 10th week,high density shadow was detected in the renal tissues of 4 rats(13.3%) in induced stone group,while not in the control group.At the end of the 10th week,there was no significant difference in the detection rate of high density shadow in renal tissues between the two groups(P=0.056).Histopathological findings showed that there were no crystal deposits in the kidneys of the rats in the control group from the 1st to 10th week.At the 4th week and the 6th to 10th week,greyish white crystals were detected in the renal tissues of the rats in the induced stone group.From the 1st to 10th week,crystals were detected in the renal tissues of 11 rats(36.7%) in induced group,but not in the control group.At the end of the 10th week,the crystal detection rate by paraffin section in the renal tissues of rats in induced stone group was higher than that in the control group,the difference was statistically significant(P<0.001).Conclusion Nanobacteria begin to induce the formation of crystals in the kidneys of the rats at the 4th week.The pathological process persists at the 6th to 10th week.Finally,the Mirco-CT examination shows the formation of high density stone like substance at the 7th to 10th week.Nanobacteria may induce the formation of crystals by early renal injury and further produce stones.
Kidney calculi;Nanobacteria;Models,animal;Tomography,spiral computed
国家自然科学基金资助项目(81460140)
R 692.4
A
10.3969/j.issn.1007-9572.2017.21.011
2017-02-23;
2017-06-06)
832000新疆石河子市,石河子大学医学院第一附属医院泌尿外科
*通信作者:钱彪,副教授,副主任医师;E-mail:qb2003_2000@163.com
*Correspondingauthor:QIANBiao,Associateprofessor,Associatechiefphysician;E-mail:qb2003_2000@163.com

