黄芪甲苷诱导大鼠骨髓间充质干细胞向心肌样细胞分化的研究
赵静苗,胡继宏,王秋萍
·论著·
·中医·中西医结合研究·
黄芪甲苷诱导大鼠骨髓间充质干细胞向心肌样细胞分化的研究
赵静苗,胡继宏*,王秋萍
目的 探讨黄芪甲苷(AST)诱导SD大鼠骨髓间充质干细胞(BMSCs)向心肌样细胞分化的作用。方法 对第2代BMSCs进行传代培养,采用四甲基偶氮唑蓝(MTT)法检测不同浓度AST在24、48、72 h时对BMSCs的增殖作用。取第4代BMSCs分为BMSCs组、5-氮杂胞苷组(5-AZA组)和AST组,5-AZA组和AST组分别加入浓度为10 μmol/L的5-AZA和浓度为100 μmol/L的AST诱导液进行诱导,采用荧光倒置相差显微镜观察诱导后各组细胞的形态变化。通过Real-time qPCR法检测诱导后各组结蛋白(Desmin)、α横纹肌肌动蛋白(α-SCA)、肌钙蛋白I(cTnI)mRNA表达水平;采用Western blotting法检测各组肌钙蛋白T(cTnT)表达水平。结果 100 μmol/L AST亚组孔72 h时BMSCs增殖情况好于24、48 h时及其他浓度AST亚组孔各时间点(P<0.05)。荧光倒置相差显微镜观察显示AST体外诱导SD大鼠BMSCs形态分化类似心肌样细胞。5-AZA组、AST组Desmin、α-SCA、cTnI mRNA表达水平表达高于BMSCs组(P<0.05),且AST组以上蛋白mRNA表达水平高于5-AZA组(P<0.05)。与BMSCs组组比较,5-AZA组和AST组cTnT表达水平升高(P<0.05);与5-AZA组比较,AST组cTnT表达水平下降(P<0.05)。结论 浓度为100 μmol/L的AST作用72 h时能够在体外诱导BMSCs向心肌样细胞分化,但分化效果弱于5-AZA。
肌细胞,心脏;细胞分化;骨髓间充质干细胞;黄芪甲苷
赵静苗,胡继宏,王秋萍.黄芪甲苷诱导大鼠骨髓间充质干细胞向心肌样细胞分化的研究[J].中国全科医学,2017,20(21):2635-2639.[www.chinagp.net]
ZHAO J M,HU J H,WANG Q P.Astragaloside effect on the differentiation of rat bone marrow mesenchymal stem cells into cardiomyogenic cells in vitro[J].Chinese General Practice,2017,20(21):2635-2639.
急性心肌梗死(AMI)是目前全球范围内严重威胁人类健康和生命的重大疾病之一,我国AMI发病率呈明显上升趋势[1]。心肌梗死后心肌细胞缺血坏死导致细胞数量减少、心肌纤维化,进而导致心室重构,使得心力衰竭的发生率和病死率增高[2]。近年来许多研究者将骨髓间充质干细胞(BMSCs)诱导分化为心肌样细胞以修复梗死区的心肌细胞从而改善心脏功能,重建心肌结构[3-6]。5-氮杂胞苷(5-AZA)为诱导BMSCs分化为心肌样细胞的有效化学制剂,但其具有细胞毒性,所以寻找更加有效、安全的诱导剂成为重要问题[7]。黄芪是传统的益气类中药,具有补气固表、利尿托毒、敛疮生肌、补中益气等功效;现代药理学研究证实,黄芪甲苷(AST)具有强心、调节机体免疫力、保护组织器官、抗细胞凋亡和抗感染等药理作用[8-9]。本研究探讨了AST诱导BMSCs向心肌细胞分化的可能性。
1 材料与方法
1.1 实验材料 第2代SD大鼠BMSCs(购自北京医科利昊生物科技有限公司),DMEM培养基(500 ml,购自HyClone公司),胎牛血清(500 ml,购自HyClone公司),AST(购自南京森贝伽生物科技有限公司,中国食品药品检定研究院批号:110781-200613),5-AZA、M-MLV(购自Promega公司),Oligo(dT)纤维素〔购自生工生物工程(上海)股份有限公司〕,Bulge-LoopTMmiRNA qPCR Primer set(购自广州锐博生物科技有限公司),Rnase Inhibitor(购自Promega公司),SYBR Master Mixture(购自TAKARA公司)、Primer(购自上海吉凯基因化学技术有限公司)。BCA蛋白浓度测定试剂盒(购自北京索莱宝科技有限公司),RIPA强裂解液(购自上海碧云天生物技术有限公司),二甲基亚砜(DMSO,购自北京索莱宝科技有限公司)Prestained Protein Marker(购自美国Thermo公司),4×蛋白上样缓冲液(购自Solarbio公司),ECL-PLUS/kit(购自美国Thermo公司),兔单克隆抗体Nesprin1、小鼠单克隆抗体肌钙蛋白T(cTnT)及肌钙蛋白I(cTnI)(购自英国Abcam公司)。
1.2 实验仪器 CO2恒温培养箱(SANYO)、荧光倒置相差显微镜(Olympus)、Nanodrop 分光光度计(Thermo 2000/2000c)、稳压电泳仪(上海天能EPS-600)、超细匀浆机(FLUKO公司F6/10)、Real-time PCR仪器(Agilent公司 MX3000p)、酶标分析仪(北京普朗公司DNM-9602A型)、低温高速离心机(德国Kontront-42K)等。
1.3 实验方法
1.3.1 SD大鼠BMSCs的培养与传代 第2代BMSCs培养:常规灭菌,打开培养瓶,放入原代细胞,在培养瓶中加入完全培养基(含20%胎牛血清),置于37 ℃、5% CO2饱和湿度培养箱中培养,次日观察细胞生长状态,48 h后首次换液,以后每隔3 d更换1次培养液,2周后细胞长满80%瓶底可传代。BMSCs的传代培养:将第2代BMSCs瓶内的培养液弃去,加入PBS冲洗2次,以除去培养液中的血清,加入2 ml胰酶蛋白消化细胞,采用荧光倒置相差显微镜进行观察,控制消化时间(2~3 min)。细胞收缩变圆时,立即加入含少量血清的培养液终止消化,用弯头吸管轻轻吹打细胞,收集细胞悬液,800 r/min离心5min(离心半径12.5 cm),弃上清液。加入完全培养液充分吹打成单细胞悬液,按1∶3传代接种于75 cm2培养瓶内,待细胞铺满瓶底后依上法继续传代培养。
1.3.2 筛选AST对BMSCs增殖的最佳作用浓度及时间 采用四甲基偶氮唑蓝(MTT)法检测AST对BMSCs的增殖作用。将AST的浓度设为50、100、200、400 μmol/L及24、48、72 h时间段。取第4代BMSCs,调整浓度为1×106/100 μl,用含10%胎牛血清的培养液吹打混匀成细胞悬液,接种于96孔板中,每孔接种量为100 μl,边缘用无菌PBS填充,设置调零孔(无血清培养基)、对照孔(不加AST的完全培养液培养细胞)及50、100、200、400 μmol/L亚组孔,每孔每板设置5个复孔,分别培养24、48、72 h后,各孔加入无菌MTT溶液20 μl,放入孵箱继续培养4 h,吸去上清液,加入150 μl的DMSO,置摇床低速震荡10 min后,于酶标仪下490 nm处测量各孔的吸光度值(即BMSCs增殖情况)。
1.3.3 BMSCs的诱导分化 取第4代BMSCs进行分组:空白对照组(BMSCs组)、5-AZA组、AST组进行诱导。BMSCs组加入含10%胎牛血清的培养液培养;5-AZA组加入浓度为10 μmol/L的5-AZA,诱导24 h;AST组加入浓度为100 μmol/L的AST诱导液,诱导72 h。每3 d更换1次完全培养液继续培养,4周后对分化的细胞进行细胞形态学观察以及分子生物学检测。
1.3.4 采用Real-time qPCR检测结蛋白(Desmin)、α横纹肌肌动蛋白(α-SCA)、cTnI mRNA表达水平 提取总蛋白,800 r/min离心5 min(离心半径12.5 cm),去上清液,细胞沉淀中加入1 ml Trizol,充分混匀后室温静止5 min,然后转移至新的1.5 ml专用EP管中进行反转录。RNA反转录成cDNA:将2 μl反转录引物(0.5 μg/μl)和2.0 μg 总RNA加入到无酶管中,补充Rnase-free water至10 μl;混匀后800 r/min离心5 min (离心半径12.5 cm),70 ℃温浴10 min;后立即置于冰水混合物中冰浴,使反转录引物和模板退火;在上述混合物中,按以下的比例配制反应体系(冰上进行)混匀,800 r/min离心5 min(离心半径12.5 cm);在42 ℃水浴反应1 h,然后再70 ℃水浴10 min使反转录酶失活;将得到的cDNA置于-80 ℃保存备用。引物设计见表1。
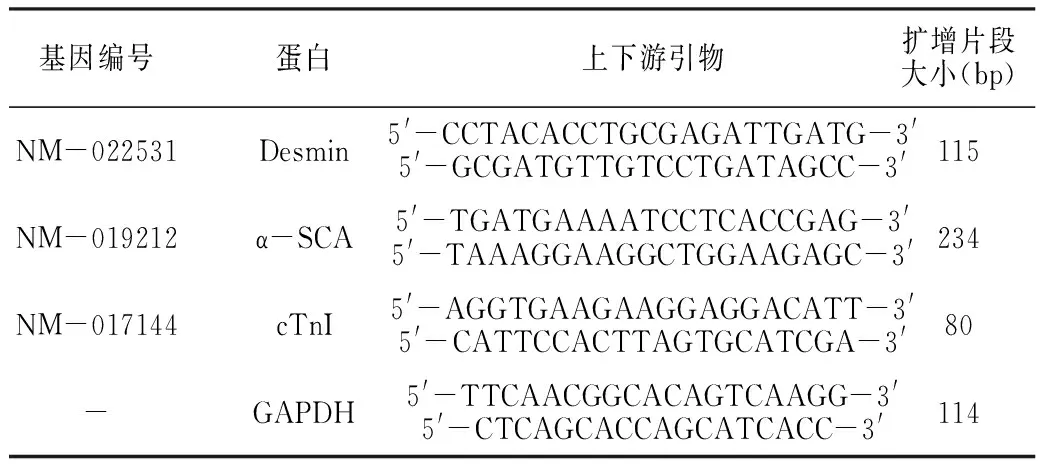
表1 PCR引物序列
注:-表示无此项目;Desmin=结蛋白,α-SCA=α横纹肌肌动蛋白,cTnI=肌钙蛋白I
1.3.5 采用Western blotting法检测各组诱导分化后cTnT的表达 收集各组细胞,用预冷PBS洗涤3次后,将细胞重悬于裂解液中,冰浴30 min,使细胞充分裂解。4 ℃、12 000 r/min离心10 min(离心半径12.5 cm),收集上清液,进行蛋白质定量。各组取等量蛋白质,经5%、12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后转膜至PVDF膜上,封闭后,与一抗结合,4 ℃摇床过夜;TBST洗涤后与二抗结合反应,同上洗涤。用ECL发光显色后,在凝胶成像系统上曝光检测,采用Quantity One 4.6.2软件对图像进行光密度分析,以GAPDH作为内参照。实验重复3次。
2 结果
2.1AST对BMSCs增殖的最佳作用浓度及时间分析 50μmol/LAST亚组孔与在24、48、72h时BMSCs增殖情况比较,差异有统计学意义(P<0.05);100μmol/LAST亚组孔在24、48、72h时BMSCs增殖情况比较,差异有统计学意义(P<0.05);且100μmol/LAST亚组孔72h时BMSCs增殖情况好于24、48h时及其他亚组孔各时间点,差异有统计学意义(P<0.05,见表2)。
2.2 诱导分化后细胞形态学观察 诱导分化4周后,BMSCs组细胞形态多呈长梭形,细胞数量较多、密集分布,培养液中有少量凋亡细胞悬浮(见图1A);5-AZA组细胞体积增大,性状类似“肌岛样”结构,部分细胞出现首尾相接的情况(见图1B);AST组细胞数量较多,呈束状排列,成簇生长(见图1C)。
2.3 诱导后各组Desmin、α-SCA、cTnImRNA表达水平比较 3组Desmin、α-SCA、cTnImRNA表达水平比较,差异有统计学意义(P<0.05);与BMSCs组比较,5-AZA组和AST

表2 对照孔和AST孔不同时间点BMSCs增殖情况比较
注:与50 μmol/L亚组孔比较,aP<0.05;与200 μmol/L亚组孔比较,bP<0.05;与400 μmol/L亚组孔比较,cP<0.05;与100 μmol/L亚组孔24 h比较,dP<0.05;与100 μmol/L亚组孔48 h比较,eP<0.05;AST=黄芪甲苷
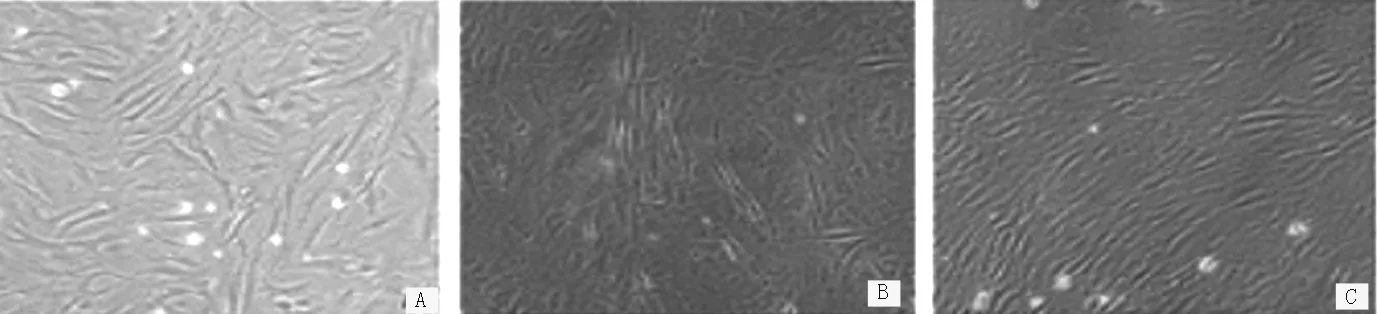
注:A为骨髓间充质干细胞(BMSCs)组,B为5-氮杂胞苷(5-AZA)组,C为黄芪甲苷(AST)组
图1 荧光倒置相差显微镜下观察各组细胞形态变化
Figure 1 Morphological changes in BMSCs in the BMSCs group,5-AZA group and AST group observed by phase contrast fluorescence inverted microscopy
组的Desmin、α-SCA、cTnI mRNA表达水平均升高,差异有统计学意义(P<0.05);与5-AZA组比较,AST组的Desmin、α-SCA、cTnI mRNA表达水平升高,差异有统计学意义(P<0.05,见表3)。
2.4 诱导后各组cTnT表达水平比较 BMSCs组、5-AZA组、AST组cTnT表达水平比较,差异有统计学意义(P<0.05)。与BMSCs组比较,5-AZA组和AST组cTnT表达水平升高,差异有统计学意义(P<0.05);与5-AZA组比较,AST组cTnT表达水平下降,差异有统计学意义(P<0.05,见图2、表4)。

Table 3 Expression levels of Desmin mRNA,α-SCA mRNA and cTnI mRNA in BMSCs group,5-AZA group and AST group measured by Real-time qPCR
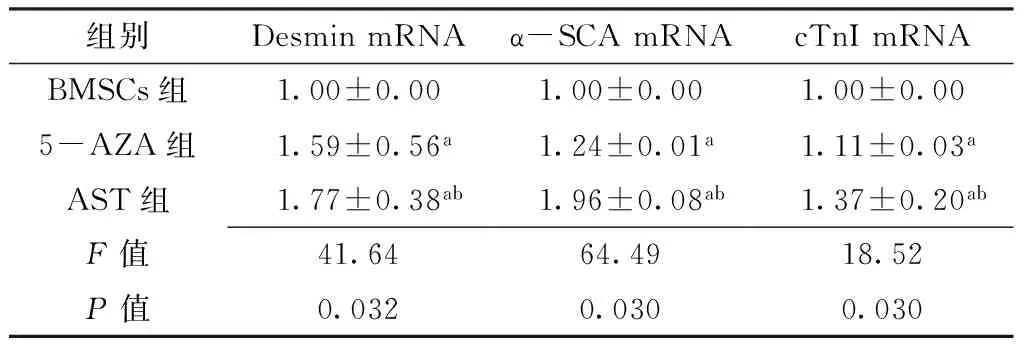
组别DesminmRNAα-SCAmRNAcTnImRNABMSCs组1.00±0.001.00±0.001.00±0.005-AZA组1.59±0.56a1.24±0.01a1.11±0.03aAST组1.77±0.38ab1.96±0.08ab1.37±0.20abF值41.6464.4918.52P值0.0320.0300.030
注:与骨髓间充质干细胞(BMSCs)组比较,aP<0.05;与5-氮杂胞苷(5-AZA)组比较,bP<0.05

注:cTnT=肌钙蛋白T
图2 诱导后各组cTnT蛋白水平表达
Figure 2 Expression levels of cTnI protein in the BMSCs group,5-AZA group and AST group detected by Western blotting

Table4ExpressionlevelsofcTnIintheBMSCsgroup,5-AZAgroupandASTgroupdetectedbyWesternblotting

组别cTnTBMSCs组0.09±0.055-AZA组0.67±0.10aAST组0.21±0.05abF值129.29P值<0.01
注:与BMSCs组比较,aP<0.05;与5-AZA组比较,bP<0.05;cTnT=肌钙蛋白T
3 讨论
心肌梗死之后修复坏死的心肌、改善心肌功能是心肌梗死治疗的关键所在。BMSCs是存在于骨髓基质中的非造血系的成体干细胞,具备向多种细胞分化的能力[10-12]。体外实验研究证实,加入适当的诱导剂,可以使BMSCs定向分化为心肌样细胞[13-14]。5-AZA是目前最常用也是被公认的最有效的诱导剂,但对细胞有一定的毒性作用[15-17]。因此,如何提高诱导分化的效率或寻找新的诱导分化因子,建立更加完善的诱导分化体系是目前医学研究的迫切需要。黄芪是传统的益气类中药,具有补气固表、利尿托毒、敛疮生肌等功效,黄芪主要活性成分AST具有良好的强心作用,对缺血心肌细胞具有保护作用,能有效保护缺氧的心肌细胞,降低损伤程度,且对心肌肥大具有抑制作用[18]。
既往研究表明,Desmin、α-SCA、cTnI及cTnT作为心肌细胞分化的早期标志物已得到了公认,是目前特异性检测心肌细胞应用最普遍的指标[19]。本研究结果显示,AST在100 μmol/L浓度下作用72 h时对BMSCs增殖的作用最佳;荧光倒置相差显微镜观察显示,AST组BMSCs呈束状排列,成簇状生长,说明AST体外诱导SD大鼠BMSCs形态分化类似心肌样细胞;MTT法检测结果显示,AST组Desmin、α-SCA、cTnI mRNA表达水平高于5-AZA组和BMSCs组;BMSCs组cTnT表达水平最低,AST组cTnT表达水平低于5-AZA组,表明AST能够诱导BMSCs向心肌细胞分化,但促分化效果弱于5-AZA,与相关文献报道一致[20]。
综上所述,AST能够诱导BMSCs向心肌细胞分化,具有效果显著、作用确切等特点,符心血管疾病防治要求,有良好的应用推广价值。
作者贡献:赵静苗进行文章的构思与设计,文献资料收集、整理文章的可行性分析、撰写论文、对文章整体负责;赵静苗、王秋萍进行实验研究,赵静苗、胡继宏进行论文的修订,英文的修订,文章的质量控制及审校,监督管理。
本文无利益冲突。
[1]张璇,许海燕.国内外急性心肌梗死注册登记研究进展[J].心血管病学进展,2014,35(3):286-290.DOI:10.3969/j.issn.1004-3934.2014.03.005. ZHANG X,XU H Y.Progress in the registration of acute myocardial infarction athome and abroad[J].Advances in Cardiovascular Diseases,2014,35(3):286-290.DOI:10.3969/j.issn.1004-3934.2014.03.005.
[2]胡馨,刘红旭.国内外急性心肌梗死注册登记研究概况[J].北京中医药,2015,34(3):192-195.DOI:10.16025/j.1674-1307.2015.03.009. HU X,LIU H X.An overview of domestic and international research on the registration of acute myocardial infarction[J].Beijing Traditional Chinese Medicine,2015,34(3):192-195.DOI:10.16025/j.1674-1307.2015.03.009.
[3]胡大一.冠心病诊断与治疗研究进展[J].中华心血管病杂志,2003,31(11):806-811.DOI:10.3760/j:issn:0253-3758.2003.11.002. HU D Y.Advances in diagnosis and treatment of coronary heart disease[J].Chinese Journal of Cardiology,2003,31(11):806-811.DOI:10.3760/j:issn:0253-3758.2003.11.002.
[4]张海燕,李强.心肌梗死后心室重构病理过程的研究进展[J].实用老年学,2012,26(3):251-253.DOI:10.3969/j.issn.1003-9198.2012.03.027. ZHANG H Y,LI Q.Research progress on the pathological process of ventricular remodeling after myocardial infarction[J].2012,26(3):251-253.DOI:10.3969/j.issn.1003-9198.2012.03.027.
[5] WANG H,ZHOU J,LIU Z,et al.Injectable cardiac tissue engineering for the treatment of myocardial infarction[J].J Cell Mol Med,2010,14(5):1044-1055.DOI:10.1111/j.1582-4934.2010.01046.x.
[6] ZHU H,SONG X,JIN L J,et al.Comparison of intra-coronary cell transplantation after myocardial infarction:autologous skeletal myoblasts versus bone marrow mesenchymal stem cells[J].J Int Med Res,2009,37(2):298-307.DOI:10.1177/147323000903700 203.
[7] MAKINO S,FUKUDA K,MIYOSHI S,et al.Cardiomyocytes can be generated from marrow storml cells in vitro[J].J Clin Invest,1999,103(5):697-705.DOI: 10.1172/JCI5298.
[8] 孙敬和,冼绍祥,黄习文,等.中医药干预骨髓间充质干细胞体外定向诱导分化为心肌细胞的研究进展[J].中药新药与临床药理,2012,23(1):115-118.DOI:10.3969/j.issn.1003-9783.2012.01.033. SUN J H,XIAN S X,HUANG X W,et al.Research progress of traditional Chinese medicine intervention on the differentiation of bone marrow mesenchymal stem cells into cardiomyocytes in vitro[J].Traditional Chinese Drug Research and Clinical Pharmacology,2012,23(1):115-118.DOI:10.3969/j.issn.1003-9783.2012.01. 033.
[9]赵瑞东,周二霞,韩霞,等.黄芪甲苷对间充质干细胞生物活性的影响[J].世界最新医学信息文摘,2015,15(19):10-11.DOI:10.3969/j.issn.1671-3141.2015.19.006. ZHAO R D,ZHOU E X,HAN X,et al.Effects of astragaloside Ⅳ on the biological activity of mesenchymal stem cell[J].World Latest Medicine Information,2015,15(19):10-11.DOI:10.3969/j.issn.1671-3141.2015.19.006.
[10] ZINK M,GOMBOTZ H,WASLER A,et al.Intragraft interleukin 2 mRNA expression during acute cellular rejection and left ventricular total wall thickness afterheart transplantation[J].Heart,2002,87(4):363.
[11]董亮,薛松.间充质干细胞向心肌细胞分化的诱导研究[J].国际心血管病杂志,2012,39(1):32-35.DOI:10.3969/j.issn.1673-6583.2012.01.010. DONG L,XUE S.Induction of differentiation of mesenchymal stem cells into cardiomyocytes[J].International Journal of Cardiovascular Diseases,2012,39(1):32-35.DOI:10.3969/j.issn.1673-6583.2012.01.010.
[12] LI X H,FU Y H,LIN Q X,et al.Induced bone marow mesenchymal stem cells improve cardiac performance of infaerted rat hearts[J].Mol Biol Rep,2012,39(2):1333-1342.DOI:10.1007/s11033-011-0867-2.
[13]LI W,LI G,ZHANG Y,et al.Role of P2×7 receptor in the differentiation of bone marrow stomal cells into osteblasts and adipocytes[J].Exp Cell Res,2015,339(2):367-379.DOI: 10.1016/j.yexcr.
[14] BAXTER M A,WYNN R F,JOWITT S N,et al.Study of telomere lenght reveals rapid aging of huamn marrow stomal cells following in vitro expansion[J].Stem Cells,2004,22(5):657-682.DOI: 10.1634/stemcells.22-5-675.
[15] BURLACU A,ROSCA A M,MANIU H,et al.Promoting effect of 5-azacytidine on the myogenic differentiation of boen marrow stromal cells[J].Eur J Cell Biol,2008,87(3):173-184.DOI:10.1016/j.ejcb.2007.09.003.
[16]冼绍祥,杨忠奇,秦佳佳,等.5-氮胞苷诱导大鼠骨髓间充质干细胞向心肌样细胞分化及黄芪甲苷的协同作用[J].中国组织工程研究,2012,16(10):1861-1865.DOI:10.3969/j.issn.1673-8225.2012.10.033. XIAN S X,YANG Z Q,QIN J J,et al.Bone marrow mesenchymal stem cells differentiation into cardiomyocyte-like cells induced by 5-azacytidine and astragaloside Ⅳ[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2012,16(10):1861-1865.DOI:10.3969/j.issn.1673-8225.2012.10.033.
[17] 曹京燕,程月新,姜敏辉,等.5-氮胞苷体外诱导骨髓间充质干细胞向心肌样细胞的分化[J].心脏杂志,2009,20(6):801-804.DOI:10.13191/j.chj.2009.06.51.caojy.007. CAO J Y,CHENG Y X,JIANG M H,et al.Differentiation of bone marrow mesenchymal stem cells into cardiomyocyte like cells induced by 5-azacytidine vitro[J].2009,20(6):801-804.DOI:10.13191/j.chj.2009.06.51.caojy.007.
[18] ZHAO P,WANG Y,ZENG S,et al.Protective effect of astragaloside Ⅳ on lipopolysaccharide-induced cardiacdysfunction via downregulation of inflammatory signaling in mice[J].Immunopharmacol Immunotoxicol,2015,37(5):428-433.
[19]胡丙杰,陈玉川,祝家镇,等.结蛋白诊断早期心肌梗死的特异性研究[J].法律与医学杂志,2000,7(4):145-148.DOI:10.3969/j.issn.1674-1226.2000.04.001. HU B J,CHEN Y C,ZHU J Z,et al.Study on the specificity of desmin in the diagnosisof early myocardial infarction[J].Journal of Law and Medicine,2000,7(4):145-148.DOI:10.3969/j.issn.1674-1226.2000.04.001.
[20]黄灿,冼绍祥,马春涛,等.黄芪甲苷预处理对无血清及缺氧诱导的骨髓间充质干细胞 TNF-α、TGF-β1基因表达的影响[J].长春中医药大学学报,2016,32(1):25-27,36.DOI:10.13463/j.cnki.cczyy.2016.01.008. HUANG C,XIAN S X,MA C T,et al.Effects of astragaloside pretreatment on the expression of TNF- alpha and TGF- beta 1 in bone marrow mesenchymal stem cells induced by serum and hypoxia in vitro[J].Journal of Changchun University of Traditional Chinese Medicine,2016,32(1):25-27,36.DOI:10.13463/j.cnki.cczyy.2016.01.008.
(本文编辑:赵跃翠)
Astragaloside Effect on the Differentiation of Rat Bone Marrow Mesenchymal Stem Cells into Cardiomyogenic Cells in Vitro
ZHAOJing-miao,HUJi-hong*,WANGQiu-ping
GansuKeyLaboratoryforthePreventionandTreatmentofMajorDiseasesbyMolecularMedicineandChineseMedicine,GansuUniversityofChineseMedicine,Lanzhou730000,China
*Correspondingauthor:HUJi-hong,Associateprofessor;E-mail:hujihonghappy@163.com
Objective To investigate the astragaloside(AST) effect on the differentiation of bone marrow mesenchymal stem cells(BMSCs) into cardiomyogenic cells in SD rats.Methods BMSCs were subcultured on behalf of BMSCs.The proliferation of BMSCs was detected by MTT assay at 24,48,72 h after the inducing with different concentrations of AST.The 4th generation of BMSCs were divided into BMSCs group,5-azacytidine group(5-AZA group) and AST group,cultured with the culture medium with 10% fetal bovine serum,the culture medium with 10 μmol/L 5-AZA,and the culture medium with 100 μmol/L AST,respectively.Morphological changes of BMSCs were observed by phase contrast fluorescence inverted microscopy.The expression levels of Desmin mRNA,α-Sarcomeric actin(α-SCA) mRNA and troponin(cTnI) mRNA in the BMSCs group,5-AZA group and AST group were measured by Real-time qPCR,and the expression levels of cTnT in these three groups were detected by western blotting.Results The proliferation of BMSCs was the best when they were induced for 72 h by AST at the concentration of 100 μmol / L(P<0.05).Morphological differentiation of BMSCs induced by AST in vitro was similar to that of cardiomyogenic cells.The BMSCs group had lower expression levels of Desmin mRNA,α-SCA mRNA and cTnI mRNA than 5-AZA group and AST group(P<0.05).Compared with 5-AZA group,the expression levels of Desmin mRNA,α-SCA mRNA and cTnI mRNA in AST group were higher(P<0.05).5-AZA group and AST group had higher cTnT expression levels than the BMSCs group(P<0.05).Compared with 5-AZA group,AST group had lower expression levels of cTnT(P<0.05).Conclusion The differentiation of BMSCs into cardiomyogenic cells in vitro can be promoted after being induced by AST with a concentration of 100 μmol/L for 72 hours,but the induction effect of AST is weaker than 5-AZA.
Myocytes,cardiac;Cell differentiation;Bone marrow mesenchymal stem cells;Astragaloside
国家自然科学基金资助项目(81260597)
R 329.21
A
10.3969/j.issn.1007-9572.2017.05.y11
2017-02-20;
2017-05-10)
730000甘肃省兰州市,甘肃中医药大学甘肃重大疾病分子医学与中医药防治研究省级重点实验室
*通信作者:胡继宏,副教授;E-mail:hujihonghappy@163.com

