雷公藤红素对肾透明细胞癌786-0细胞的作用及其机制研究
张小路,杜梅红,张 全,陈红跃,赵 林,郭伟胜
·论著·
雷公藤红素对肾透明细胞癌786-0细胞的作用及其机制研究
张小路1*,杜梅红2,张 全1,陈红跃1,赵 林1,郭伟胜2
背景 肾透明细胞癌发病率高,治愈率低。雷公藤红素可调节肿瘤细胞中细胞因子,从而抑制肿瘤细胞增殖。而有关雷公藤红素对肾透明细胞癌786-0细胞的作用研究较少。目的 探讨雷公藤红素对肾透明细胞癌786-0细胞的作用及其机制,以期为探索治疗肾透明细胞癌的药物提供借鉴。方法 2015年2月—2016年5月,培养肾透明细胞癌786-0细胞和正常肾小管上皮细胞HK2细胞(简称肾细胞HK2细胞)。检测不同浓度(0、0.5、1.0、1.5、2.0 μmol/L)雷公藤红素作用不同时间(12、24、48 h)肾透明细胞癌786-0、肾细胞HK2细胞存活率;检测不同浓度(0、0.5、1.0、1.5、2.0 μmol/L)雷公藤红素、1.5 μmol/L 5-氟尿嘧啶(5-Fu)作用下肾透明细胞癌786-0、肾细胞HK2细胞毒性;检测不同浓度(0、1.5、2.0 μmol/L)雷公藤红素、1.5 μmol/L 5-Fu作用下肾透明细胞癌786-0、肾细胞HK2细胞周期、凋亡率;检测不同浓度(0、0.5、1.0、1.5 μmol/L)雷公藤红素作用下肾透明细胞癌786-0、肾细胞HK2细胞线粒体膜电位;检测不同浓度(0、0.5、1.0、1.5 μmol/L)雷公藤红素作用下肾透明细胞癌786-0细胞中含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-3、caspase-9活性,Bax、B淋巴细胞瘤-2(Bcl-2)、细胞色素c、磷酸多核糖基核糖醇(PRRP)水平。结果 0、0.5、1.0、1.5、2.0 μmol/L雷公藤红素作用12、24、48 h时肾透明细胞癌786-0细胞存活率随浓度增加依次减小(P<0.05)。1.0 μmol/L雷公藤红素作用24、48 h时肾透明细胞癌786-0细胞存活率小于12 h时(P<0.05);1.5、2.0 μmol/L雷公藤红素作用12、24、48 h时肾透明细胞癌786-0细胞存活率随时间增加依次减小(P<0.05)。0.5 μmol/L雷公藤红素、1.0 μmol/L雷公藤红素、1.5 μmol/L雷公藤红素、2.0 μmol/L雷公藤红素、1.5 μmol/L 5-Fu作用下肾透明细胞癌786-0、肾细胞HK2细胞毒性大于0 μmol/L雷公藤红素(P<0.05);2.0 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞毒性大于0.5、1.0、1.5 μmol/L雷公藤红素,肾细胞HK2细胞毒性大于1.0 μmol/L雷公藤红素(P<0.05);1.5 μmol/L 5-Fu作用下肾透明细胞癌786-0、肾细胞HK2细胞毒性大于0.5、1.0、1.5、2.0 μmol/L雷公藤红素(P<0.05)。0、1.5 μmol/L雷公藤红素作用下G2/M期肾透明细胞癌786-0细胞、肾细胞HK2细胞少于S、G0/G1期(P<0.05);2.0 μmol/L雷公藤红素、1.5 μmol/L 5-Fu作用下G0/G1期肾透明细胞癌786-0细胞、肾细胞HK2细胞多于S期,G2/M期肾透明细胞癌786-0细胞、肾细胞HK2细胞少于S、G0/G1期(P<0.05)。1.5 μmol/L雷公藤红素、2.0 μmol/L雷公藤红素、1.5 μmol/L 5-Fu作用下肾透明细胞癌786-0细胞凋亡率大于0 μmol/L雷公藤红素(P<0.05);2.0 μmol/L雷公藤红素、1.5 μmol/L 5-Fu作用下肾透明细胞癌786-0细胞凋亡率大于1.5 μmol/L雷公藤红素(P<0.05);1.5 μmol/L 5-Fu作用下肾细胞HK2细胞凋亡率大于0 μmol/L雷公藤红素、2.0 μmol/L雷公藤红素(P<0.05)。0、0.5、1.0、1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞线粒体膜电位依次增大(P<0.05)。0、0.5、1.0、1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞中caspase-3、caspase-9活性依次增大(P<0.05)。0、0.5、1.0、1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞中Bax、细胞色素c、PRRP水平依次升高,Bcl-2水平依次降低(P<0.05)。结论 雷公藤红素可能通过激活caspase-3、caspase-9活性,上调Bax、细胞色素c、PRRP水平,下调Bcl-2水平来抑制肾透明细胞癌786-0细胞的增殖并诱导其凋亡。
肾肿瘤;腺癌,透明细胞;雷公藤红素;细胞增殖;细胞凋亡
张小路,杜梅红,张全,等.雷公藤红素对肾透明细胞癌786-0细胞的作用及其机制研究[J].中国全科医学,2017,20(21):2590-2597.[www.chinagp.net]
ZHANG X L,DU M H,ZHANG Q,et al.Effect and mechanism of celastrol on the renal clear cell carcinoma 786-0 cells[J].Chinese General Practice,2017,20(21):2590-2597.
肾透明细胞癌是由胞质透明或嗜酸性的肿瘤细胞构成的恶性肿瘤,肿瘤内有纤细的血管网。肾透明细胞癌多发生于双侧肾脏,肿瘤中常见囊腔、坏死、出血和钙化,影像学可显示钙化影;其发病率较高,为60%~85%[1]。肾透明细胞癌786-0细胞源自原发性肾透明细胞癌,此细胞有微绒毛和桥粒,能在软琼脂中生长。雷公藤红素是三萜类醌甲基化合物,具有抗炎、抗神经退行性疾病作用[2],可调节靶点肿瘤坏死因子α(TNF-α)、血管内皮生长因子(VEGF)、促炎因子、细胞因子等,起到抗炎和抑制肿瘤细胞增殖的作用[3-4]。而有关雷公藤红素对于肾透明细胞癌786-0细胞作用的研究较少,特别是分子机制方面[5]。本研究旨在观察雷公藤红素对肾透明细胞癌786-0细胞增殖、周期、凋亡的作用,并探索细胞凋亡机制,以期为探索治疗肾透明细胞癌的药物提供借鉴。
1 材料与方法
1.1 材料与仪器 肾透明细胞癌786-0细胞株、正常肾小管上皮细胞HK2细胞(简称肾细胞HK2细胞)购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所;雷公藤红素(纯度>98%)购自上海融禾医药科技发展有限公司;乳酸脱氢酶(LDH)、含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-3、caspase-9试剂盒购自GIBICO;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)溶液、5-氟尿嘧啶(5-Fu)购自Sigma公司;Bax、B淋巴细胞瘤-2(Bcl-2)、细胞色素c、磷酸多核糖基核糖醇(PRRP)等兔抗人抗体(一抗)购自艾美捷科技有限公司;转膜仪购自Bio-Rad公司;FACSVerse流式细胞仪购自BD公司。
1.2 研究方法 本研究时间为2015年2月—2016年5月。
1.2.1 细胞培养[6]采用含10%小牛血清的RMPI 1640培养基培养肾透明细胞癌786-0细胞和肾细胞HK2细胞,于37 ℃、5% CO2条件下培养,贴壁80%时,消化并传代。
1.2.2 检测细胞存活率[7]取对数期肾透明细胞癌786-0细胞和肾细胞HK2细胞接种于96孔板,37 ℃、5% CO2条件下培养24 h,贴壁后的细胞分别采用不同浓度(0、0.5、1.0、1.5、2.0 μmol/L)雷公藤红素处理,12、24、48 h后加入MTT溶液(5 mg/ml)20 μl,孵育4 h,800 r/min离心2 min(离心半径6 cm),弃上清液,加150 μl十二烷基硫酸钠,振荡8 min。测定570 nm处吸光度,计算细胞存活率。实验独立重复3次。
1.2.3 检测细胞毒性[8-9]取对数期肾透明细胞癌786-0细胞和肾细胞HK2细胞,分别采用不同浓度(0、0.5、1.0、1.5、2.0 μmol/L)雷公藤红素、1.5 μmol/L 5-Fu处理,24 h后,采用LDH法于450 nm处检测细胞毒性。实验独立重复3次。
1.2.4 检测细胞周期[10]取对数期肾透明细胞癌786-0细胞和肾细胞HK2细胞,37 ℃、5% CO2条件下培养24 h,贴壁后,分别采用不同浓度(0、1.5、2.0 μmol/L)雷公藤红素、1.5 μmol/L 5-Fu处理,采用70%乙醇于-20 ℃固定,加入1 ml磷酸盐缓冲液(PBS)和10 μl核糖核酸酶(RNase),室温下培养30 min,加入10 μl碘化丙啶(PI)培养30 min,采用FACSVerse流式细胞仪检测细胞周期。实验独立重复3次。
1.2.5 检测细胞凋亡率[11]取对数期肾透明细胞癌786-0细胞和肾细胞HK2细胞,37 ℃、5% CO2条件下培养24 h,贴壁后,采用不同浓度(0、1.5、2.0 μmol/L)雷公藤红素、1.5 μmol/L 5-Fu处理,24 h后,加入胰蛋白酶消化,采用FACSVerse流式细胞仪检测细胞凋亡率。实验独立重复3次。
1.2.6 检测线粒体膜电位[12]取对数期肾透明细胞癌786-0细胞和肾细胞HK2细胞,采用不同浓度(0、0.5、1.0、1.5 μmol/L)雷公藤红素处理,24 h后,加入1 mmol/L罗丹明123进行细胞染色,37 ℃染色30 min,采用FACSVerse流式细胞仪检测线粒体膜电位。实验独立重复3次。
1.2.7 检测caspase-3、caspase-9活性[13]取对数期肾透明细胞癌786-0细胞,采用不同浓度(0、0.5、1.0、1.5 μmol/L)雷公藤红素处理,24 h后,裂解15 min,12 000 r/min离心20 min(离心半径3 cm),取上清液(含30 μg蛋白),加入90 μl探针和10 μl蛋白酶,37 ℃培养2 h,测定570 nm处吸光度,判定caspase-3、caspase-9活性。实验独立重复3次。
1.2.8 检测Bax、Bcl-2、细胞色素c、PRRP水平[14]取对数期肾透明细胞癌786-0细胞,制成3×105个/ml单细胞悬液,接种于培养瓶,37 ℃、5% CO2条件下培养24 h,采用不同浓度(0、0.5、1.0、1.5 μmol/L)雷公藤红素处理,24 h后收集细胞;12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至聚偏氟乙烯(PVDF)膜,5%脱脂牛奶封闭2 h,加入一抗4 ℃过夜;PBST洗3次,5 min/次;加入二抗,室温孵育1 h;增强化学发光法(ECL)显色,读取灰度值,即Bax、Bcl-2、细胞色素c、PRRP水平。实验独立重复3次。
2 结果
2.1 细胞存活率 不同浓度雷公藤红素作用不同时间肾透明细胞癌786-0细胞存活率组间比较,差异均有统计学意义(P<0.05);0.5、1.0、1.5、2.0μmol/L雷公藤红素作用12、24、48h时肾透明细胞癌786-0细胞存活率小于0μmol/L雷公藤红素,1.0、1.5、2.0μmol/L雷公藤红素作用12、24、48h时肾透明细胞癌786-0细胞存活率小于0.5μmol/L雷公藤红素,1.5、2.0μmol/L雷公藤红素作用12、24、48h时肾透明细胞癌786-0细胞存活率小于1.0μmol/L雷公藤红素,2.0μmol/L雷公藤红素作用12、24、48h时肾透明细胞癌786-0细胞存活率小于1.5μmol/L雷公藤红素,差异有统计学意义(P<0.05)。0.5μmol/L雷公藤红素作用不同时间肾透明细胞癌786-0细胞存活率组内比较,差异无统计学意义(P>0.05);1.0、1.5、2.0μmol/L雷公藤红素作用不同时间肾透明细胞癌786-0细胞存活率组内比较,差异有统计学意义(P<0.05);1.0μmol/L雷公藤红素作用24、48h时肾透明细胞癌786-0细胞存活率小于12h时,差异有统计学意义(P<0.05);1.5、2.0μmol/L雷公藤红素作用24、48h时肾透明细胞癌786-0细胞存活率小于12h时,48h时肾透明细胞癌786-0细胞存活率小于24h时,差异有统计学意义(P<0.05,见表1)。
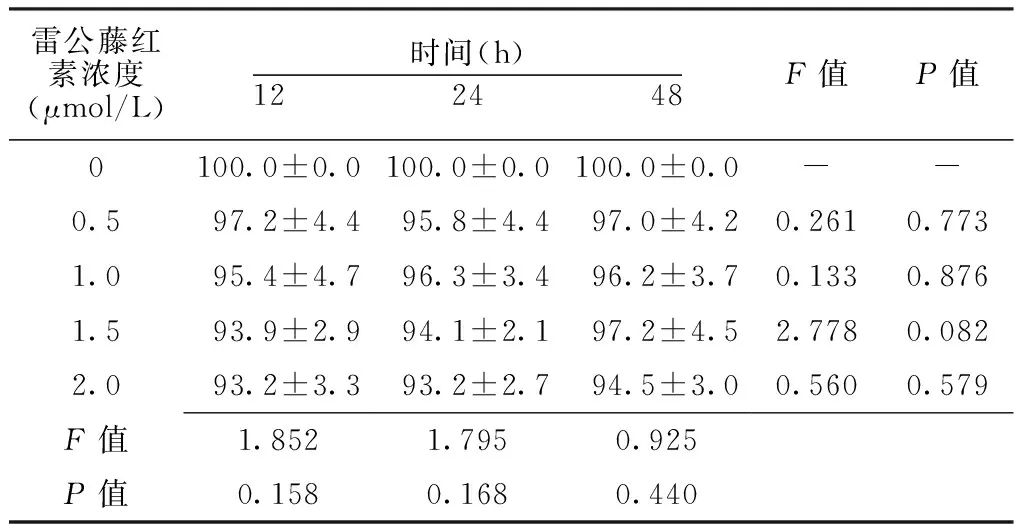
不同浓度雷公藤红素作用不同时间肾细胞HK2细胞存活率组间比较,差异均无统计学意义(P>0.05)。不同浓度雷公藤红素作用不同时间肾细胞HK2细胞存活率组内比较,差异均无统计学意义(P>0.05,见表2)。

Table 1 Comparison of survival rate of renal clear cell carcinoma 786-0 cells after treating with celastrol at different concentrations for different time

雷公藤红素浓度(μmol/L)时间(h)12 24 48 F值P值0100.0±0.0 100.0±0.0 100.0±0.0 --0.595.1±5.0a94.3±4.7a93.4±4.7a 0.267 0.7681.088.4±4.7ab80.2±4.2abe78.4±4.6abe12.654<0.0011.580.3±2.8abc73.6±2.7abce60.2±2.2abcef143.003<0.0012.058.6±1.4abcd45.4±2.0abcde36.2±1.6abcdef404.258<0.001F值209.031402.689597.603P值<0.001<0.001<0.001
注:与0 μmol/L雷公藤红素比较,aP<0.05;与0.5 μmol/L雷公藤红素比较,bP<0.05;与1.0 μmol/L雷公藤红素比较,cP<0.05;与1.5 μmol/L雷公藤红素比较,dP<0.05;与12 h比较,eP<0.05;与24 h比较,fP<0.05;-表示无此项数据
2.2 细胞毒性 不同浓度雷公藤红素、5-Fu作用下肾透明细胞癌786-0、肾细胞HK2细胞毒性比较,差异有统计学意义(P<0.05);0.5 μmol/L雷公藤红素、1.0 μmol/L雷公藤红素、1.5 μmol/L雷公藤红素、2.0 μmol/L雷公藤红素、1.5 μmol/L 5-Fu作用下肾透明细胞癌786-0、肾细胞HK2细胞毒性大于0 μmol/L雷公藤红素,差异有统计学意义(P<0.05);2.0 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞毒性大于0.5、1.0、1.5 μmol/L雷公藤红素,肾细胞HK2细胞毒性大于1.0 μmol/L雷公藤红素,差异有统计学意义(P<0.05);1.5 μmol/L 5-Fu作用下肾透明细胞癌786-0、肾细胞HK2细胞毒性大于0.5、1.0、1.5、2.0 μmol/L雷公藤红素,差异有统计学意义(P<0.05,见表3)。
2.3 细胞周期 不同浓度雷公藤红素、5-Fu作用下不同细胞周期肾透明细胞癌786-0细胞、肾细胞HK2细胞组间比较,差异均无统计学意义(P>0.05)。不同浓度雷公藤红素、5-Fu作用下不同细胞周期肾透明细胞癌786-0细胞、肾细胞HK2细胞组内比较,差异有统计学意义(P<0.05);0、1.5 μmol/L雷公藤红素作用下G2/M期肾透明细胞癌786-0细胞、肾细胞HK2细胞少于S、G0/G1期,差异有统计学意义(P<0.05);2.0 μmol/L雷公藤红素、1.5 μmol/L 5-Fu作用下G0/G1期肾透明细胞癌786-0细胞、肾细胞HK2细胞多于S期,G2/M期肾透明细胞癌786-0细胞、肾细胞HK2细胞少于S、G0/G1期,差异有统计学意义(P<0.05,见表4、5)。
Table 2 Comparison of survival rate of renal cells HK2 cells after treating with celastrol at different concentrations for different time
雷公藤红素浓度(μmol/L)时间(h)12 24 48F值P值0100.0±0.0100.0±0.0100.0±0.0--0.597.2±4.495.8±4.497.0±4.20.2610.7731.095.4±4.796.3±3.496.2±3.70.1330.8761.593.9±2.994.1±2.197.2±4.52.7780.0822.093.2±3.393.2±2.794.5±3.00.5600.579F值1.8521.7950.925P值0.1580.1680.440
注:-表示无此项数据
Table 3 Comparison of cytotoxicity of renal clear cell carcinoma 786-0 cells,renal cells HK2 cells after treating with celastrol at different concentrations and 5-Fu
药物肾透明细胞癌786-0细胞毒性肾细胞HK2细胞毒性0μmol/L雷公藤红素100.0±0.0100.0±0.00.5μmol/L雷公藤红素108.2±0.4a108.1±0.4a1.0μmol/L雷公藤红素109.2±1.2a107.1±1.3a1.5μmol/L雷公藤红素110.3±1.1a109.2±2.0a2.0μmol/L雷公藤红素215.4±2.3abcd110.1±2.2ac1.5μmol/L5-Fu220.2±2.2abcde113.3±2.1abcdeF值4511.52123.486P值<0.001<0.001
注:与0 μmol/L雷公藤红素比较,aP<0.05;与0.5 μmol/L雷公藤红素比较,bP<0.05;与1.0 μmol/L雷公藤红素比较,cP<0.05;与1.5 μmol/L雷公藤红素比较,dP<0.05;与2.0 μmol/L雷公藤红素比较,eP<0.05;5-Fu=5-氟尿嘧啶
2.4 细胞凋亡率 不同浓度雷公藤红素、5-Fu作用下肾透明细胞癌786-0、肾细胞HK2细胞凋亡率比较,差异有统计学意义(P<0.05);1.5 μmol/L雷公藤红素、2.0 μmol/L雷公藤红素、1.5 μmol/L 5-Fu作用下肾透明细胞癌786-0细胞凋亡率大于0 μmol/L雷公藤红素,差异有统计学意义(P<0.05);2.0 μmol/L雷公藤红素、1.5 μmol/L 5-Fu作用下肾透明细胞癌786-0细胞凋亡率大于1.5 μmol/L雷公藤红素,差异有统计学意义(P<0.05);1.5 μmol/L 5-Fu作用下肾细胞HK2细胞凋亡率大于0 μmol/L雷公藤红素、2.0 μmol/L雷公藤红素,差异有统计学意义(P<0.05,见表6)。
2.5 线粒体膜电位 不同浓度雷公藤红素作用下肾透明细胞癌786-0细胞线粒体膜电位比较,差异有统计学意义(P<0.05);0.5、1.0、1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞线粒体膜电位大于0 μmol/L雷公藤红素,1.0、1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞线粒体膜电位大于0.5 μmol/L雷公藤红素,1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞线粒体膜电位大于1.0 μmol/L雷公藤红素,差异有统计学意义(P<0.05)。不同浓度雷公藤红素作用下肾细胞HK2细胞线粒体膜电位比较,差异无统计学意义(P>0.05,见表7)。
Table 4 Comparison of cell cycle of renal clear cell carcinoma 786-0 cells after treating with celastrol at different concentrations and 5-Fu
药物肾透明细胞癌786-0细胞周期(期)S G0/G1 G2/MF值P值0μmol/L雷公藤红素38.2±3.436.8±2.021.0±1.5ab46.393<0.0011.5μmol/L雷公藤红素36.2±2.539.1±3.421.4±1.7ab39.878<0.0012.0μmol/L雷公藤红素34.3±4.741.3±1.6a24.4±2.1ab22.5050.0021.5μmol/L5-Fu33.0±4.139.7±2.6a24.8±2.1ab17.5140.003F值1.0691.6523.406P值0.4150.2530.074
注:与S期比较,aP<0.05;与G0/G1期比较,bP<0.05
Table 5 Comparison of cell cycle of renal cells HK2 cells after treating with celastrol at different concentrations and 5-Fu
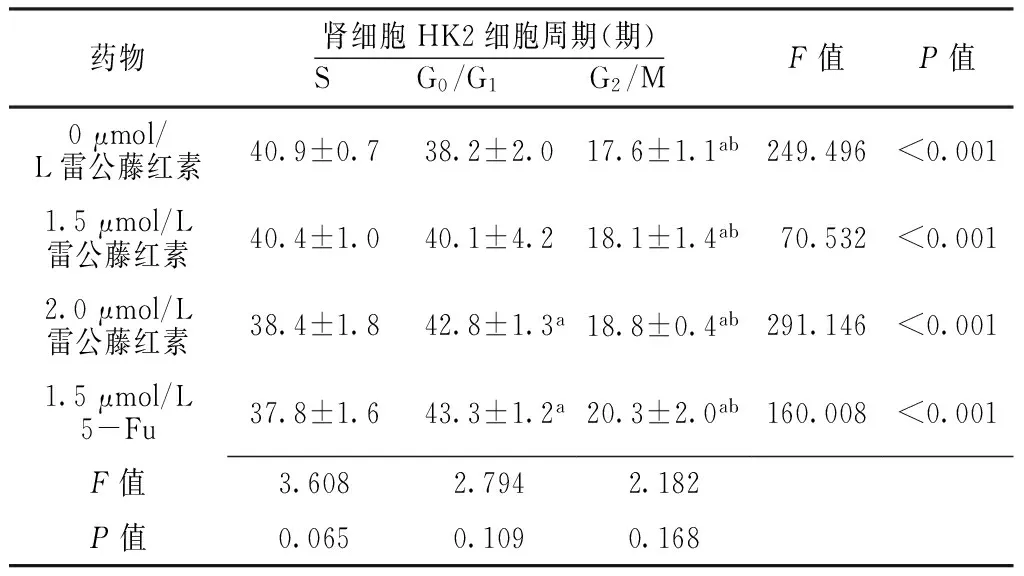
药物肾细胞HK2细胞周期(期)S G0/G1 G2/MF值P值0μmol/L雷公藤红素40.9±0.738.2±2.017.6±1.1ab249.496<0.0011.5μmol/L雷公藤红素40.4±1.040.1±4.218.1±1.4ab70.532<0.0012.0μmol/L雷公藤红素38.4±1.842.8±1.3a18.8±0.4ab291.146<0.0011.5μmol/L5-Fu37.8±1.643.3±1.2a20.3±2.0ab160.008<0.001F值3.6082.7942.182P值0.0650.1090.168
注:与S期比较,aP<0.05;与G0/G1期比较,bP<0.05
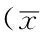
Table 6 Comparison of apoptosis rate of renal clear cell carcinoma 786-0 cells,renal cells HK2 cells after treating with celastrol at different concentrations and 5-Fu

药物肾透明细胞癌786-0细胞凋亡率肾细胞HK2细胞凋亡率0μmol/L雷公藤红素3.9±0.83.7±0.61.5μmol/L雷公藤红素27.6±1.2a4.6±0.62.0μmol/L雷公藤红素54.1±3.5ab4.1±0.51.5μmol/L5-Fu50.3±3.3ab5.3±0.6acF值260.2364.199P值<0.0010.046
注:与0 μmol/L雷公藤红素比较,aP<0.05;与1.5 μmol/L雷公藤红素比较,bP<0.05;与2.0 μmol/L雷公藤红素比较,cP<0.05
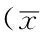
Table 7 Comparison of mitochondrial membrane potential of renal clear cell carcinoma 786-0 cells,renal cells HK2 cells after treating with celastrol at different concentrations

雷公藤红素浓度(μmol/L)肾透明细胞癌786-0细胞线粒体膜电位肾细胞HK2细胞线粒体膜电位015.2±1.214.2±1.00.518.6±1.4a15.1±1.21.035.7±1.8ab15.2±1.51.549.8±2.2abc16.2±2.2F值268.3860.814P值<0.0010.521
注:与0 μmol/L雷公藤红素比较,aP<0.05;与0.5 μmol/L雷公藤红素比较,bP<0.05;与1.0 μmol/L雷公藤红素比较,cP<0.05
2.6 caspase-3、caspase-9活性 不同浓度雷公藤红素作用下肾透明细胞癌786-0细胞中caspase-3、caspase-9活性比较,差异有统计学意义(P<0.05);0.5、1.0、1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞中caspase-3、caspase-9活性大于0 μmol/L雷公藤红素,1.0、1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞中caspase-3、caspase-9活性大于0.5 μmol/L雷公藤红素,1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞中caspase-3、caspase-9活性大于1.0 μmol/L雷公藤红素,差异有统计学意义(P<0.05,见表8)。

Table 8 Comparison of caspase-3,caspase-9 activity in the renal clear cell carcinoma 786-0 cells after treating with celastrol at different concentrations

雷公藤红素浓度(μmol/L)caspase-3caspase-901.00±0.001.00±0.000.51.22±0.02a1.34±0.02a1.01.64±0.05ab1.52±0.02ab1.51.71±0.03abc1.85±0.05abcF值356.433492.471P值<0.001<0.001
注:与0 μmol/L雷公藤红素比较,aP<0.05;与0.5 μmol/L雷公藤红素比较,bP<0.05;与1.0 μmol/L雷公藤红素比较,cP<0.05;caspase=含半胱氨酸的天冬氨酸蛋白水解酶
2.7 Bax、Bcl-2、细胞色素c、PRRP水平 不同浓度雷公藤红素作用下肾透明细胞癌786-0细胞中Bax、Bcl-2、细胞色素c、PRRP水平比较,差异有统计学意义(P<0.05);0.5、1.0、1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞中Bax、细胞色素c、PRRP水平高于0 μmol/L雷公藤红素,Bcl-2水平低于0 μmol/L雷公藤红素,差异有统计学意义(P<0.05);1.0、1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞中Bax、细胞色素c、PRRP水平高于0.5 μmol/L雷公藤红素,Bcl-2水平低于0.5 μmol/L雷公藤红素,差异有统计学意义(P<0.05);1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞中Bax、细胞色素c、PRRP水平高于1.0 μmol/L雷公藤红素,Bcl-2水平低于1.0 μmol/L雷公藤红素,差异有统计学意义(P<0.05,见表9)。
3 讨论
雷公藤红素是从中药雷公藤的根皮当中提取出的一种三萜类的天然产物[15]。2006年,中美两国科学家通过体内、体外抗肿瘤机制研究证实,雷公藤红素是一种有效的抗癌活性成分,掀起了雷公藤红素抗癌研究的热潮[16]。研究者相继发现雷公藤红素对前列腺癌、子宫癌、乳腺癌等多种癌症的癌细胞具有较强的杀伤作用[17],提示雷公藤红素有望成为一种新型抗肿瘤辅助药物,然而,雷公藤红素对肾透明细胞癌细胞增殖及凋亡影响的研究较少。同时,本文通过比较雷公藤红素与化疗药物5-Fu对肾透明细胞癌786-0细胞的作用的差异性,为雷公藤红素成为新一代抗肿瘤辅助药物提供依据。
表9 不同浓度雷公藤红素作用下肾透明细胞癌786-0细胞中Bax、Bcl-2、细胞色素c、PRRP水平比较
Table 9 Comparison of the levels of Bax,Bcl-2,cytochrome c and PRRP in the renal clear cell carcinoma 786-0 cells after treating with celastrol at different concentrations

雷公藤红素浓度(μmol/L)BaxBcl-2细胞色素cPRRP01.00±0.001.00±0.001.00±0.001.00±0.000.51.21±0.03a0.81±0.03a1.13±0.03a1.21±0.03a1.01.41±0.03ab0.42±0.04ab1.41±0.02ab1.31±0.02ab1.51.61±0.04abc0.31±0.02abc1.82±0.03abc1.52±0.03abcF值249.788395.205854.310309.253P值<0.001<0.001<0.001<0.001
注:与0 μmol/L雷公藤红素比较,aP<0.05;与0.5 μmol/L雷公藤红素比较,bP<0.05;与1.0 μmol/L雷公藤红素比较,cP<0.05;Bcl-2=B淋巴细胞瘤-2,PRRP=磷酸多核糖基核糖醇
王莹等[18]研究发现,雷公藤红素对H1975细胞增殖有较明显的抑制作用且呈浓度和时间依赖性,能够显著抑制H1975细胞的侵袭能力。张乙川等[19]研究发现,雷公藤红素可以抑制人肝癌SMMC-7721细胞增殖并呈浓度和时间依赖性,可以增强caspase-3 活性。本研究结果显示,0、0.5、1.0、1.5、2.0 μmol/L雷公藤红素作用12、24、48 h时肾透明细胞癌786-0细胞存活率随浓度增加依次减小;1.0 μmol/L雷公藤红素作用24、48 h时肾透明细胞癌786-0细胞存活率小于12 h时;1.5、2.0 μmol/L雷公藤红素作用12、24、48 h时肾透明细胞癌786-0细胞存活率随时间增加依次减小;说明雷公藤红素对肾透明细胞癌786-0细胞增殖有较明显的抑制作用且呈浓度和时间依赖性。0.5 μmol/L雷公藤红素、1.0 μmol/L雷公藤红素、1.5 μmol/L雷公藤红素、2.0 μmol/L雷公藤红素、1.5 μmol/L 5-Fu作用下肾透明细胞癌786-0、肾细胞HK2细胞毒性大于0 μmol/L雷公藤红素;2.0 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞毒性大于0.5、1.0、1.5 μmol/L雷公藤红素,肾细胞HK2细胞毒性大于1.0 μmol/L雷公藤红素;1.5 μmol/L 5-Fu作用下肾透明细胞癌786-0、肾细胞HK2细胞毒性大于0.5、1.0、1.5、2.0 μmol/L雷公藤红素;说明雷公藤红素的细胞毒性小于5-Fu。0、1.5 μmol/L雷公藤红素作用下G2/M期肾透明细胞癌786-0细胞、肾细胞HK2细胞少于S、G0/G1期;2.0 μmol/L雷公藤红素、1.5 μmol/L 5-Fu作用下G0/G1期肾透明细胞癌786-0细胞、肾细胞HK2细胞多于S期,G2/M期肾透明细胞癌786-0细胞、肾细胞HK2细胞少于S、G0/G1期;说明雷公藤红素以抑制肾透明细胞癌786-0细胞、肾细胞HK2细胞处于S期为主。1.5 μmol/L雷公藤红素、2.0 μmol/L雷公藤红素、1.5 μmol/L 5-Fu作用下肾透明细胞癌786-0细胞凋亡率大于0 μmol/L雷公藤红素;2.0 μmol/L雷公藤红素、1.5 μmol/L 5-Fu作用下肾透明细胞癌786-0细胞凋亡率大于1.5 μmol/L雷公藤红素;1.5 μmol/L 5-Fu作用下肾细胞HK2细胞凋亡率大于0 μmol/L雷公藤红素、2.0 μmol/L雷公藤红素;说明雷公藤红素对肾细胞HK2细胞安全性高于5-Fu,可以为雷公藤红素替代5-Fu提供依据。0、0.5、1.0、1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞线粒体膜电位依次增大,说明雷公藤红素促进肾透明细胞癌786-0细胞线粒体膜电位增大。与王莹等[18]和张乙川等[19]研究结果比较发现,雷公藤红素对不同细胞均有一定抑制作用,但对不同细胞的抑制率不同,且相同剂量的雷公藤红素对肾透明细胞癌抑制效果较好,这可能与细胞的特性有关。
caspase-3、caspase-9活性,Bax、Bcl-2、细胞色素c、PRRP水平等与细胞的生存状态密切相关,本文通过以上分子研究雷公藤红素对肾透明细胞癌786-0细胞的促凋亡作用的大小。caspase-3为关键的执行分子,其在细胞凋亡信号传导的途径中发挥着重要作用。本研究结果显示,0、0.5、1.0、1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞中caspase-3、caspase-9活性依次增大,说明雷公藤红素促进肾透明细胞癌786-0细胞分泌caspase-3、caspase-9,且呈浓度依赖性。0、0.5、1.0、1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞中Bax、细胞色素c、PRRP水平依次升高,与FORNER等[20]的报道一致,说明雷公藤红素促进肾透明细胞癌786-0细胞分泌Bax、细胞色素c、PRRP,且呈浓度依赖性。0、0.5、1.0、1.5 μmol/L雷公藤红素作用下肾透明细胞癌786-0细胞中Bcl-2水平依次降低,说明雷公藤红素抑制肾透明细胞癌786-0细胞分泌Bcl-2,且呈浓度依赖性,推测可能是雷公藤红素通过表皮生长因子受体(EGFR)通路下调了Bcl-2水平。细胞凋亡途径中的一条是以线粒体为核心,该途径能够促使肿瘤细胞凋亡并导致DNA损伤;异常细胞信号均引起促凋亡蛋白活化[21-23],导致线粒体释放细胞色素c,活化caspase-9和caspase-3,促进蛋白酶水解,引起细胞凋亡。凋亡通路被Bcl-2等凋亡抑制因子调控[19]。Bax/Bcl-2发生改变,表明Bax/Bcl-2在细胞凋亡中发挥了作用,且线粒体膜电位减少及胞质中细胞色素c水平升高[24]。
本文的创新点在于对线粒体膜电位和caspase活性进行了测定,而以往的研究少有报道。当然,本研究也存在一些不足之处,研究对象仅限于肾透明细胞癌786-0细胞,对于其他癌细胞类型还需进一步实验验证。
综上所述,雷公藤红素可能通过激活caspase-3、caspase-9活性,上调Bax、细胞色素c、PRRP水平,下调Bcl-2水平来抑制肾透明细胞癌786-0细胞的增殖并诱导其凋亡。
作者贡献:张小路进行文章的构思与设计;杜梅红进行研究的实施与可行性分析;张全进行数据收集,数据整理,统计学处理;陈红跃进行结果的分析与解释;张小路撰写论文;赵林进行论文的修订,英文的修订;郭伟胜负责文章的质量控制及审校;张小路对文章整体负责,监督管理。
本文无利益冲突。
[1] 吴佩军,李伟,华婷,等.肾透明细胞癌CT表现与病理[J].上海医学,2010,33(3):284-286. WU P J,LI W,HUA T,et al.Renal clear cell carcinoma:the correlation of CT findings with pathology[J].Shanghai Medical Journal,2010,33(3):284-286.
[2]罗伟,陈卫昌.雷公藤红素对结肠癌细胞株HCT-116生长的影响及其作用机制[J].苏州大学学报(医学版),2009,29(5):874-877. LUO W,CHEN W C.Effects and mechanisms of celastrol(GSL)on human colon cancer cell line HCT-116 in vitro[J].Suzhou University Journal of Medical Science,2009,29(5):874-877.
[3]许阳贤,宋海燕,季光.雷公藤红素对肝癌细胞SMMC-7721凋亡和周期的调控作用及机制[J].中成药,2015,37(6):1153-1157. XU Y X,SONG H Y,JI G.Effect and underlying mechanism of celastrol on apoptosis and cell cycle in hepatocarcinoma cell line SMMC-7721[J].Chinese Traditional Patent Medicine,2015,37(6):1153-1157.
[4]罗伟.雷公藤红素抑制结肠癌HCT-116细胞生长及其机制的实验研究[D].苏州:苏州大学,2009. LUO W.The studies to anti-tumor effect and its mechanisms of celastrol on human colon cancer cell line HCT-116[D].Suzhou:Soochow University,2009.
[5]陈永安,韩峭青,周敏,等.雷公藤红素对人肝癌MHCC97H细胞侵袭转移的影响及机制研究[J].中医学报,2014,29(5):623-625. CHEN Y A,HAN Q Q,ZHOU M,et al.Research on the effect of celastrol inhibits invasion and metastasis of human livel cancer MHCC97H cells and related mechanism[J].China Journal of Chinese Medicine,2014,29(5):623-625.
[6]PARKIN D M,BRAY F,FERLAY J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[7]刘晓,邢丽娜.核转录因子NF-κB与肿瘤[J].实用肿瘤学杂志,2007,21(2):191-193,196. LIU X,XING L N.Nuclear factor kappa NF- κB and tumor[J].Journal of Practical Oncology,2007,21(2):191-193,196.
[8]SETHI G,AHN K S,PANDEY M K,et al.Celastrol,a novel triterpene, potentiates TNF-induced apoptosis and suppresses invasion of tumor cells by inhibiting NF-kappaB-regulated gene products and TAK1-mediated NF-kappaB activation[J].Blood,2007,109(7):2727-2735.
[9]ZHU H,DING W J,WU R,et al.Synergistic anti-cancer activity by the combination of TRAIL/APO-2L and celastrol[J].Cancer Invest,2010,28(1):23-32.
[10]SUNG B,PARK B,YADAV V R,et al.Celastrol,a triterpene,enhances TRAIL-induced apoptosis through the down-regulation of cell survival proteins and up-regulation of death receptors[J].J Biol Chem,2010,285(15):11498-11507.
[11]PANG X,YI Z,ZHANG J,et al.Celastrol suppresses angiogenesis-mediated tumor growth through inhibition of AKT/mammalian target of rapamycin pathway[J].Cancer Res,2010,70(5):1951-1959.DOI:10.1158/0008-5472.CAN-09-3201.
[12]WU F,HAN M,WILSON J X.Tripterine prevents endothelial barrier dysfunction by inhibiting endogenous peroxynitrite formation[J].Br J Pharmacol,2009,157(6):1014-1023.
[13]KANG H,LEE M,JANG S W.Celastrol inhibits TGF-β1-induced epithelial-mesenchymal transition by inhibiting Snail and regulating E-cadherin expression[J].Biochem Biophys Res Commun,2013,437(4):550-556.DOI:10.1016/j.bbrc.2013.06.113.
[14]HU X,LI D,ZHANG W,et al.Matrix metalloproteinase-9 expression correlates with prognosis and involved in ovarian cancer cell invasion[J].Arch Gynecol Obstet,2012,286(6):1537-1543.
[15]DAI Y,DESANO J,TANG W,et al.Natural proteasome inhibitor celastrol suppresses and rogen-independent prostate cancer progression by modulating apoptotic proteins and NF-kappaB[J].PLoS One,2010,5(12):e14153.
[16]KIM K.Interaction between HSP 70 and iNOS in skeletal muscle injury and repair[J].J Exerc Rehabil,2015,11(5):240-243.
[17]丁海鹏,李相鹏,张伟,等.雷公藤红素药理作用分子靶点的研究进展[J].中国药理学与毒理学杂志,2012,26(4):570-576. DING H P,LI X P,ZHANG W,et al.Research progress in pharmacologic molecular targets of celastrol[J].Chinese Journal of Pharmacology and Toxicology,2012,26(4):570-576.
[18]王莹,陈浩杰,曹帆帆,等.雷公藤红素对非小细胞肺癌细胞株H1975的增殖抑制及其相关机制研究[J].中国现代医生,2016,54(32):33-36. WANG Y,CHEN H J,CAO F F,et al.Study on the inhibitory effect of celastrol on proliferation of non-small cell lung cancer cell line H1975 and its related mechanisms[J].China Modern Doctor,2016,54(32):33-36.
[19]张乙川,刘峰,王俊,等.雷公藤红素诱导人肝癌SMMC-7721细胞凋亡研究[J].中国普外基础与临床杂志,2016,23(1):48-51. ZHANG Y C,LIU F,WANG J,et al.Apoptosis of human hepatocellular carcinoma cell line SMMC-7721 induced by the celastrol[J].Chin J Bases Clin General Surg,2016,23(1):48-51.
[20]FORNER A,LLOVET J M,BRUIX J.Hepatocellular carcinoma[J].Lancet,2012,379(9822):1245-1255.
[21]GRELEWSKI P G,BAR J K.The role of p53 protein and MMP-2 tumor/stromal cells expression on progressive growth of ovarian neoplasms[J].Cancer Invest,2013,31(7):472- 479.
[22]刘强,张琼,木拉提·热夏提,等.趋化因子受体4在肾透明细胞癌组织中的表达及与预后的相关性研究[J].中国全科医学,2014,17(17):1976-1979.DOI:10.3969/j.issn.1007-9572.2014.17.013. LIU Q,ZHANG Q,MULATI·R X T,et al. Chemokine Receptor 4 Expression and Its Prognostic Significance in Renal Clear Cell Carcinoma Tissue[J].Chinese General Practice, 2014,17(17):1976-1979.DOI:10.3969/j.issn.1007-9572.2014.17.013.
[23]李波,宋永胜,张超,等.WNT 信号通路抑制因子-1和β连环蛋白在肾透明细胞癌中的表达及临床意义[J].疑难病杂志,2016,15(7):710-712.DOI:10.3969/j.issn.1671-6450.2016.07.013. LI B,SONG Y S,ZHANG C,et al. The expression and clinical significance of WIF-1 andβ-catenin in clear-cell renal cell carcinoma[J].Chinese Journal of Difficult and Complicated Cases, 2016,15(7):710-712.DOI:10.3969/j.issn.1671-6450.2016.07.013.
[24]YUEN M F,HOU J L,CHUTAPUTTI A,et al.Hepatocellular carcinoma in the Asia pacific region[J].J Gastroenterol Hepatol,2009,24(3):346-353.
(本文编辑:崔丽红)
Effect and Mechanism of Celastrol on the Renal Clear Cell Carcinoma 786-0 Cells
ZHANGXiao-lu1*,DUMei-hong2,ZHANGQuan1,CHENHong-yue2,ZHAOLin1,GUOWei-sheng2
1.DepartmentofGeneralSurgery,HenanProvinceHospitalofTCM,Zhengzhou450002,China2.DepartmentofRadiology,HenanProvinceHospitalofTCM,Zhengzhou450002,China
*Correspondingauthor:ZHANGXiao-lu,Attendingphysician;E-mail:xiaoisxiao@126.com
Background The incidence rate of renal clear cell carcinoma was high and the cure rate was low.Celastrol could regulate cytokines in tumor cells,then inhibit the proliferation of tumor cells.However,there were few studies on the effect of celastrol on the renal clear cell carcinoma 786-0 cells.Objective To explore the effect and mechanism of celastrol on the renal clear cell carcinoma 786-0 cells,in order to provide a reference for investigating drugs for the treatment of renal clear cell carcinoma.Methods From February 2015 to May 2016,renal clear cell carcinoma 786-0 cells and normal renal tubular epithelial cells HK2 cells(renal cells HK2 cells) were cultured.The survival rate of renal clear cell carcinoma 786-0 cells,renal cells HK2 cells were detected after treating with celastrol at different concentrations(0,0.5,1.0,1.5,2.0 μmol/L) for different time(12,24,48 h);cytotoxicity of renal clear cell carcinoma 786-0 cells,renal cells HK2 cells were detected after treating with celastrol at different concentrations(0,0.5,1.0,1.5,2.0 μmol/L),1.5 μmol/L 5-Fu;cell cycle,apoptosis rate of renal clear cell carcinoma 786-0 cells,renal cells HK2 cells were detected after treating with celastrol at different concentrations(0,1.5,2.0 μmol/L),1.5 μmol/L 5-Fu;mitochondrial membrane potential of renal clear cell carcinoma 786-0 cells,renal cells HK2 cells were measured after treating with celastrol at different concentrations(0,0.5,1.0,1.5 μmol/L);cysteine-containing aspartic proteolytic enzymes(caspase)-3,caspase-9 activity,the levels of Bax,B lymphocyte tumor-2(Bcl-2),cytochrome c and polyribosylribitol phosphate(PRRP) in the renal clear cell carcinoma 786-0 cells were detected after treating with celastrol at different concentrations(0,0.5,1.0,1.5,2.0 μmol/L).Results The survival rate of the renal cell carcinoma 786-0 cells decreased with the increase of concentration when treated with 0,0.5,1.0,1.5,2.0 μmol/L celastrol for 12,24,48 h(P<0.05).The survival rate of the renal cell carcinoma 786-0 cells treated with 1.0 μmol/L celastrol for 24,48 h were less than that for 12 h(P<0.05);the survival rate of the renal cell carcinoma 786-0 cells treated with 1.5,2.0 mumol/L celastrol for 12,24,48 h decreased with the increase of time(P<0.05).Cytotoxicity of renal clear cell carcinoma 786-0 cells,renal cells HK2 cells treated with 0.5 μmol/L,1.0 μmol/L,1.5 μmol/L,2.0 μmol/L celastrol and 1.5 μmol/L 5-Fu were larger than 0 μmol/L celastrol(P<0.05);cytotoxicity of renal clear cell carcinoma 786-0 cells treated with 2.0 μmol/L celastrol was larger than 0.5,1.0,1.5 μmol/L celastrol(P<0.05);cytotoxicity of renal cells HK2 cells treated with 2.0 μmol/L celastrol was larger than 1.0 μmol/L celastrol(P<0.05);cytotoxicity of renal cell carcinoma 786-0 cells and renal cells HK2 cells treated with 1.5 mmol/L 5-Fu was larger than 0.5,1.0,1.5,2.0 μmol/L celastrol(P<0.05).After treated with 0,1.5 mmol/L celastrol,the renal cell carcinoma 786-0 cells and renal cells HK2 cells at the G2/M phase were less than S,G0/G1phase(P<0.05);after treated with 2.0 umol/L celastrol,1.5 umol/L 5-Fu,renal clear cell carcinoma 786-0 cells,renal cells HK2 cells at G0/G1phase were more than S phase,while renal clear cell carcinoma 786-0 cells and renal cells HK2 cells at G2/M phase were less than S,G0/G1phase(P<0.05).Cell apoptosis rate of renal clear cell carcinoma 786-0 cells treated with 1.5 μmol/L,2.0 μmol/L celastrol and 1.5 μmol/L 5-Fu were larger than 0 μmol/L celastrol(P<0.05);cell apoptosis rate of renal clear cell carcinoma 786-0 cells treated with 2.0 μmol/L celastrol and 1.5 μmol/L 5-Fu were larger than 1.5 μmol/L celastrol(P<0.05);cell apoptosis rate of renal cells HK2 cells treated with 1.5 μmol/L 5-Fu were larger than 0 μmol/L,2.0 μmol/L celastrol(P<0.05).Mitochondrial potential of renal clear cell carcinoma 786-0 cells treated with 0,0.5,1.0,1.5 μmol/L celastrol increased in turn(P<0.05).caspase-3,caspase-9 activity of renal clear cell carcinoma 786-0 cells treated with 0,0.5,1.0,1.5 μmol/L celastrol increased in turn(P<0.05).The levels of Bax,cytochrome c,PRRP of renal clear cell carcinoma 786-0 cells treated with 0,0.5,1.0,1.5 μmol/L celastrol increased in turn,while the level of Bcl-2 decreased in turn(P<0.05).Conclusion Celastrol may inhibit the proliferation of renal clear cell carcinoma 786-0 cells and induce their apoptosis by activating caspase-3,caspase-9 activity,upregulating Bax,cytochrome c,PRRP levels and down-regulating Bcl-2 level.
Kidney neoplasms;Adenocarcinoma,clear cell;Celastrol;Cell proliferation;Apoptosis
河南省科技计划项目(142300410070)
R 737.11
A
10.3969/j.issn.1007-9572.2017.05.y14
2017-02-29;
2017-05-29)
1.450002 河南省郑州市,河南省中医院普外二科
2.450002 河南省郑州市,河南省中医院放射科
*通信作者:张小路,主治医师;E-mail:xiaoisxiao@126.com

