鸡源ADAR2基因克隆及其抗新城疫病毒作用研究
张耀丹,汪 伟,李继红,刘开春,孟春春,孙英杰,谭 磊,宋翠萍,廖 瑛,仇旭升,丁 铲
·研究论文·
鸡源ADAR2基因克隆及其抗新城疫病毒作用研究
张耀丹,汪 伟,李继红,刘开春,孟春春,孙英杰,谭 磊,宋翠萍,廖 瑛,仇旭升,丁 铲
目前对家禽中双链RNA特异性腺苷脱氨酶(adenosine deaminase acting on double-stranded RNA, ADAR)的种类、组织分布及其功能尚不明了。本研究中以刀豆素、poly I:C以及新城疫病毒(Newcastle disease virus,NDV)作为刺激物诱导鸡胚成纤维细胞(chicken embryo fibroblast,CEF)中ADARs基因上调,扩增获得鸡ADAR2基因的mRNA。为了鉴定ADAR2的抗病毒作用,本研究构建了能够偶联有绿色荧光蛋白(green fluorescent protein,GFP)的ADAR2重组真核表达质粒,转染DF1细胞,结果显示在过量表达ADAR2的细胞中,NDV的增殖受到了显著抑制,表明ADAR2在NDV感染过程中发挥重要的抗病毒作用,这为进一步研究鸡RNA编辑酶对NDV RNA编辑奠定了基础。
鸡双链RNA特异性腺苷脱氨酶基因;新城疫病毒;RNA编辑;抗病毒作用
双链R NA特异性腺昔脱氨酶(adenosine deaminase acting on double-stranded RNA,ADAR)基因家族广泛存在于从线虫到人的各种生物细胞中,因其所编码的RNA编辑酶可作用于特定双链RNA结构和mRNA前体,引起腺苷发生脱氨基变成肌苷(A→I)而得名,这一现象被命名为“RNA编辑”,最早在20世纪90年代初由Sommer等[1]在谷氨酸受体蛋白mRNA前体上发现。“RNA编辑”是一种不同于传统的蛋白翻译途径的独特的基因组的转录后修饰过程。宿主细胞在转录过程中通过RNA编辑酶可以对RNA进行加工,如插入、删除或取代一些核苷酸残基,产生不同于模板DNA的RNA,编码蛋白的同功异构体,从而大幅度增加编码蛋白质的多样性。目前,已经在哺乳动物中发现4个ADARs成员[2]:ADAR1、ADAR2、ADAR3及TENR(testis-expressed RNA-binding protein),其中ADAR1、2在中枢神经系统高表达;ADAR3催化活性不高,仅存在于脑部;TENR主要在睾丸内表达[3]。
RNA编辑酶是一种重要的病毒限制因子,能够有效地阻断病毒的感染[4]。在人类免疫缺陷病毒(HIV)的研究中,细胞APOBEC(apolipoprotein B mRNA-editing,catalytic polypeptide)类的RNA编辑酶可以诱发负链RNA发生胞嘧啶(C)→尿嘧啶(U)突变,导致病毒基因组翻译受阻,蛋白编码功能丧失或降低,从而在病毒复制的第一阶段就起到阻止病毒复制的作用[5]。最新报道指出,ADAR类的RNA编辑酶也可以诱导流感病毒和哺乳动物副黏病毒RNA的突变,发挥抗病毒作用[6]。尽管如此,禽类上是否存在RNA编辑酶,存在对宿主或病毒RNA的编辑作用尚未有相关报道。为了鉴定鸡ADAR类RNA编辑酶的存在及其机体内的分布,本研究在新城疫病毒(Newcastle disease virus, NDV)感染以及干扰素刺激药物处理的原代鸡胚成纤维细胞(chicken embryo fibroblast,CEF)中提取ADAR基因的mRNA,并对其组织分布和抗病毒作用开展了初步研究。
1 材料方法
1.1 材料
1.1.1 实验动物、菌种、质粒、细胞株与病毒等 SPF级雌性BALB/c小鼠及鸡成纤维细胞细胞系(DF1)购自美国模式菌种收集中心ATCC;NDV毒株为Herts/33及La Sota购自中国兽医药品监察所,本实验室保存。
1.1.2 实验试剂 Tirzol Reagents购自Invitrogen公司;凝胶回收试剂盒购自Qiagen公司;MLV Reverse Transcriptase和RNasin购自Promega公司;显影液定影液试剂盒购自碧云天生物技术研究所;限制性内切酶、dNTP、LA Taq购自TaKaRa公司;PCR Mix购自东盛生物公司;抗生素、琼脂粉、琼脂糖购自上海生工生物工程有限公司;红色荧光标签的山羊抗小鼠荧光二抗及Con-A购自SIGMA公司;Poly (I:C)(HMW)购自Invivogen公司。
1.2 方法
1.2.1 引物设计及合成 根据NCBI所预测的鸡ADAR2序列(序列号:NM_001111074),设计并合成ADAR2全长的特异性引物,预期扩增片段长约2020 bp。以质粒pCMV-HA为模板,上下游引物P1、P2中分别引入EcoR I和Sal I的酶切位点(下划线)及保护性碱基,由上海生工合成。HA-ADAR2-EcoR I-UP(上游引物):5'-GAAAGAATTCACATGGA CAACGTTCCCCCCAAGGATG-3';HA-ADAR2-Sal I-DOWN(下游引物):5'-GCAGGTCGACAA TTAGACAGTGAGTGAAAACTGATCCTGTTC-3' 1.2.2 ADAR 2基因扩增 取10日龄的 SPF 鸡胚,采用消化法制备 CEF 细胞。Trizol法收集的正常细胞和 L a Sota感染的细胞,提取RNA,并反转录成cDNA。以CEF cDNA为模板进行PCR,反应条件:94℃预变性3 min;94℃变性30s,55℃退火30 s;72℃延伸2 min 30 s,30个循环;72℃再延伸10 min,10 g/L琼脂糖凝胶电泳分析扩增产物。
1.2.3 ADAR 2真核表达质粒构建及测序 PCR产物经胶回收试剂盒纯化回收后,用EcoR I和Sal I双酶切,缓冲液使用通用BufferH;酶切产物经胶回收纯化后与同样用EcoR I和Sal I双酶切的pCMV-HA于4℃连接过夜,连接产物转化E. coli DH5α感受态细胞,LB(Amp+)固体培养基培养12~16 h。挑选阳性克隆经PCR及EcoR I和Sal I限制性内切酶双酶切鉴定后,将含正确插入片段的重组质粒命名为pCMVHA-ADAR2,送上海生物工程技术服务有限公司进行测序测定。pCMV-HA-ADAR2质粒经EcoR I和Sal I双酶切,与p EGFP-C3连接,将测序正确的阳性质粒命名为pEGFP-C3-ADAR2。
1.2.4 序列对比和遗传进化分析 通过DNA STARMegAlign软件将鸡ADAR2 ORF序列和其他几种动物(包括人、斑马鱼、绿头鸭等)序列进行比对,并绘制进化树。
1.2.5 ADAR 2 R eal-time PCR检测方法的建立及分析 根据A DA R2ORF序列设计几对RT-qPCR的引物A D A R 2-Q-U P(上游引物):5'AGTCAGCCCTGGCATCTTTGTT3';ADAR2-QDOWN(下游引物):5'CACTGAATTTATCTA CAACCAA3'。取高纯度的pEGFP-C3-ADAR2质粒(浓度508.7 ng/μ L)作为标准品,用超纯水做6个稀释度,分别为:103、104、105、106、107、108copies/μ L。Real-time PCR用SY BR Green I染料法进行测定。20μ L的反应体系:SY BR Green qPCR Master Mix 10μ L、上下游引物各1μ L、模板1μ L、蒸馏水8μ L。PCR反应程序:94℃预变性1 min:95℃变性15 s;60℃退火15 s 72 ℃45 s,40个循环;生成溶解曲线步骤:55℃30 s,每30 s升温0.5℃,81个循环。根据荧光值的变化规律,系统将自动生成标准曲线和溶解曲线。
1.2.6 NDV感染CEF对内源性ADAR 2表达的影响 将CEF细胞铺满6孔板,一组用3 MOI La Sota和Herts/33感染,37℃孵育30 min后换维持液,并在6 h和12 h时加入Trizol并收集样品。另外一组CEF用ConA和PolyI:C(HMW)刺激物处理,终浓度均为10μ g/ mL,37℃恒温培养1 h,用含2%FBS的DMEM维持培养,分别在6 h和12 h之后收样。细胞样品提取RNA并反转录后,采用RT-qPCR的方法检测ADAR2的含量。试验结果采用相对比较Ct法(Qr=2-△△Ct)分析,△△Ct=(Ct目的基因-Ct参照基因)实验组-(Ct目的基因-Ct参照基因)对照组,计算出相对含量。
1.2.7 ADAR 2多克隆抗体的制备
1.2.7.1 原核表达质粒的构建 pCMV-HA-ADAR2质粒经EcoR I和Sal I双酶切,与酶切之后的pET-28a质粒4℃连接过夜,连接产物转化E. coli DH5α感受态细胞,LB(Kan+)固体培养基培养12~16 h。挑菌,提质粒,将测序正确的阳性质粒命名为pET-28a-ADAR2。
1.2.7.2 ADAR2蛋白诱导表达及抗原制备 将pET-28a-ADAR2转化BL21感受态细胞,使用终浓度为0.1 mmol/L的IPTG进行诱导表达,表达的蛋白用WB鉴定并大量诱导表达。SDA-PAGE确定其在包涵体内表达,用8 mol/L尿素溶解包涵体后纯化蛋白,并进行蛋白定量,分装保存。
1.2.7.3 多克隆抗体的制备 取适量纯化的包涵体每2周免疫1次小鼠。三免之后,摘眼球采血制备ADAR2多抗血清。
1.2.8 重组蛋白pEGFP-C3-ADAR 2的Western blot鉴定及细胞亚定位 收集转染pEGFP-C3和pEGFP-C3-ADAR2的细胞加入适量的细胞裂解液,冰上裂解30 min。SDS-PAGE电泳之后,转印至硝酸纤维(NC)膜上,以5 %脱脂乳4℃封闭过夜。根据目的蛋白大小将NC膜分开,并用GFP商品化兔抗作为一抗,山羊抗兔 IgG-HRP为二抗,采用ECL增强显色试剂盒进行显影检测。
为确定ADAR2的细胞亚定位,检测了转染pEGFP-C3和pEGFP-C3-ADAR2的DF1细胞间接免疫反应。培养36 h后,于倒置荧光显微镜下观察转染后的荧光表达情况。所用一抗为上述制备的ADAR2鼠抗,二抗为红色荧光标签的山羊抗小鼠荧光二抗,室温染DAPI 5 min后洗净封片。
1.2.9 外源性ADAR 2转染细胞对NDV复制的影响
为了验证ADAR2能否在DF1中引发抗NDV效应,我们使用高纯度去内毒素的EGFP-C3-A DA R2质粒转染D F 1细胞,48 h后感染N D V毒株Herts/33,剂量为5 MOI。分别在6 h和12 h时间点收集细胞,采用T rizol提取法提取R NA,进行反转录。引物参照文献[7],Pla-rt13:5'-CAACAATAGGAGTGGAGTGTCTGA-3';Plart14:5'-CAGGGTATCGGTGATGTCTTCT-3'。通过RT-qPCR的方法检测样品,标准曲线公式为y= -3.2901x + 38.922(y指循环数Ct,x指拷贝值以10为底的对数值)
2 结果
2.1 PCR扩增 电泳结果显示,正常CEF细胞样品PCR扩增后未见有明显目的条带,而La Sota刺激的CEF细胞样品PCR扩增后电泳,可见一条较亮的约2100 bp的条带,与预期片段大小相符(图1),并且测序结果与目的序列一致。
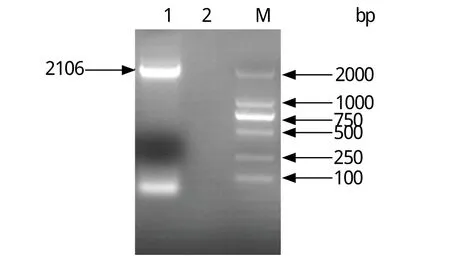
图1 鸡ADAR2基因的PCR扩增Fig.1 PCR-amplified ADAR2 gene from CEF cDNAM: DNA分子量标准(DL2000); 1: La Sota株作用的CEF细胞; 2: 正常的CEF细胞M: DNA Marker(DL2000); 1: PCR products of CEF infected with La Sota strain; 2: PCR products of CEF as control
2.2 ADAR2基因序列分析 通过DNAStar-MegAlign软件将鸡ADAR2序列与其他几种动物序列进行同源性比对。鸡ADAR2与人、鼠、河豚鱼、斑马鱼和枪乌贼ADAR2核苷酸序列同源性分别为78.3%、76.3%、71.9%、70.2%和62.0%;氨基酸序列同源性分别是83.9%、82.9%、81.0%、76.2%和62.2%。各物种ADAR2的基因序列的遗传进化关系如图2所示。通过对氨基酸序列的生物信息学分析,鸡ADAR2蛋白存在两段双链RNA结合区,分别位于第80~142位和第237~298位,与其他物种的差异较小,而介导腺苷脱氨基的活性功能区位于323~698位(图3、图4)。用于本次实验分析的其他动物ADAR2的GenBank登录号见表1。
2.3 ADAR2-Q-PCR的引物优化 标准曲线和熔点曲线等有荧光定量机器自动生成,结果见图5;质粒pEGFP-C3-ADAR2的浓度换算成拷贝值(质粒浓度×6.022×1023)(质粒总碱基数×109×660)。线性回归方程y=-3.283x+38.032(R2=0.993),扩增效率为101.6%。
2.4 NDV刺激CEF上调表达 采用相对比较Ct法(Qr=2-△△Ct)分析,△△Ct=(Ct目的基因-Ct参照基因)实验组-(Ct目的基因-Ct参照基因)对照组,计算出相对含量。经RT-PCR绝对定量的方法计算可知单位正常CEF细胞中ADAR2基因的拷贝数约为0.8。3 MOI的La Sota和Herts/33感染CEF细胞6 h和12 h之后,ADAR2的含量出现1~3倍不等的上调,如图6所示,可见ADAR2蛋白是受NDV的刺激上调表达的。另外CEF细胞在受Con-A作用6 h和12 h小时后的ADAR2表达含量均增加了5倍左右(P<0.01);PolyI:C(HMW)可以促使ADAR2也可以上调表达约3倍和5倍(P<0.01)。
2.5 EGFP-C3-ADAR2重组蛋白的Western blot鉴定和亚定位 图7可见清晰地ADAR2重组蛋白110 kDa大小的条带,符合EGFP-C3-ADAR2重组蛋白的大小。推测图中55 kDa大小的条带是ADAR2降解的蛋白片段。间接免疫荧光结果显示,pEGFP空质粒转染后整个细胞区域发出绿色荧光,而在转染EGFPC3-ADAR2的细胞中可观察到特异性绿色荧光,并且与DAPI荧光重合(图8);ADAR2鼠抗的红色荧光与EGFP-C3-ADAR2绿色荧光重叠,说明ADAR2鼠抗具有荧光效价,更进一步证实了ADAR2只在细胞核内表达。
2.6 过表达ADAR2对NDV复制的影响 根据所得Ct值绝对定量换算结果可知,转染pEGFP-C3-ADAR2的细胞中NP含量明显低于非转染组和转染空质粒组,差异均具备显著统计学意义(P<0.01),实时荧光定量的结果见图9,证实ADAR2过量表达可以抑制NDV的增殖。
3 讨论
“RNA编辑”现象在宿主抗病毒免疫过程以及病毒进化中的作用是目前RNA病毒研究的热点问题,正在引起越来越多研究学者的关注[4]。哺乳动物ADARs蛋白家族成员有ADAR1、ADAR2、ADAR3 及TENR四种,其中ADAR1、ADAR2的RNA编辑活性最强。家禽是否表达ADAR1和ADAR2基因,以及这两种蛋白是否正常表达尚不明了。
据报道,ADAR1和ADAR2属于干扰素刺激基因(ISGs)[8],其启动子序列与PKR基因启动子的I型干扰素刺激反应元件相同[9]。本研究尝试以刀豆素、Poly I:C以及NDV病毒作为刺激物诱导CEF细胞中ADARs基因的上调,并根据鸡的全基因组测序和生物信息分析结果设计引物扩增了鸡ADAR2基因的mRNA(未扩增到ADAR1基因)。在此基础上,我们建立了鸡ADAR2的Real-time PCR检测方法。对鸡各个脏器的检测结果可见,ADAR2是健康鸡体内正常表达的一种基因,主要存在于心脏、肝脏、肾脏、肺脏、脑、胸腺、法氏囊、气囊等组织脏器中,并且在肺脏和法氏囊中表达量最高。

表1 本研究中各动物ADAR2序列及其登录号Table 1 ADAR2 sequences used and their GenBank accession numbers
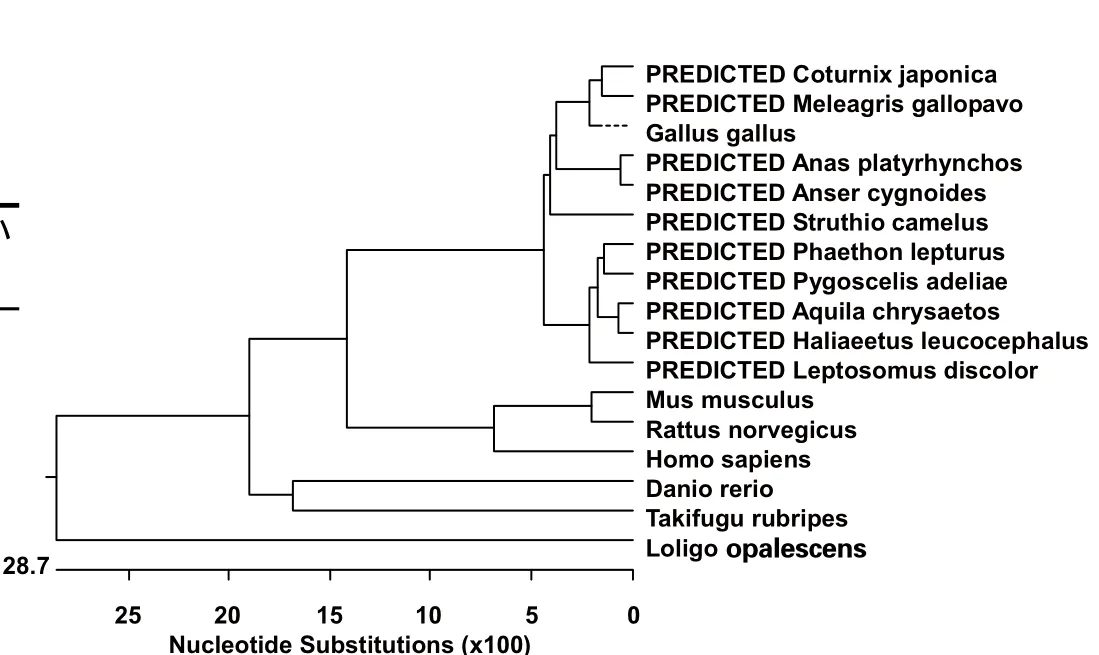
图2 ADAR2基因进化树分析Fig.2 Phylogenetic tree of ADAR2 gene
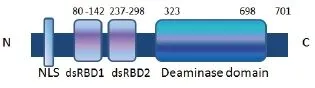
图3 鸡ADAR2氨基酸结构示意图Fig.3 Amino acid structure of chicken ADAR2

图4 鸡与6个物种 ADAR2功能区序列对位排列分析Fig.4 Alignment of amino acidsequences of encoding region of ADAR2 gene between chicken and 6 other speciesa:结合区1; b:结合区2; c:催化区a: dsRBD1; b: dsRBD2; c: Deaminase domain

图5 Real-time PCR引物的优化和标准曲线的建立Fig.5 Optimization of the primers and standard curve for Real-time PCRA: 标准曲线; B: 熔点峰A: Standard curve; B: Melt peak

图6 NDV和药物作用刺激ADAR2上调表达Fig.6 Higher expression of ADAR2 in response to NDV and pharmacological stimuli
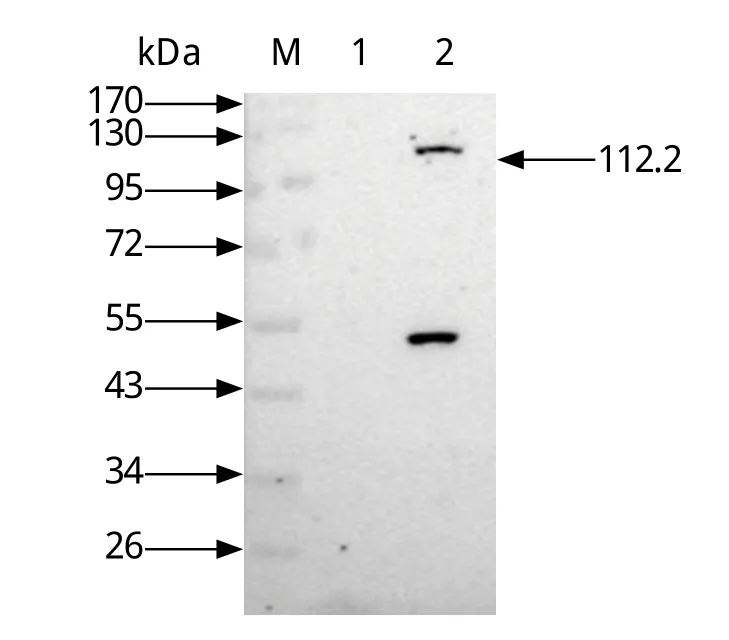
图7 Western blot鉴定EGFP-C3-ADAR2蛋白的表达Fig.7 Western blot analysis of EGFPC3-ADAR2 proteinM: 蛋白质分子量标准; 1: DF1细胞对照; 2: pEGFP-C3-ADAR2重组质粒转染DF1细胞M: Protein Marker; 1: DF1 cell control ; 2: Transient expression of pEGFP-C3-ADAR2
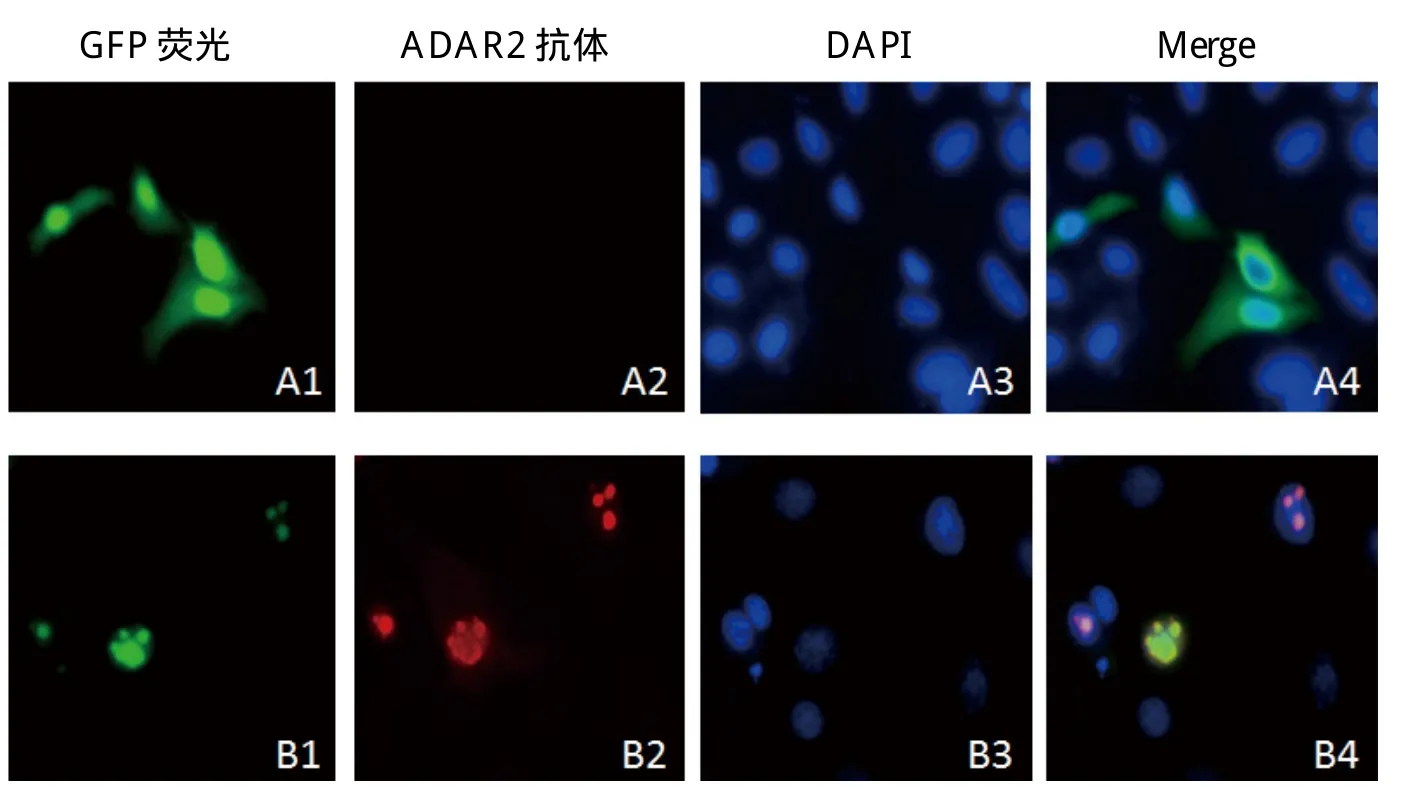
图8 间接免疫荧光检测ADAR2基因在Hela细胞中的表达Fig.8 Expresssion of ADAR2 gene in Hela cells detected by the indirect immunoflurescenceA1~A4: 转染pEGFP-C3的Hela; B1~B4: 转染pEGFP-C3-ADAR2的HelaA1~A4: Hela transfected with pEGFP-C3; B1~B4: Hela transfected with pEGFP-C3-ADAR2
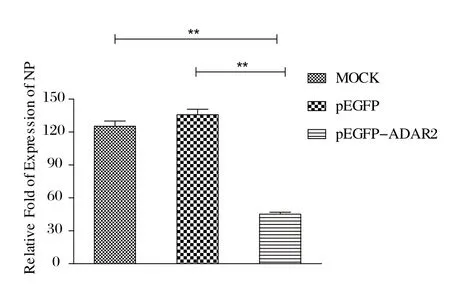
图9 DF1细胞感染NDV的NP含量的比较Fig.9 Qualification of NP in DF1 cells infected with NDV
通过序列比对分析,鸡源与人源、鼠源ADAR2的氨基酸同源性较高,达到83.9%,尤其3个主要的功能区,即2个RNA结合区位和1个腺苷脱氨基活性功能区,仅存在极少的氨基酸差异,由此可以初步推断,鸡源ADAR2具有与人源ADAR2类似的RNA编辑功能。
有报道指出,ADARs的RNA编辑活性对不同病毒的感染存在两种截然相反的效果,既可能是促进病毒增殖的作用,也可能存在抑制病毒增殖。在丁型肝炎病毒(Hepatitis D virus,HDV)的研究中,ADAR1和ADAR2同样显示出了显著的抗病毒效果。在HDV复制过程中产生两种形式的抗原:HDAg-S 和HDAg-L。前者是病毒复制所必需的,后者抑制病毒复制,但为病毒粒子包装所必需[10]。Casey等[11]证实了后者的产生正是由于ADAR1编辑了HDV反向基因组amber/W处的腺苷,使其脱氨基变成肌苷,导致氨基酸序列中终止子变成色氨酸密码子,并使该阅读框延长。Jayan和Casey[12]通过将ADAR1 和ADAR2转染Huh7细胞,发现二者显著增加HDV RNA的编辑,从而明显抑制了HDV RNA的复制。而在HIV-1研究中,ADAR1和ADAR2的RNA编辑作用可以促进病毒增殖的作用,大量表达后可以刺激病毒的释放和病毒粒子的感染性[13]。Doria等[14]指出ADAR2的过量表达不但不会不抑制HIV-I的增殖,甚至细胞中敲除ADAR2后能够显著抑制病毒的增殖。
我们的研究显示,刀豆素和PolyI:C刺激能够引起ADAR2的显著上调。同样,NDV感染能够引起ADAR2的上调,这一结果与前期的报道一致[13]。为了确定ADAR2蛋白对NDV感染的影响,我们构建了能够正常表达偶联有绿色荧光蛋白的重组ADAR2蛋白的真核表达质粒并转染DF1细胞。根据间接免疫荧光和Western blot检测结果,在转染细胞中,外源鸡ADAR2-GFP重组蛋白可以大量表达,并集中在细胞核中,这与哺乳动物ADAR2的亚细胞定位一致。在过量表达ADAR2的细胞中,NDV的生长受到了显著的抑制,这表明ADAR2在NDV感染过程中主要发挥抗病毒作用,暗示ADAR2的RNA编辑作用可能对病毒的RNA造成了损伤。Susp è ne等[6]通过3DIPCR技术发现,ADARs蛋白能够引起季节性流感和麻疹病毒基因组发生A→G突变,突变成规律性,以5 ArA和5 UrA为主,这一结果证明了ADAR蛋白确实能够引起副黏病毒基因组发生RNA编辑。因此,可以推测,在ADAR2高表达细胞中,NDV的增殖受到显著抑制是受到了ADAR2对病毒RNA直接攻击。
本研究首次在鸡体内鉴定了ADAR2基因的表达,证实其有抑制NDV增殖的作用,其抗病毒的作用机制则需要进一步的研究来揭示。
[1] Sommer B, Kohler M, Sprengel R, et al. RNA editing in brain controls a determinant of ion flow in glutamate -gated channels[J]. Cell, 1991, 67(1): 11-19.
[2] Savva Y A, Rieder L E, Reenan R A. The ADAR protein family[J]. Genome Bio, 2012, 13(12): 252.
[3] 何安邦, 汪翔, 张蒙, 等. RNA编辑在肿瘤中的研究进展[J]. 生命科学, 2015, 27(7): 928-935.
[4] Lauring A S, Andino R. Quasispecies theory and the behavior of RNA viruses[J]. PLoS Pathog, 2010, 6(7): e1001005.
[5] Stopak K C, de Noronha C, Y onemoto W, et al. Greene. HIV-1 Vif blocks the antiviral activity of APOBEC3G by impairing both its translation and intracellular stability[J]. Mol Cell, 2003, 12(4): 591-601.
[6] Suspene R, Petit V, Puyraimond-Zemmour, et al. Double-stranded RNA adenosine deaminase ADAR-1-induced hypermutated genomes among inactivated seasonal influenza and live attenuated measles virus vaccines[J]. Virol, 2011, 85(5): 2458-2462.
[7] Qiu X, Y u Y, Y u S, et al. Development of strand-specific real-time RT-PCR to distinguish viral RNAs during Newcastle disease virus infection[J]. Scientific World J, 2014, 2014(9): 185-194.
[8] Samuel C E. Adenosine deaminases acting on RNA (ADARs) are both antiviral and proviral[J]. Virology, 2011, 411(2): 180-193.
[9] George C X, Das S, Samuel C E. Organization of the mouse RNA-specific adenosine deaminase Adar1 gene 5'-region and demonstration of STAT1-independent, ST A T 2-dependent transcriptional activation by interferon[J]. Virology, 2008, 380(2): 338-343.
[10] 郑玉姝, 赵朴, 刘兴友. RNA编辑功能的研究进展[J]. 生命科学, 2008, 20(3): 454-457.
[11] Casey J L. RNA editing in hepatitis delta virus[J]. Curr Top Microbiol Immunol, 2006, 307: 67-89.
[12] Jayan G C, Casey J L. Increased RNA editing and inhibition of hepatitis delta virus replication by highlevel expression of ADAR1 and ADAR2[J]. J Virol, 2002, 76(8): 3819-27.
[13] Qiu X, Q Fu, Meng C, et al. Newcastle disease virus V protein targets phosphorylated STAT1 to block IFN-I signaling[J]. PLoS One, 2016, 11(2): e0148560.
[14] Doria M, Tomaselli S, Neri F, et al. ADAR2 editing enzyme is a novel human immunodeficiency virus-1 proviral factor[J]. J Gen Virol, 2011, 92(Pt 5): 1228-1232.
IDENTIFICATION OF CHICKEN ADENOSINE ACTING ON RNA (ADAR2) AND ITS ANTI-VIRAL EFFECT ON NEWCASTLE DISEASE VIRUS
ZHANG Yao-dan, WANG Wei, LI Ji-hong, LIU Kai-chun, MENG Chun-chun, SUN Ying-jie, TAN Lei, SONG Cui-ping, LIAO Ying, QIU Xu-sheng, DING Chan
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
The type, tissue distribution and function of avian adenosine deaminase acting on double-stranded RNA (ADAR) have not been well characterized although recently it has been extensively studied for its roles in antiviral effect and virus evolution. In this study, ADAR2 mRNA was amplified from primary CEF cells previously stimulated with ConA, poly I:C and Newcastle disease virus (NDV). The eukaryotic plasmid expressing green fluorescent protein (GFP)-labeled ADAR2 was constructed to determine the antiviral effect of ADAR2. In the transfected DF1 cells, the GFP-labeled ADAR2 was visualized in cellular nuclei and growth of NDV was obviously inhibited, suggesting chicken ADAR2 might play a role in the anti-NDV activity. However, the detailed mechanism of ADAR2 mediated anti-NDV effect need to be carried out in the future.
ADAR2 gene; Newcastle disease virus; RNA editing;antiviral effect
S852.659.5
A
1674-6422(2017)02-0035-08
2016-11-04
公益性行业(农业)科研专项经费(201303033);国家自然科学基金(31101822,31530074)
张耀丹,女,硕士研究生,预防兽医学专业
丁铲,E-mail:shoveldeen@shvri.ac.cn;仇旭升,E-mail:xsqiu1981@shvri.ac.cn
(中国农业科学院上海兽医研究所,上海200241)

