应用Cre/loxp系统构建含有BAC序列的重组伪狂犬病毒
王 涛,童 武,叶 超,于之清,梁 超,李国新,高 飞,单同领,于 海,郑 浩,童光志
(中国农业科学院上海兽医研究所,上海 200241)
·研究论文·
应用Cre/loxp系统构建含有BAC序列的重组伪狂犬病毒
王 涛,童 武,叶 超,于之清,梁 超,李国新,高 飞,单同领,于 海,郑 浩,童光志
(中国农业科学院上海兽医研究所,上海 200241)
近年来我国出现伪狂犬病毒变异株,导致猪伪狂犬病重新爆发流行。为研究伪狂犬病毒变异株毒力增强与抗原变异的分子机制,需要建立该病毒的感染性克隆操作系统。本研究通过构建转移载体pTEGGF,利用同源重组将含有增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)表达框及两翼各一个loxp位点,插入到伪狂犬病毒变异株PRV JS-2012 gG编码区下游,获得重组病毒rJS2012-gG/EGFP。将表达Cre重组酶的质粒pcDNA3.1-Cre转染BHK-21细胞,再感染rJS2012-gG/ EGFP,筛选获得含有单一loxp位点的重组病毒rJS2012-gG/loxp。将rJS2012-gG/loxp基因组、含有EGFP标记基因的BAC载体pBeloBAC11-EGFP和pcDNA3.1-cre共转染BHK-21,获得含有BAC序列插入的重组病毒rJS2012-BAC。一步生长曲线与空斑试验显示,重组病毒rJS2012-BAC在体外生长略慢于亲本病毒。本研究成功构建了含有BAC载体的重组伪狂犬病毒,为进一步建立伪狂犬病毒变异株的感染性克隆操作系统,开展变异株的分子病原学研究打下良好基础。
伪狂犬病毒变异株;细菌人工染色体;Cre/loxp系统
伪狂犬病(pseudorabies,PR)是由伪狂犬病毒(Pseudo rabies virus,PRV)感染多种家畜与野生动物后出现以发热、奇痒、呼吸和神经系统症状为特征的急性传染病[1]。PR曾在世界范围内广泛传播,只有部分欧美国家宣布在家猪中根除了该病,但在野猪中仍有流行[2]。多年来,通过免疫接种,PR在我国得到了有效控制。然而自2011年底以来,中国数十省相继爆发PR并呈流行扩大趋势。研究表明,我国出现了伪狂犬病毒变异株,导致猪伪狂犬病重新爆发流行。与经典毒株相比,变异株抗原性存在差异,毒力明显增强,基因序列存在不同程度改变,现有疫苗不能提供有效保护[3-6]。
疱疹病毒细菌人工染色体(bacterial artificial chromosome,BAC)技术是将BAC载体插入疱疹病毒基因组中,提取病毒复制过程中的环状基因组电转化入大肠杆菌DH10B中,筛选出包含病毒全基因组的阳性克隆[7]。利用该技术既可以使疱疹病毒在大肠杆菌中稳定的增殖、保存,也可以在细菌中对其基因组任意基因进行缺失、替换、突变等遗传操作[8]。BAC突变技术已经成为疱疹病毒分子病原学研究的重要工具[9]。Cre/loxp系统由Cre重组酶和loxp位点两部分组成,在Cre重组酶的作用下可以将设定的DNA片段删除、倒位、以及定点整合[10]。由于该系统作用方式简单高效,被广泛应用在删除特定基因、外源基因整合、动植物体内外DNA重组等领域,已成为体内外遗传操作新的有力工具[10]。
本研究以我国目前流行的PRV变异株为研究对象[11],利用Cre/loxp位置特异性重组系统,将BAC载体序列重组入变异株JS-2012中,为构建变异株感染性克隆操作系统奠定了基础,为进一步研究变异株抗原变异、毒力增强的分子机制提供技术支持。
1 材料和方法
1.1 病毒和细胞 伪狂犬病毒变异株PRV JS-2012为中国农业科学院上海兽医研究所猪病研究室(以下简称本实验室)分离鉴定并保存[11];BHK-21细胞、Vero细胞均为本实验室保存。
1.2 质粒和菌株 pBeloBAC11载体与大肠杆菌DH10B由中国农业科学院哈尔滨兽医研究所王云峰研究员惠赠;pcDNA3.1-Cre购自和元生物技术(上海)股份有限公司;pEGFP-N1、pEGFP-C3购自Clontech公司;pMD18-T、大肠杆菌DH5α购自TaK aRa公司。
1.3 工具酶和主要试剂 限制性内切酶和T4 DNA L igase购自NEB公司;FuGENE 6转染试剂购自Promega公司;胎牛血清(fetal bovine serum, FBS)和DMEM购自Gibco公司;质粒小提试剂盒购自QIAGEN公司;质粒中提试剂盒购自Macherey-Nagel公司;凝胶回收试剂盒购自广州东盛生物科技有限公司;PCR 试剂购自TaKaRa 公司。
1.4 引物设计 根据已发表的PRV JS-2012基因组序列(GenBank登录号:KP257591.1),按照US4 (gG)至US6(gD)基因区间序列,设计2对扩增左右同源臂引物:PgGF/PgGR、PDgGF/PDgGR;根据pEGFP-C3载体序列设计扩增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)表达盒的引物pEGFPF/pEGFPR;根据PRV JS-2012 gG基因序列设计loxp插入测序检测引物gLoxF/gLoxR。引物均由 Invitrogen上海公司合成,序列见表1。
1.5 转移载体构建
1.5.1 转移载体pT EGGF构建 首先使用X ho I和BamH I酶切pEGFP-C3,并用T4 DNA polymerase补平,胶回收大片段并以T4 DNA Ligase连接,获得了删除X ho I至BamH I间多克隆位点序列的质粒PEGFP-C3D。以PRV JS-2012基因组为模板,使用引物PgGF/PgGR和PDgGF/PDgGR分别扩增左右侧同源臂,并将扩增产物连接入pMD18-T,获得重组质粒pGL-ARM 和pGR-ARM。利用Sac I和Ase I酶切pGL-ARM、Ase I和Xba I酶切pEGFP-C3D,回收小片段,以T4 DNA Ligase连接入经Sac I和Xba I酶切的pBlueScript SK(+),获得重组质粒pLARM-EGFP。以Afl II和EcoR I分别酶切pGR-ARM和pEGFP-N1,将从pEGFP-N1切下的polyA片段连接入pGRARM,获得重组质粒pRARM-PA。以Xho I和Xba I酶切pRARM-PA,回收小片段,以T4 DNA Ligase连入经相同酶酶切的pLARM-EGFP,获得了转移载体pTEGGF。
1.5.2 转移载体pBeloBAC11-EGFP构建 以pEGFP-C3D为模板使用引物pEGFPF/pEGFPR扩增EGFP表达盒,回收目的条带。以BamH I和Hind III分别酶切PCR条带和pBeloBAC11,并以T4 DNA Ligase将EGFP表达盒与pBeloBAC11连接。连接产物转化DH5α,以BamH I和Hind III酶切筛选阳性克隆,获得转移载体pBeloBAC11-EGFP。
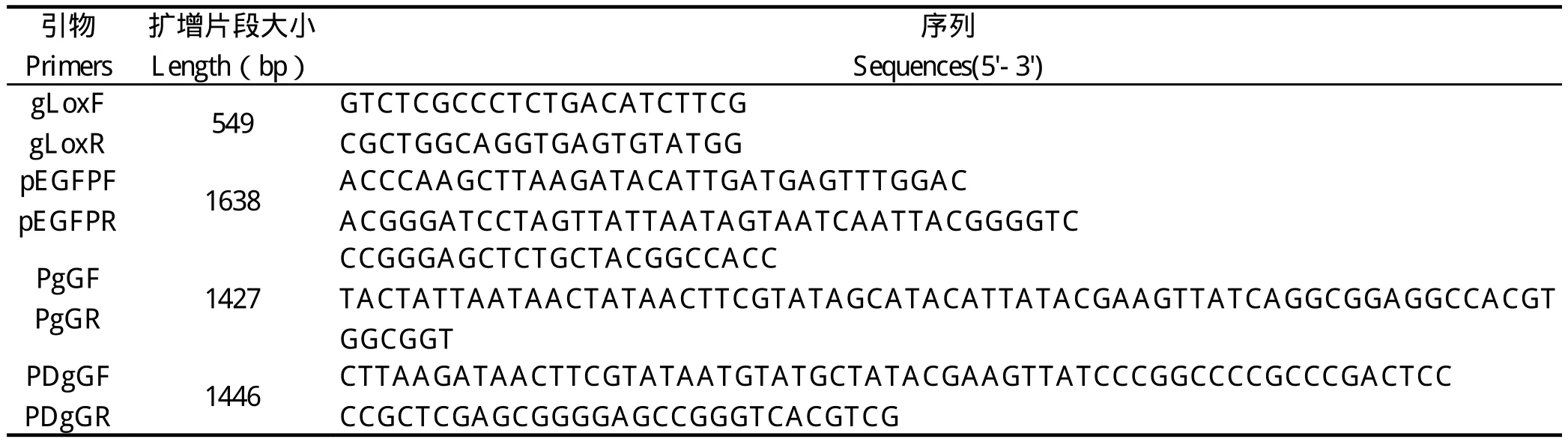
表 1 本研究所用到的引物Table 1 Primers used in this study
1.6 重组病毒构建
1.6.1 重组病毒rJS2012-gG/EGFP的构建 将PRV JS-2012接种BHK-21细胞,待70%病变时刮取细胞。使用酚/氯仿抽提法提取PRV JS-2012基因组并测其浓度,使用FuGENE 6转染试剂将2μ g PRV JS-2012基因组与1μ g pTEGGF 质粒共转染BHK-21细胞。待细胞病变达到60%时,收上清进行空斑纯化。挑取有绿色荧光的单个病毒空斑,获得含有EGFP和2个loxp位点插入的重组病毒(图1b),命名为rJS2012-gG/EGFP。
1.6.2 重组病毒rJS2012-gG/loxp的构建 利用FuGENE 6将2μ g表达Cre重组酶的质粒pcDNA3.1-Cre转染BHK-21细胞。转染10 h后,以0.01 MOI重组病毒rJS2012-gG/EGFP进行感染。待出现70%细胞病变,收上清进行空斑纯化。挑取没有绿色荧光的单个病毒空斑,获得不表达EGFP的重组病毒,命名为rJS2012-gG/loxp(图1c)。利用引物gLoxF/gLoxR检测重组病毒是否删除EGFP及一个loxp位点。
1.6.3 重组病毒rJS2012-BAC的构建 使用FuGENE 6转染试剂将2μ g pBeloBA C11-E GFP、1μ g pcDNA3.1-cre、1μ g rJS2012-gG/loxp基因组共转染BHK-21细胞,待出现70%细胞病变时,收上清进行空斑纯化。挑取有绿色荧光的单个病毒空斑,进行纯化获得BAC载体插入的重组病毒,命名为rJS2012-BAC(图1d)。图1表示重组病毒构建过程。
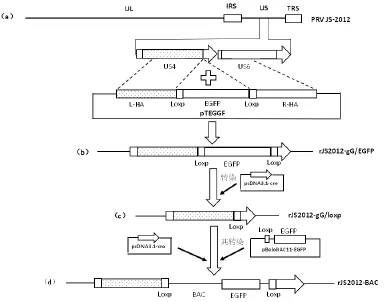
图1 重组病毒构建过程示意图Fig.1 Schematic diagram of the steps for constructing the recombinant virus
1.7 重组病毒一步生长曲线 以1MOI的rJS2012-gG/ EGFP、rJS2012-gG/loxp、rJS2012-BAC与亲本毒PRV JS-2012分别接种T25中的Vero细胞,37℃孵育1 h后,DMEM洗2遍,加入5 mL含2% FBS的DMEM。分别于接种后4、8、12、16、20、24、28、32、36、40 h取培养上清500μ L,并补加500μ L含2%FBS的DMEM。将不同时间点的病毒10倍梯度稀释成10-1至10-9的稀释度,并接种到生长于96孔细胞培养板中的单层Vero细胞,每个稀释度接8
孔。接种细胞培养4 d后,观察每孔的细胞病变,按照 Reed-Muench 法计算病毒TCID50,利用GraphPad软件绘制病毒一步生长曲线。
1.8 重组病毒空斑实验 将重组病毒rJS2012-gG/ EGFP、rJS2012-gG/loxp、rJS2012-BAC与亲本毒PRV JS-2012分别使用DMEM培养基稀释后,接种Vero细胞,孵育1 h后,弃去病毒液,PBS洗2次,每孔加入3 mL含有1%低熔点琼脂糖和2% FBS的覆盖培养基。室温凝固后,于37℃、5% CO2中倒置培养3 d后,用5%的结晶紫染色即可观察空斑大小。
2 结果
2.1 转移载体构建及鉴定 提取转移载体pBeloBAC11 -EGFP 和pTEGGF 的质粒,1%琼脂糖凝胶电泳结果如图2。测序结果显示,2个转移载体与预期一致。以FuGENE 6将2 μ g pBeloBAC11-EGFP 和pTEGGF分别转染BHK-21细胞,转染24 h后观察,均有绿色荧光产生(图3)。
图2 转移载体琼脂糖凝胶电泳结果
Fig.2 Identification of transfer plasmids by agarose gel electrophoresis
1:转移载体pBeloBAC11-EGFP; 2: 转移载体pTEGGF; M: DNA分子量标准(DL15000)
1: Transfer vector pBeloBAC11-EGFP; 2: Transfer vector pTEGGF; M: DNA Marker (15000)
2.2 重组病毒筛选及纯化 将PRV JS-2012基因组与转移载体pTEGGFF 共转染BHK-21细胞,产生的病毒经过连续5轮挑取表达绿色荧光的单个空斑进行纯化,获得重组病毒rJS2012-gG/EGFP。将rJS2012-
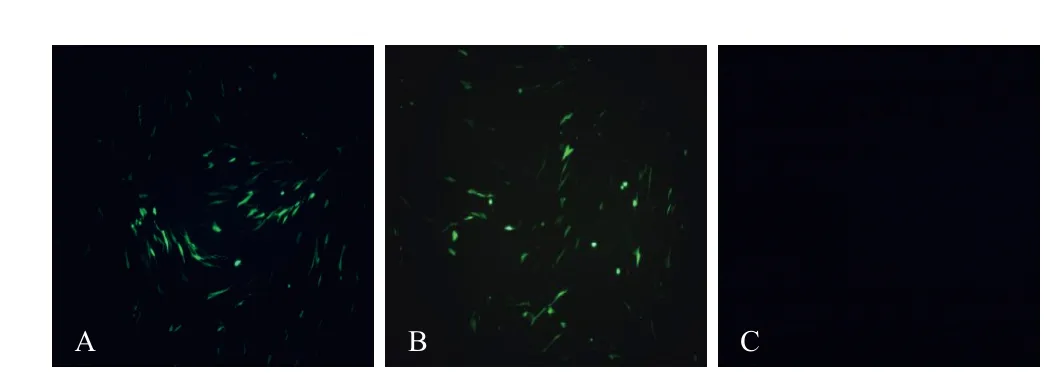
图3 转移载体转染BHK-21细胞Fig.3 Transfection results of the transfer plasmids in BHK-21 cellsA: 转移载体pTEGGF; B: 转移载体pBeloBAC11-EGFP; C: 阴性对照A: Transfer vector pTEGGF; B: Transfer vector pBeloBAC11-EGFP; C: Negative control
gG/EGFP接种转染表达Cre重组酶质粒的BHK-21细胞,收获的病毒经过连续4轮挑取无绿色荧光的单个空斑进行纯化,获得了重组病毒rJS2012-gG/loxp。以gLoxF/gLoxR为引物(表1)进行PCR检测,扩增的片段测序分析显示,在rJS2012-gG/loxp基因组中,loxP位于gG基因终止密码子下游(图4),与预期一致。将pcDNA3.1-Cre、pBeloBAC11-EGFP和重组病毒rJS2012-gG/loxp共转染,挑取有绿色荧光的单个空斑传代纯化,经过6轮纯化获得重组病毒rJS2012-BAC。各重组病毒在Vero细胞中的荧光表达如图5所示。
2.3 重组病毒一步生长曲线 将重组病毒rJS2012-gG/ EGFP、rJS2012-gG/loxp 和rJS2012-BAC与亲本毒PRV JS-2012接种Vero细胞,测定不同时间点的病毒滴度绘制的一步生长曲线如图6。结果显示,感染早期,rJS2012-gG/EGFP与PRV JS-2012滴度相近,rJS2012-gG/loxp与rJS2012-BAC滴度相近,但rJS2012-gG/EGFP与PRV JS-2012的滴度高于rJS2012-gG/loxp与rJS2012-BAC的滴度。从12 h开始3个重组病毒的滴度接近,复制速度差异不明显。重组病毒的复制速度虽略微低于亲本毒,但与亲本毒一致均在32 h时达到最高滴度,且滴度接近。随后所有病毒滴度均开始下降,但亲本毒略高于重组病毒。
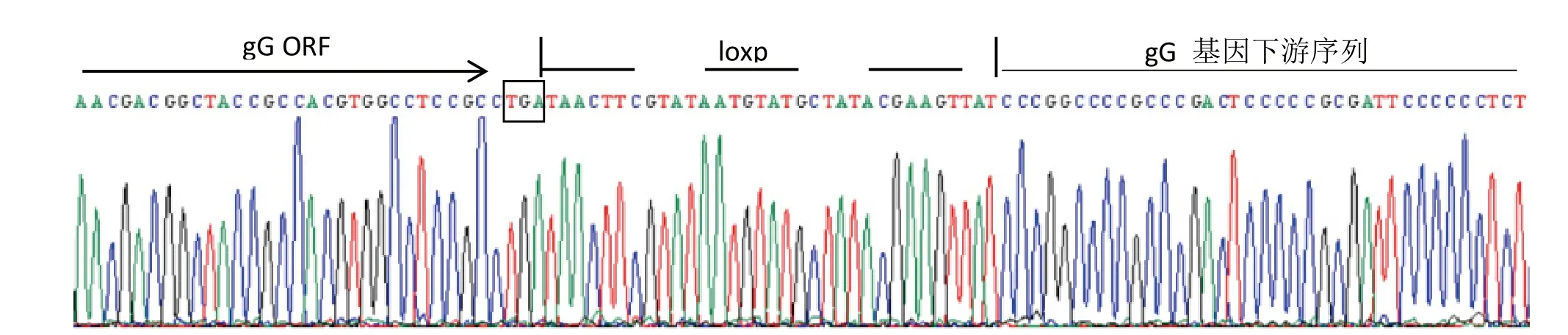
图4 loxp位点检测结果Fig.4 The sequencing results of loxp site
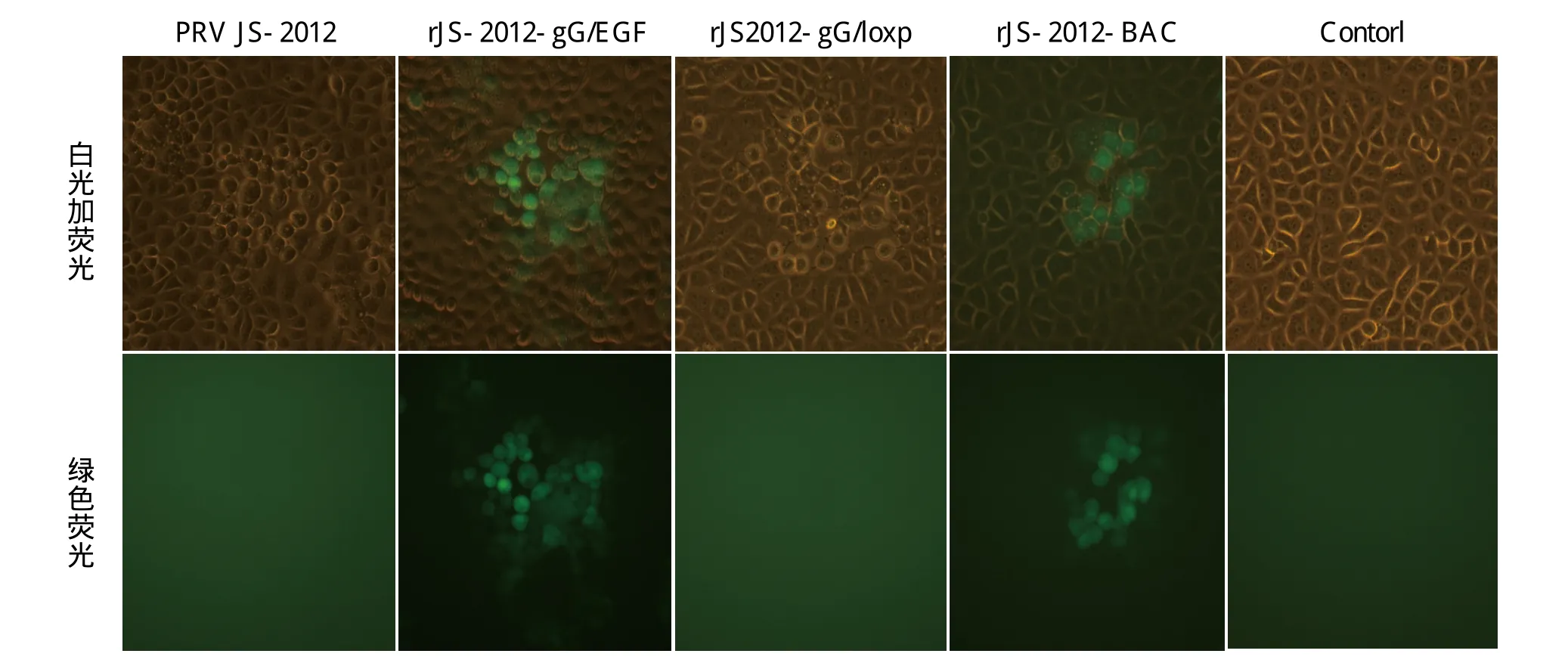
图5 重组病毒及亲本毒感染Vero细胞荧光表达结果Fig. 5 Fluorescent expression of recombinant viruses in Vero cells infected with recombinant virus and parental virus PRV JS-2012

图6 重组病毒与亲本毒一步生长曲线Fig.6 Single-step growth curves of the recombinant viruses and parental virus PRV JS-2012 in Vero cell
2.4 重组病毒空斑大小和形态 将重组病毒rJS2012-gG/EGFP、rJS2012-gG/loxp、rJS2012-BAC与亲本毒PRV JS-2012感染V ero细胞,加1%琼脂层培养60 h后,以结晶紫进行染色。重组病毒与亲本毒空斑形态如图7,rJS2012-gG/EGFP和rJS2012-gG/loxp空斑大小相似, 与亲本毒PRV JS-2012相比,略小于亲本毒,而rJS2012-BAC空斑则更小。这表明gG编码框下游插入序列,对重组病毒在细胞间扩散存在影响,而长序列,如BAC载体序列,的插入影响更为明显。
3 讨论
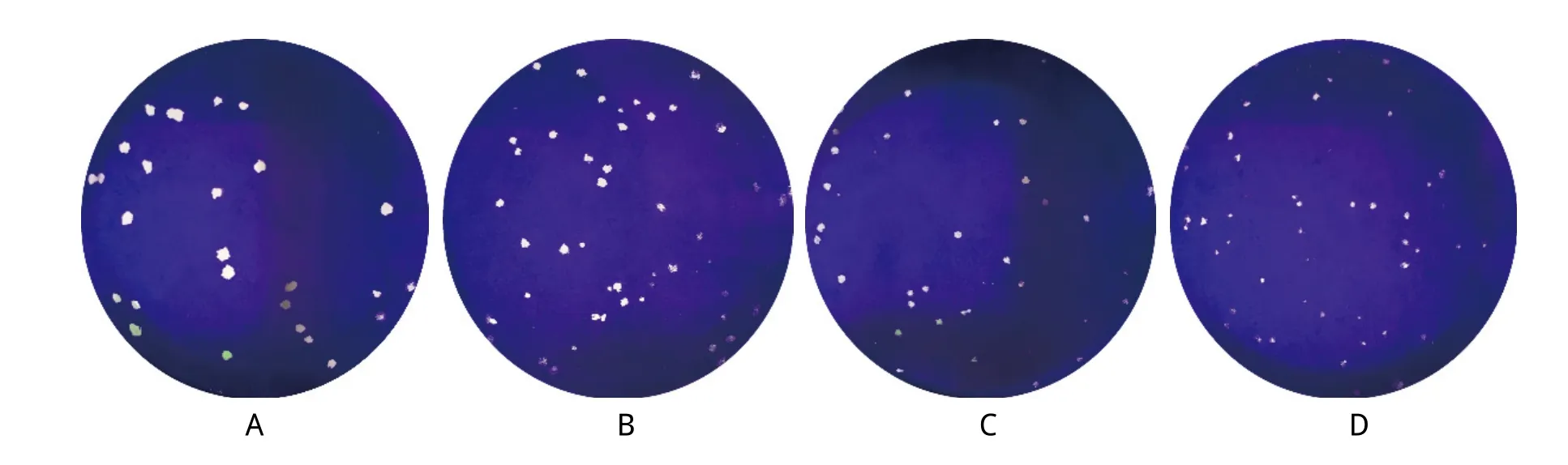
图7 重组病毒与亲本毒空斑形态Fig.7 Plaque morphology of the recombinant virus and parental virus PRV JS-2012A: 亲本毒PRV JS-2012; B: 重组病毒rJS2012-gG/EGFP; C: 重组病毒 rJS2012-gG/loxp; D: 重组病毒rJS2012-BACA: Parental virus PRV JS-2012 ; B: Recombinant virus rJS2012-gG/EGFP; C: Recombinant virus rJS2012-gG/loxp; D: Recombinant virus rJS2012-BAC
1999年PRV BAC(pBecker1)首次构建成功,该研究将F质粒插入PRV-Becker gG基因上游,pBecker1虽然可以在大肠杆菌中稳定增殖,但是转染真核细胞后发现F质粒的部分序列会有自发删除现象[12]。彭金美等[13]将BAC 质粒插入PRV 弱毒疫苗株Bartha K61的 TK基因中,成功的获得了带 BAC质粒的重组伪狂犬病毒 rv-PRVBAC,该重组病毒可以在Vero细胞中稳定遗传。尹文玲等[14]将BAC载体插入PRV TK基因内完成了猪伪狂犬病毒浙江株感染性细菌人工染色体的构建。为了不破坏PRV基因组中任何基因的结构,我们将BAC载体的插入位点选在了gG基因编码区下游,从而保证伪狂犬病毒变异株基因组的完整性,降低了对PRV其他基因功能研究时的潜在影响。
构建PRV细菌人工染色体大多通过一步同源重组,将带有标记基因的BAC载体插入PRV基因组中,筛选出包含完整PRV基因组的阳性克隆[12-14]。一步同源重组的优点是通过一次重组多轮空斑筛选纯化,即可获得重组病毒。本研究利用Cre/loxp系统位置特异性、重组效率高的特点[10],通过多次重组构建了含有BAC载体序列的重组PRV。本研究先通过EGFP标记筛选将loxp位点引入重组病毒,再利用Cre/loxp系统将大片段BAC载体引入重组病毒中,虽然步骤较多,但每步获得阳性重组病毒的几率高,获得含BAC载体的重组病毒也易于实现。同时,后期也可以利用Cre/loxp系统删除插入的BAC载体获得PRV突变毒无痕恢复株,更有利于PRV变异株的分子病原学研究。
从病毒的生长特性来看,在gG编码框下游插入序列的重组病毒的生长动力学与亲本株PRV JS-2012相似,但最高滴度比亲本株低。重组病毒的空斑都比亲本株的偏小,特别是有长片段BAC载体插入的重组病毒空斑偏小更为明显。这表明,gG编码框下游插入序列,特别是BAC载体,对病毒生长存在一定影响。但在重组病毒的设计中,含BAC载体的重组病毒同时携带loxp序列,可以利用Cre/loxp系统删除病毒中BAC载体序列,以消除BAC载体对病毒的影响。
本研究利用Cre/loxp系统构建了含有BAC载体序列的重组病毒,为建立PRV变异株的感染性克隆操作系统奠定了良好基础。
[1] Pomeranz L E, Reynolds A E, Hengartner C J. Molecular biology of pseudorabies virus: impact on neurovirology and veterinary medicine[J]. Microbiol Mol Biol R, 2005, 69(3): 462-500.
[2] V erpoest S, Cay A B, De R egge N. Molecular characterization of Belgian pseudorabies virus isolates from domestic swine and wild boar[J]. Vet Microbiol, 2014, 172(1): 72-77.
[3] An T Q, Peng J M, Tian Z J, et al. Pseudorabies virus variant in Bartha-K61-vaccinated pigs, China, 2012[J]. Emerg Infect Dis, 2013, 19(11): 1749-1755.
[4] Luo Y, Li N, Cong X, et al. Pathogenicity and genomic characterization of a pseudorabies virus variant isolated from Bartha-K 61-vaccinated swine population in China[J]. Vet Microbiol, 2014, 174(1): 107-115.
[5] Tong W, L iu F, Zheng H, et al. Emergence of a Pseudorabies virus variant with increased virulence topiglets[J]. Vet Microbiol, 2015, 181(3): 236-240.
[6] Ye C, Zhang Q Z, Tian Z J, et al. Genomic characterization of emergent pseudorabies virus in China reveals marked sequence divergence: Evidence for the existence of two major genotypes[J]. Virology, 2015, 483: 32-43.
[7] Warden C, Tang Q, Zhu H. Herpesvirus BACs: past, present, and future[J]. Biomed Res Int, 2010, 2011:1-16.
[8] 张达, 朱厚础, 黄留玉. 细菌人工染色体及其在基因组学研究中的应用[J]. 生物技术通讯, 2003, 14(5): 406-409.
[9] Britt W J. Infectious clones of herpesviruses: a new approach for understanding viral gene function[J]. Trends Microbiol, 2000, 8(6): 262-264.
[10] 王立霞, 王勇, 胡鸢雷, 等. Cre 重组酶结构与功能的研究进展[J]. 生物工程学报, 2002, 18(5): 531-535.
[11] 童武, 张青占, 郑浩, 等. 免疫后发病仔猪中伪狂犬病毒的分离和鉴定[J]. 中国动物传染报, 2013, 21(3): 1-7.
[12] Smith G A, Enquist L W. Construction and transposon mutagenesis in Escherichia coli of a full-length infectious clone of pseudorabies virus, an Alphaherpesvirus[J]. J Virol, 1999, 73(8): 6405-6414.
[13] 彭金美, 王瑜, 田志军, 等. 带BAC质粒的重组伪狂犬病毒的构建及其体外生长特性研究[J]. 中国预防兽医学报, 2009, 31(1): 10-15.
[14] 尹文玲, 尹龙勃, 叶伟成, 等. 猪伪狂犬病毒浙江株感染性细菌人工染色体克隆的构建[J]. 病毒学报, 2010, 26(4): 330-335.
CONSTRUCTION OF A RECOMBINANT PSEUDORABIES VIRUS CARRYING A BAC SEQUENCE BY USING CRE/LOXP SYETEM
WANG Tao, TONG Wu, YE Chao, YU Zhi-qing, LIANG Chao, LI Guo-xin, GAO Fei, SHAN Tong-ling, YU Hai, ZHENG Hao, TONG Guang-zhi
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
To develop a reverse genetic system for Pseudorabies virus (PRV), a recombinant PRV carrying a BAC sequence was constructed in the present study. An EGFP expression cassette flanked by a loxp site in both sides was inserted into the downstream of gG coding region of a pseudorabies virus variant strain PRV JS-2012 by homologous recombination, generating a recombinant virus rJS2012-gG/EGFP. BHK-21 cells were transfected with the pcDNA3.1-Cre that expressed Cre recombinase and then infected with rJS2012-gG/ EGFP. A recombinant virus rJS2012- gG/loxp carrying only one loxp site downstream of gG coding region was obtained. Subsequently, the genome of rJS2012-gG/loxp was co-transfected with pcDNA3.1-cre and pBeloBAC11-EGFP into BHK-21 cells, generating a recombinant virus rJS2012-BAC. The recombinant virus rJS2012-BAC carried the BAC vector sequences in its genome and grew slightly slower than its parent strain JS-2012 in vitro. The availability of the recombinant virus rJS2012-BAC would contribute to developing a reverse genetic system for PRV.
Pseudorabies virus variant strain; bacterial artificial chromosome; Cre/loxp syetem
S852.659.1
A
1674-6422(2017)02-0022-07
2016-10-30
国家重点研发计划项目(2016YFD0500100);上海市科技兴农重点攻关项目(沪农科攻字(2016)第4-2号)
王涛,男,硕士研究生,预防兽医学专业
童光志,E-mail:gztong@shvri.ac.cn;郑浩,E-mail:haozheng@shvri.ac.cn

