呼吸道综合征的猪肺中支气管败血波氏杆菌的分离、鉴定及特性分析
张彦兵,黎倩倩,石元元,魏建超,李蓓蓓,刘 珂,邵东华,马志永,孙延鸣,邱亚峰
(1.石河子大学生命科学学院,石河子 832003;2.石河子大学动物科技学院,石河子 832003;3.中国农业科学院上海兽医研究所,上海 200241)
·研究论文·
呼吸道综合征的猪肺中支气管败血波氏杆菌的分离、鉴定及特性分析
张彦兵1,3,黎倩倩2,3,石元元3,魏建超3,李蓓蓓3,刘 珂3,邵东华3,马志永3,孙延鸣1,2,邱亚峰3
(1.石河子大学生命科学学院,石河子 832003;2.石河子大学动物科技学院,石河子 832003;3.中国农业科学院上海兽医研究所,上海 200241)
临床上猪呼吸道综合征(porcine respiratory disease complex,PRDC)大多为多种病原微生物共感染所致,支气管败血波氏杆菌(Bordetella bronchiseptica,Bb)为PRDC的常见病原,但其在PRDC发生中的作用还不十分清楚。为了研究Bb在PRDC中的作用,本研究聚焦于PRDC的猪肺中Bb的分离、鉴定及特性分析。首先,利用16S rRNA基因序列对分离的细菌进行鉴定,结果从15头已鉴定为PRDC的猪肺中共获得5株Bb分离菌株。随后,对Bb相关毒力因子包括皮肤坏死毒素(dermonecrotic toxin,DNT)、百日咳杆菌粘附素(bordetellaad hesin,PRN)以及鞭毛蛋白(flagellin,fla B)进行PCR鉴定,结果发现所有分离株上述毒力因子都为阳性。最后,对Bb分离株进行18种抗生素的药敏实验,发现所有分离株对阿莫西林、头孢噻呋、链霉素、氨苄西林等8种药物高度耐药,而对卡那霉素、美罗培南以及庆大霉素高度敏感;此外,部分菌株对红霉素、氟苯尼考、强力霉素以及阿米卡星耐药。总之,本研究从PRDC的猪肺中分离到5株支气管败血波氏杆菌,这些分离株显示出不同的耐药特性,同时,分离株含有的与毒力相关的毒力因子,暗示了其致病特性。
猪呼吸道综合征;支气管败血波氏杆菌;16S rRAN;毒力因子;耐药性
支气管败血波氏杆菌(B o r d e t e l l a bronchiseptica,Bb)作为一种条件致病菌,是导致哺乳动物呼吸道疾病的重要病原。值得一提的是,研究显示Bb不仅可以导致包括猪、牛、狗等多种哺乳动物的呼吸道疾病,也可以感染人尤其是免疫功能低下的病人,比如AIDS病人等。因此,Bb不仅危害动物的健康,而且对人类健康具有一定的威胁[1]。
Bb广泛地分布于猪群中,尤其是猪的上呼吸道。大多数的情况不引起疾病,但是,当有其它病原存在时,例如Bb与多杀性巴氏杆菌共感染,可以引起猪萎缩性鼻炎[2]。已有研究显示Bb也是导致猪呼吸道综合征(porcine respiratory disease complex,PRDC)的关键病原菌之一。随着我国规模化养猪业的发展,PRDC作为一种由多种病原微生物感染导致的疾病,由于其病症复杂、防治难度大,已成为危害我国养猪业发展的重要疾病。然而,Bb作为PRDC的常见病原,在PRDC的发生中起着何种作用,还不清楚。
研究显示,Bb导致的呼吸道疾病与其表达不同的毒力因子相关。这些毒力因子主要分为两类:黏附素和毒素,其中黏附素类有百日咳杆菌黏附素(pertactin,PRN)、丝状血凝素(filamentous hemagglutinin,FHA)和菌毛(fimbriase)等;毒素类主要有皮肤坏死毒素(dermonecrotic toxin,DNT)、气管细胞毒素(tracheal cytotoxin)[3]等。FHA不仅能调控机体免疫机制,而且可以促进Bb黏附呼吸道上皮。另外,缺失PRN的Bb致病性降低[4]。因此,这些毒力因子对Bb感染的建立具有重要的作用。
Bb药物敏感性的变化影响Bb感染的建立。实际上,Bb在体内和体外对多种抗生素敏感,但是,随着多种抗生素的联合用药或滥用药,使得Bb的药物敏感性发生了变化,出现了一些耐药性菌株,从而有利于Bb建立感染。因此,在有PRDC的猪肺脏中,Bb分离株的药物敏感性如何变化需要进一步的研究。
为了揭示Bb在猪呼吸道综合征发生中的作用,本研究在上海市不同规模化养猪场中采集有呼吸道综合征的猪肺脏,对其Bb的感染情况以及不同Bb分离株的毒力因子和药物敏感性进行了分析。
1 材料与方法
1.1 试剂 胰蛋白酶大豆琼脂(Tryptic Soy Agar,TSA)和胰蛋白酶大豆肉汤(Tryptic Soy Broth,TSB)购自英国Oxoid公司;新生牛血清购自杭州四季青公司;烟酰胺腺嘌呤二核苷酸(Nicotinamide Adenine Dinucleotide,NAD,又称 V因子)购自中国医药(集团)上海化学试剂公司;CTAB(十六烷基三甲基溴化铵)购自生工生物工程(上海)股份有限公司;药敏纸片购自赛默飞世尔科技(中国)有限公司;DNA Marker,2×Tap PCR MasterMix 购自天根生化科技(北京)有限公司。
1.2 细菌的分离及培养 2014年6月~2015年1月,从上海市周边地区6个大型的养猪场中收集有呼吸道症状的猪,共计22头,剖检后取出肺脏。在超净工作台中无菌取新鲜肺脏组织,涂布TSA平板(含有5%的新生牛血清、10 μ g/mL的NAD),37℃倒置培养18~24 h。然后挑取细菌单菌落,利用TSA平板进行细菌纯化,用于后续的细菌鉴定及耐药性分析。同时,剪切适量的肺脏组织用10%的中性福尔马林固定,用于病理组织分析。
1.3 细菌鉴定 在超净工作台中无菌挑取纯化的细菌,基于16S rRNA[5](27F:5'-AGAGTTTGATCCT
GGCTCAG-3';1492R:5'-ACGGCTACCTTGTTA CGACTT-3')进行PCR扩增,反应条件:95℃预变性5 min;95℃变性45 s,55℃退火45 s,72℃延伸90 s;30个循环;72℃再延伸7 min。对PCR产物进行测序分析(上海桑尼生物公司),并对测序结果利用NCBI的Blast软件进行序列的同源性比对,根据比对的结果对分离细菌进行鉴定。
1.4 细菌毒力基因的PCR分析 根据文献[6-8],本研究选取PRN、DNT、fla B毒力基因进行引物设计,具体的引物序列见表1,所用引物由上海桑尼生物公司合成。PRN的PCR扩增:95℃预变性5 min,进入30个循环:95℃变性30 s,60℃退火30 s,72℃延伸45 s;最后72℃延伸10 min;DNT的PCR扩增:95℃预变性5 min,进入35个循环:95℃变性15 s,55℃退火15 s,72℃延伸45 s;最后72℃延伸10 min;fla B的PCR扩增:94℃预变性4 min,进入25个循环:94℃变性30 s,56℃退火30s,72℃延伸60 s;最后72℃延伸10 min。最后,利用1%的琼脂糖凝胶对PCR产物进行分析,并对阳性的PCR产物进行序列分析。
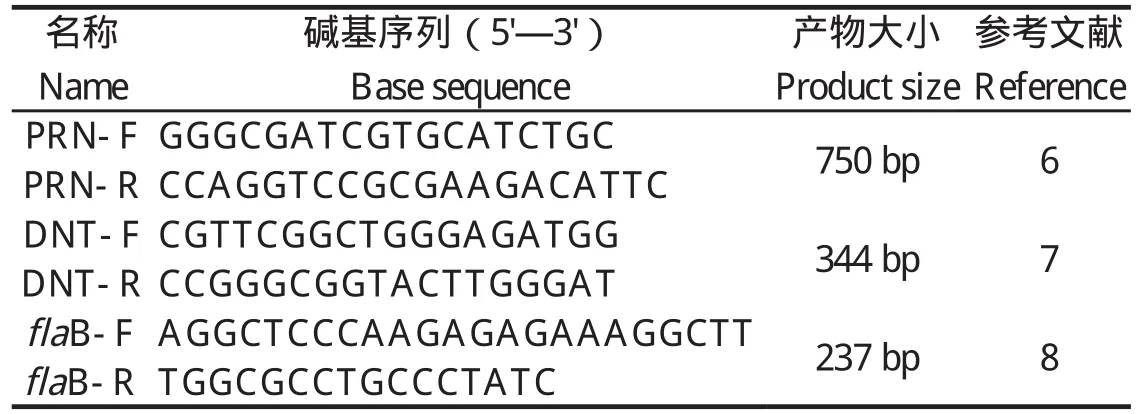
表1 引物序列Table 1 Primer sequences
1.5 细菌耐药性分析 首先进行细菌的复苏[9],按照上述条件进行细菌培养。挑取单菌落于800 μ L TSB(含有5%的新生牛血清、10 μ g/mL的NAD)中,37℃震荡培养过夜。然后5000×g离心5 min,收集菌体,将菌体沉淀用TSB稀释至OD600约为0.6,取40 μ L用棉签均匀涂布TSA平板待菌液完全吸收,贴药敏纸片,37℃培养18~24 h,测量抑菌圈进行耐药性分析。
2 结果
2.1 呼吸道综合征的猪肺脏中支气管败血波氏杆菌的分离及鉴定 为了研究有呼吸道综合征的猪肺脏中支气管败血波氏杆菌的感染情况,对临床上收集的22头有呼吸道症状的猪肺脏进行细菌的分离鉴定及病理组织切片分析。病理组织切片结果显示,共有15头猪表现呼吸道综合征(结果未显示)。通过16S rRNA的扩增及序列比对,从这15头表现为呼吸道综合征的猪肺脏中,共鉴定出5株支气管败血波氏杆菌,结果见表2。同时,对其他7头猪肺脏的分离细菌进行了鉴定,但未鉴定出支气管败血波氏杆菌的感染(结果未显示)。这一结果暗示支气管败血波氏杆菌感染在猪呼吸道综合征中起着一定的作用。

表2 支气管败血波氏杆菌分离株来源Table 2 Source of Bordetella bronchiseptica isolated in this study
2.2 不同支气管败血波氏杆菌分离株毒力基因的鉴定 为了弄清支气管败血波氏杆菌分离株中毒力基因的分布情况,对纯化的分离株进行基因组提取,利用PCR方法对支气管败血波氏杆菌的毒力因子flaB、DNT及PRN分别进行扩增,PCR产物进行1%琼脂糖凝胶电泳验证。结果显示,这些基因的扩增与预期大小相符(图1)。
2.3 不同支气管败血波氏杆菌分离株药物敏感性分析 为了进一步揭示支气管败血波氏杆菌的潜在致病机制,我们对不同分离株的耐药性进行分析,共选择18种药物(包括常见动物用药)进行药敏试验。结果显示5株分离株分别对阿莫西林、头孢噻呋、氨 西林等8种药物表现100%耐药率;对替米考星和萘啶酸部分耐药,耐药率分别为80%和70%。这些分离株仅对卡那霉素、美罗培南以及庆大霉素3种药100%敏感;对阿米卡星、氟苯尼考、红霉素等5种药物的敏感率为90%(表3)。结果显示在肺脏建立感染的过程中,支气管败血波氏杆菌分离株已经不同程度地演化具备了耐药的特性,另外,在分离株之间,耐药性也存在一定差异。
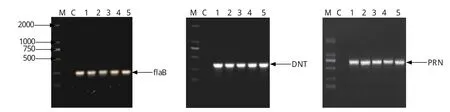
图1 支气管败血波氏杆菌毒力因子fl a B、DNT及PRN基因PCR扩增产物Fig.1 PCR products of fl a B, DNT, and PRN gene from BbM: DNA分子量标准(DL2000); C: 阴性对照; 1~5:不同的分离菌株M: DNA Marker(DL2000); C: Negative control; 1-5: Different isolates of Bb

表3 支气管败血波氏杆菌分离株对18种药物的抗药谱Table 3 Drug sensitivity of Bb isolates to 18 drugs
3 讨论
本研究从15头已鉴定为呼吸道综合征的猪肺脏中分离到5株支气管败血波氏杆菌。对携带毒力基因的情况进行分析,结果发现这些分离株都含有毒力因子flaB、DNT及PRN。此外,对分离株的药物敏感性进行分析,结果显示这些分离株表现出一定程度的耐药性。因此,Bb分离株所具备的这些特性可能为Bb在猪肺脏中建立感染及促进PRDC的发生中起着重要的作用。
Bb可通过双组份调节系统(BvgAS)调控基因的表达[10]。本研究的所有分离株中含有flaB、DNT及PRN等毒力因子[10,11],当在Bb与宿主细胞相互作用的过程中,可以通过双组份调节系统控制这些基因的表达,应对环境的变化及清除。因此,在猪感染的过程中,这些毒力因子的表达调控不仅影响Bb的生存,同时对Bb的免疫致病起着重要的作用。但是,这些毒力因子是如何在体内被调控表达,还需要进一步研究。
Bb作为一种条件致病菌,建立感染往往伴随其他病原微生物的感染[12,13]。我们的研究发现在有Bb感染的猪肺脏中,还存在其它不同病原微生物的感染,如多杀性巴氏杆菌(Pasteurella multocida)、胸膜肺炎放线杆菌(Actinobacilluspleuropneumoni ae)、猪链球菌(Streptococcus suis)、猪繁殖与呼吸综合征病毒、圆环病毒2型等(结果未显示)。目前为止,虽还未发现Bb单独感染致病的情况,但不能排除这种可能。
我们研究发现Bb分离株的药物敏感性已发生了变化。本研究中分离菌株对庆大霉素、红霉素、卡拉霉素敏感,这与赵战勤等[14]的报道类似,但部分菌株已显示对红霉素、卡拉霉素耐药。另外,与文献[15,16]报道不同,大部分分离菌株已显示对替米考星的耐药。值得注意的是,部分菌株已出现了对阿米卡星、氟苯尼考、阿莫西林等药物的耐药。另外,在不同分离株之间,药物敏感性存在着细微的差别,这可能与分离株猪场的环境相关,即这些Bb分离株药物敏感性的变化有利于Bb适应有抗生素的环境,从而建立感染。这些分离株药物敏感性的变化,暗示着Bb的演化。另外,需要注意的是某些分离株的抗药特性,如对氟苯尼考等的耐药,可能对将来药物的防控带来威胁。
Bb作为猪群中的常在病原菌,在PRDC中的作用还不清楚。本研究从有PRDC的猪肺脏中分离鉴定出5株Bb,通过对毒力因子和药物敏感性分析,发现这些分离株的潜在致病特性。下一步研究中,我们将通过小鼠模型对这些分离株的致病特性进行评估,通过基因组测序技术对其基因组进行分析,不仅对其毒力因子进行挖掘,而且对其耐药性改变提供理论依据,最终为解析Bb在PRDC中作用奠定基础。
[1] 赵战勤, 裴洁, 薛云, 等. 猪源支气管败血波氏杆菌的分离鉴定及生物学特性研究[J]. 中国农业科学, 2008, 41(12): 4209-4217.
[2] Erich V, Jeffrey A, Amanda J, et al. Cooperative roles for fimbria and filamentous hemagglutinin in Bordetella adherence and immune modulation[J]. MBio, 2015, 3(6): 1-10.
[3] 陆承平. 兽医微生物学[M]. 3版. 北京: 中国农业出版社, 2001: 132-134.
[4] MattooS,C herry J D.Molecular pathogenesis, epidemiology, and clinical manifestations of respiratory infections due to Bordetellapertussis and other Bordetella subspecies[J]. Clin Microbiol Rev, 2005, 18(2): 326-382.
[5] Katsumi Doi, OngThiAhnPhuong, FagyunKawatou, et al. Identification and Characterization of Lactic Acid Bacteria Isolated from Fermented Rice Bran Product[J]. Adv Microbiol, 2013, 3: 265-272.
[6] 李洪广, 王芳, 姜平, 等. 兔支气管败血波氏杆菌PRN基因缺失突变株的构建及特性研究[J]. 畜牧兽医学报, 2012, 43(2): 299-305.
[7] 覃娟娟, 顾凡, 蔡雨涵, 等. 副猪嗜血杆菌毒力菌株和猪支气管败血波氏杆菌毒力菌株双重 PCR 检测方法的建立及应用[J]. 中国兽医学报, 2015, 35 (8):1217-1218.
[8] Hozbor D, F ouque F, Guiso N. Detection of Bordetellabronchiseptica by the polymerase chain reaction[J]. Res Microbiol, 1999, 150(5): 333-341.
[9] 陈溥言. 兽医传染病学[M]. 5版. 北京: 中国农业出版社, 2008: 209-269.
[10] Brockmeier S L, Register K B, Magyar T, et al. Role of the dermonecrotic toxin of Bordetellabronchiseptica in the pathogenesis of respiratory disease in swine[J]. Infect Immun, 2002, 70(2): 481-490.
[11] 蔡宝祥. 家畜传染病学[M]. 3版. 北京: 中国农业出版社, 2001, 198-201.
[12] Chanter N, Magyar T, Rutter J M, et al. Interactions between Bordetella bronchiseptica and toxigenic Pasteurella multocida in atrophic rhinitis of pigs[J]. Res Vet Sci, 1989, 47(1): 48-53.
[13] Brockmeier S L, Loving C L, NicholsonT L, et al. Coinfection of pigs with porcine respiratory coronavirus and Bordetellabronchiseptica[J]. Vet Microbiol, 2008, 128(1-2): 36-47.
[14] 赵战勤, 裴洁, 薛云, 等. 猪源支气管败血波氏杆菌的分离鉴定及生物学特性研究[J]. 中国农业科学, 2008, 41( 12): 4209 -4217.
[15] 王晓芳, 刘燕, 肖琛闻, 等. 兔支气管败血波氏杆菌的分离鉴定及耐药基因检测[J]. 中国畜牧兽医, 2015, 4(3): 544-548.
[16] 李爽, 元娜, 张杏, 等. 猪支气管败血波氏杆菌的分离鉴定[J]. 中国兽医杂志, 2016, 4(52): 51-53.
IDENTIFICATION AND CHARATERIZATION OF BORDETELLA BRONCHISEPTICA ISOLATED FROM LUNGS OF PIGS WITH PORCINE RESPIRATOTY DISEASE COMPLEX
ZHANG Yan-bing1,3, LI Qian-qian2,3, SHI Yuan-yuan3, WEI Jian-chao3, LI Bei-bei3, LIU Ke3, SHAO Dong-hua3, MA Zhi-yong3, SUN Yan-ming2, QIU Ya-feng3
(1.College of Life Science, Shihezi University, Shihezi 832003, China;2.College of Animal Science and Technology, Shihezi University, Shihezi 832003,China;3.Shanghai Veterinary Research Institute, CAAS, Shanghai 200241)
Porcine respiratory disease complex (PRDC) is usually characterized with polymicrobial lung infections. Although Bordetella bronchiseptica (Bb) can be commonly isolated from lungs of PRDC, how Bb lung infection contributes to PRDC remains unknown. To address effect of Bb lung infection on pathogenesis of PRDC, this study focused on identification and characterization of Bb isolated fromlungs of pigs with PRDC. Firstly, 5 Bb isolates were obtained from 15 pig lungs with PRDC and identified based on 16s RNA sequencing analysis. These 5 Bb isolates were then characterized for their virulence genes and antimicrobial resistance. The results demonstrated that all of 5 isolates contained dermonecrotic toxin (DNT), Bordetella adhesin (PRN) and flagellin (fla B) in their genomes. Furthermore, these isolates were tested on 18 selected drugs for their antimicrobial resistance. All of 5 isolates were found to be highly resistant to 8 drugs including amoxicillin, ceftiofur, streptomycin and ampicillin. Some strains appeared resistant to erythromycin, florfenicol, doxycycline or amikacin. In contrast, all of them were sensitive to kanamycin, meropenem and gentamicin.
PRDC; Bordetella bronchiseptica; 16S rRAN; virulence; drug resistance
S852.612
A
1674-6422(2017)02-0061-05
2016-10-31
中国农业科学院上海兽医研究所中央级公益性科研院所基本科研业务费专项资金项目(2014JB06);上海市科技兴农重点攻关项目(沪农科攻字(2013)第5-6号);上海市生猪产业技术体系建设项目 (沪农科产字2015第6号)
张彦兵,男,硕士研究生,动物学专业
邱亚峰,E-mail:yafengq@shvri.ac.cn;孙延鸣,E-mail:sym@shzu.edu.cn

